近日,中国科学院广州生物医药与健康研究院研究员林达团队与上海市第一人民医院实验动物中心主任杨玉琴团队开发出单细胞多组学技术-Uniform Chromosome Conformation Capture(Uni-C)。该方法可在一个细胞中同时解析基因组大尺度结构变异(如SV、CNV、ecDNA)、小尺度突变(SNP/INDEL)以及染色质三维构象,实现高分辨率、多维度的联合分析。相关成果发表于《自然-通讯》。
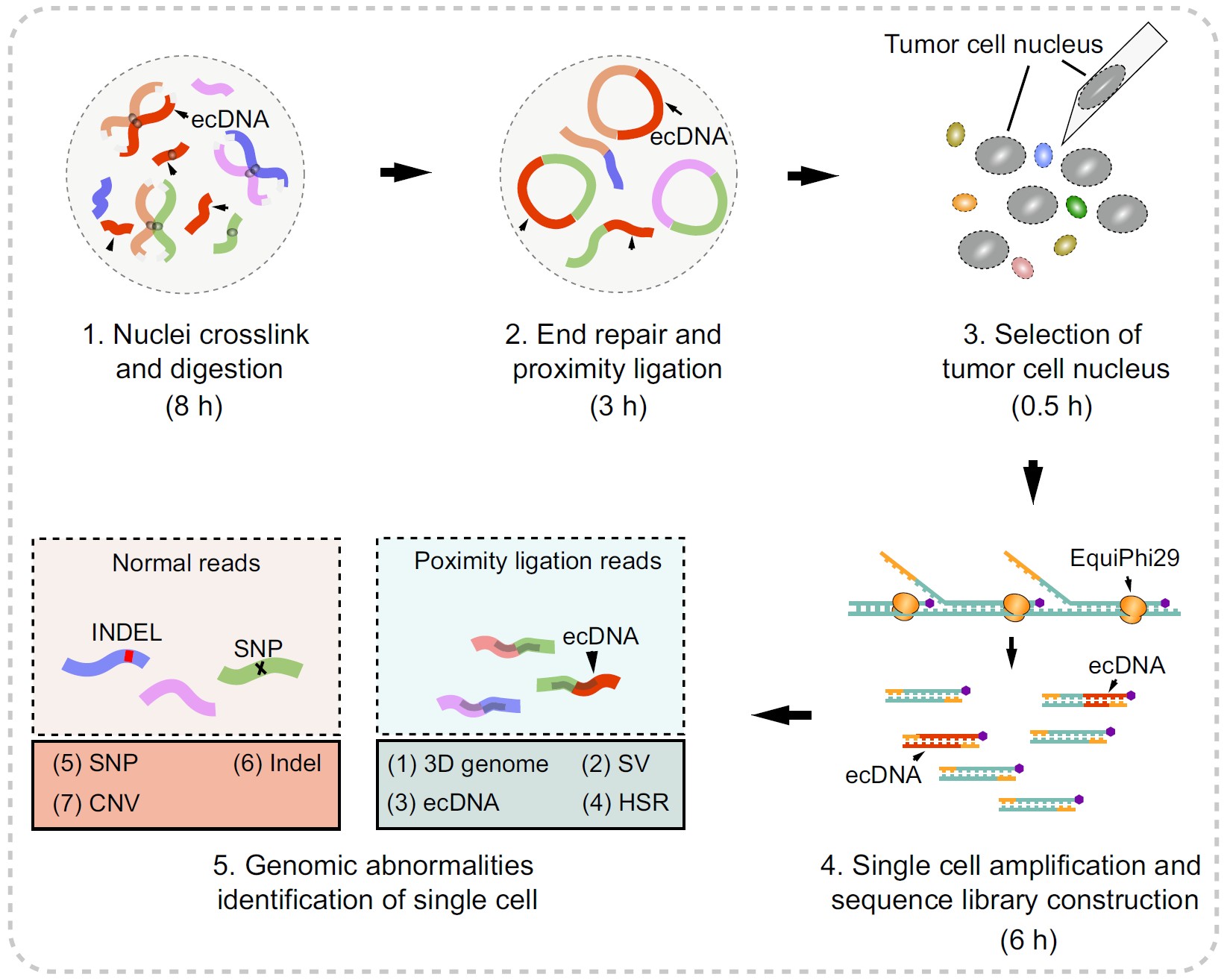 Uni-C单细胞多维组学测序文库构建流程。研究团队供图
Uni-C单细胞多维组学测序文库构建流程。研究团队供图
胰腺癌异质性强、进展迅速,临床面临早筛困难、治疗靶点匮乏等挑战。循环肿瘤细胞(CTCs)因携带原发瘤的完整基因组信息,被视为无创检测和动态监测的重要窗口。然而,CTCs数量稀少、单细胞分析难度高,亟需关键检测技术。
研究团队利用Uni-C技术对胰腺癌来源的CTCs进行分析,仅整合7个细胞数据,即可还原约89%的SNP/INDEL与75%的结构变异,与肿瘤组织检测结果高度一致,验证了该方法在稀有细胞中的准确性与代表性。进一步分析发现,Uni-C可解析CTC中ecDNA的分子结构,以及处于细胞周期不同阶段CTC所展现出的染色质构象差异,如A/B隔室重构与高阶结构消失等,为评估CTC活性与细胞状态提供了新维度。
值得注意的是,染色质三维结构不仅承载空间信息,还与基因表达密切相关。Uni-C所获取的单细胞层面染色质构象数据,为揭示基因组结构变异与转录调控网络之间的潜在关联提供了可能。例如,不同细胞周期阶段的染色质折叠状态,反映了转录活性变化,提示Uni-C在探索肿瘤细胞异质性调控机制方面具有重要潜力。
在功能应用方面,研究结合Uni-C所获突变数据开展个体化新抗原预测,并通过合成多肽与动物实验验证部分候选新抗原具备明确免疫原性,联合免疫治疗可有效抑制肿瘤生长,展现出良好的治疗潜力。
该研究首次在单细胞水平实现了对CTCs中多类型基因组异常与染色质构象的联合解析,并具备探索其在转录调控与免疫应答中的功能意义的能力。Uni-C为稀有肿瘤细胞的演化追踪、靶点发现与个体化治疗提供了有力技术支撑,推动单细胞多组学在肿瘤精准医学中的转化应用。
相关论文信息:https://doi.org/10.1038/s41467-025-62215-w
