1. 领域背景与文献引入
文献英文标题:NPC1 as a novel therapeutic target for induction of pyroptosis in cancers;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤代谢与细胞死亡调控(胆固醇代谢重编程与焦亡机制)。
代谢重编程是癌症的核心特征之一,涵盖有氧糖酵解(Warburg效应)、谷氨酰胺依赖及脂质代谢重塑等。其中,胆固醇代谢重编程是脂质代谢的关键方向——癌细胞因快速增殖对胆固醇需求激增,形成“胆固醇依赖”,主要通过摄取低密度脂蛋白(LDL)或增强从头合成满足需求,但这一过程的调控机制尚未完全阐明。焦亡是近年来备受关注的程序性细胞死亡方式,由gasdermin(GSDM)家族蛋白介导:caspase-1切割GSDM D(GSDMD)释放N端结构域,在细胞膜形成孔道导致细胞肿胀、破裂,同时释放HMGB1、IL-1β等促炎因子。癌细胞虽对焦亡敏感,但可通过代谢重编程抵抗焦亡,其具体机制仍不清楚。
Niemann-Pick C1(NPC1)是内体/溶酶体膜上的胆固醇转运蛋白,负责将LDL来源的胆固醇从内体转运至其他细胞器(如内质网、高尔基体),在正常细胞胆固醇稳态中起关键作用。然而,NPC1在癌症胆固醇依赖中的功能,尤其是与焦亡调控的关联,尚未见系统研究。这一空白提示,解析NPC1在癌细胞胆固醇代谢与焦亡抵抗中的作用,可能为癌症治疗提供新靶点。
2. 文献综述解析
作者在综述中系统梳理了三大研究方向:
(1)癌症代谢重编程:强调胆固醇代谢重编程是癌细胞适应快速增殖的关键,癌细胞通过“胆固醇依赖”维持膜合成、信号通路激活等过程,但LDL摄取与胆固醇稳态的调控机制不清;
(2)NPC1的生物学功能:作为内体胆固醇转运的“分子开关”,NPC1突变会导致胆固醇在内体堆积,引发尼曼-皮克病,但在癌症中的表达及功能未明;
(3)焦亡的调控机制:caspase-1/GSDMD通路是焦亡的核心,但癌细胞通过何种代谢途径抵抗焦亡,尤其是胆固醇代谢与焦亡的关联,尚无报道。
基于此,作者指出现有研究的两大不足:一是NPC1在癌症胆固醇代谢重编程中的作用未被解析,二是癌细胞抵抗焦亡的代谢调控机制仍待阐明。本研究正是针对这两个问题,探索NPC1作为胆固醇代谢与焦亡调控的关键节点,及其作为治疗靶点的潜力。
3. 研究思路总结与详细解析
本研究以“NPC1是否通过调控胆固醇代谢保护癌细胞免受焦亡”为核心科学问题,采用“临床数据挖掘-细胞功能验证-动物模型验证-机制解析-治疗潜力评估”的闭环路线,逐步阐明NPC1在癌症中的作用及机制。
3.1 临床数据挖掘与NPC1表达特征分析
实验目的:明确NPC1在人类癌症中的表达模式及与预后的关联。
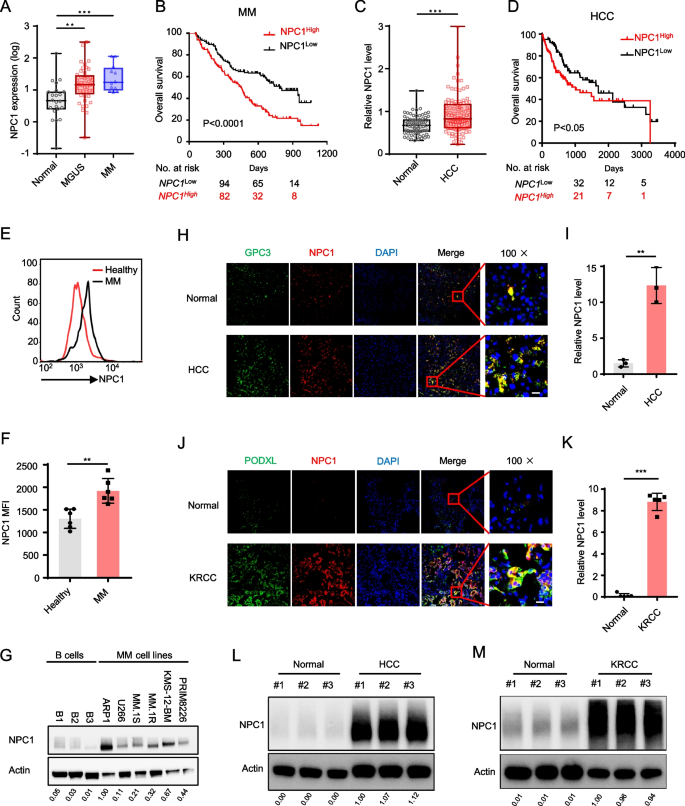
方法:分析Zhan多发性骨髓瘤(MM)数据集(健康对照n=22、MGUS n=44、MM n=12)、GEO Chen肝癌数据集(正常肝组织n=76、肝细胞癌HCC n=104)及TCGA多癌种数据,评估NPC1 mRNA表达与患者生存的关系;通过免疫荧光、Western blot及流式细胞术,验证临床MM样本(健康供体n=6、MM患者n=6)、MM细胞系(ARP-1、RPMI-8226)及实体瘤样本(HCC、肾细胞癌KRCC)的NPC1蛋白表达。
结果:NPC1 mRNA在MM、HCC及多癌种中显著高表达(MM患者vs健康对照,P<0.01);MM患者血浆细胞中NPC1平均荧光强度(MFI)较健康供体高2.3倍(n=6,P<0.01);HCC、KRCC组织中NPC1与肿瘤细胞共定位且表达升高。
产品关联:实验所用关键抗体包括Abcam的NPC1抗体(货号ab134113)、Proteintech的LDLR抗体(货号10785-1-AP)、CST的caspase-1抗体(货号3866)等。
3.2 NPC1缺失对癌细胞生长的影响
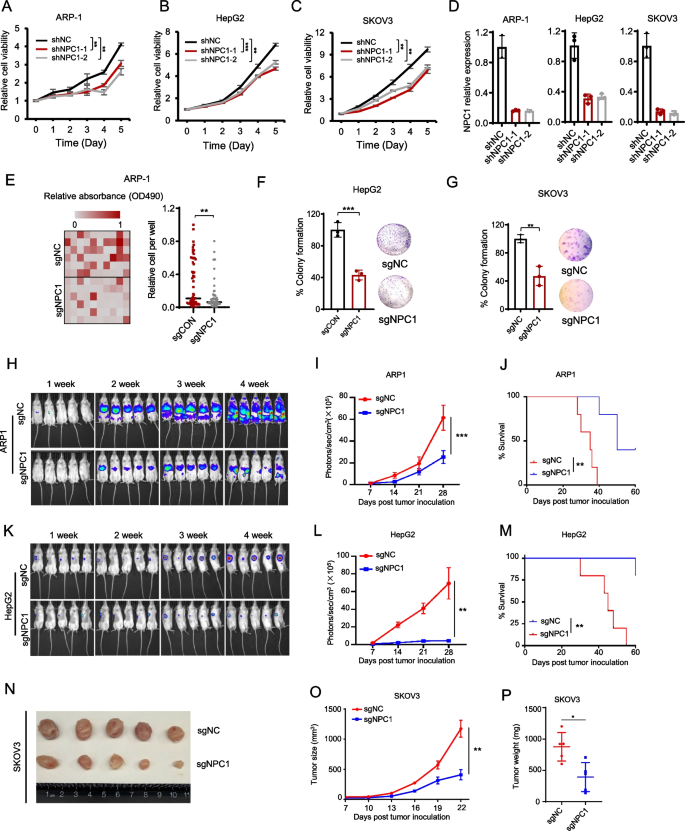
实验目的:探究NPC1对癌细胞增殖与肿瘤形成的调控作用。
方法:构建NPC1 shRNA(靶向序列#1: CCACAAGTTCTATACCATATT;#2: GCCCGACTTATAGCCAGTAAT)或sgRNA(靶向序列CGTGTTATACGGTGAAAGAG)敲低/敲除的癌细胞系(MM细胞ARP-1、肝癌细胞HepG2、卵巢癌细胞SKOV3),通过细胞活力实验(Promega G3580)、克隆形成实验检测体外生长;构建异种移植瘤模型(NSG小鼠尾静脉注射luc标记的sgNC/sgNPC1 ARP-1细胞,或皮下注射SKOV3细胞),监测肿瘤负荷(生物发光成像)及生存期。
结果:NPC1敲低/敲除显著抑制ARP-1、HepG2、SKOV3细胞活力(ARP-1 shNPC1 vs shNC,P<0.01)及克隆形成能力;动物模型中,NPC1缺失显著降低肿瘤负荷(ARP-1模型:sgNPC1组生物发光信号较sgNC组降低70%,n=5,P<0.001),延长生存期(ARP-1模型:sgNPC1组中位生存期56天vs sgNC组32天,P<0.01)。
产品关联:使用了Promega的细胞活力试剂(货号G3580)、Helena的QuickGel SPE Kit(货号3405)检测小鼠血清M带。
3.3 NPC1对癌细胞焦亡的保护作用
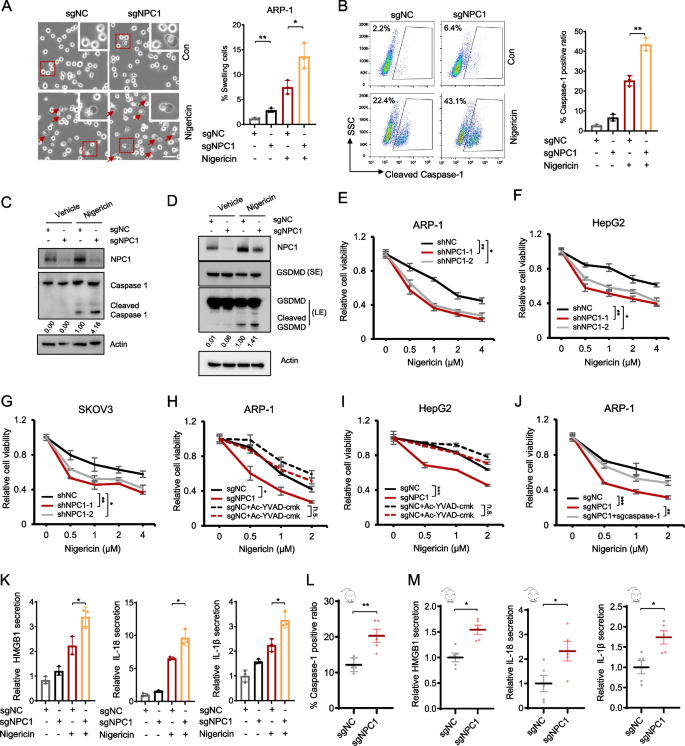
实验目的:验证NPC1是否抑制癌细胞焦亡。
方法:对NPC1敲低/敲除的ARP-1、HepG2细胞,用焦亡诱导剂nigericin(MCE,HY-127019)处理,通过相差显微镜观察细胞肿胀(焦亡特征)、Western blot检测焦亡标志物(cleaved caspase-1、cleaved GSDMD)、流式细胞术检测PI阳性细胞(细胞死亡);同时用caspase-1抑制剂Ac-YVAD-cmk(MCE,HY-16990)或caspase-1敲除验证焦亡通路的必要性。
结果:NPC1缺失显著增加nigericin诱导的细胞肿胀(ARP-1 sgNPC1组肿胀细胞比例较sgNC组高40%,n=3,P<0.001)、cleaved caspase-1/GSDMD表达及PI阳性率;Ac-YVAD-cmk或caspase-1敲除可完全逆转NPC1缺失的焦亡敏感性。
产品关联:使用了MCE的nigericin(货号HY-127019)、Ac-YVAD-cmk(货号HY-16990)。
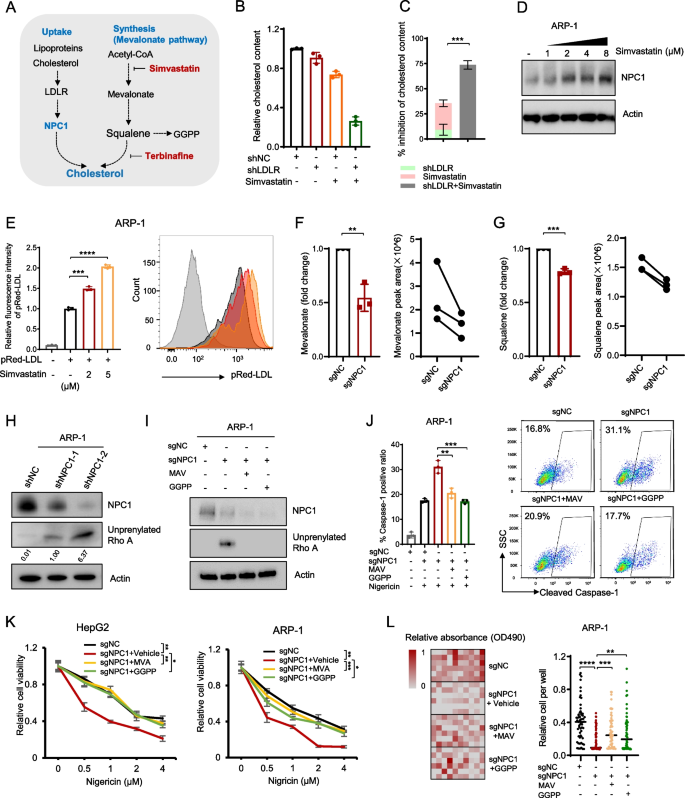
3.4 NPC1通过LDL摄取维持胆固醇稳态抵抗焦亡
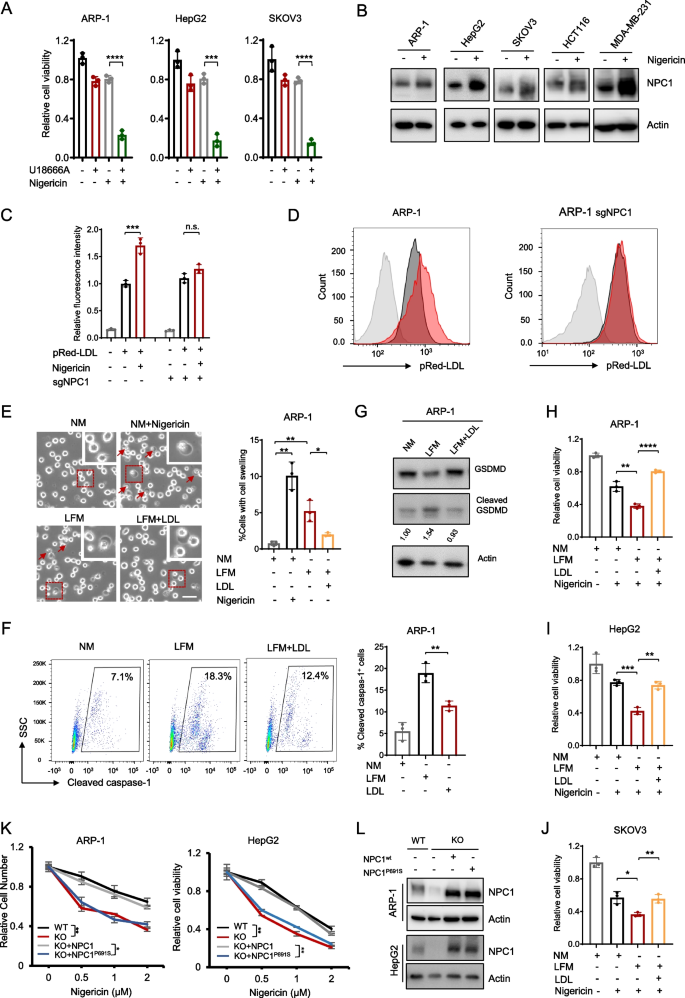
实验目的:探究NPC1调控焦亡的代谢机制是否依赖LDL摄取。
方法:用NPC1抑制剂U18666A(MCE,HY-107433)处理细胞,检测nigericin敏感性;用脂质-free培养基(LFM)培养ARP-1、HepG2细胞,回补LDL(Invitrogen,L3486)或野生型/突变型NPC1(P691S,胆固醇转运缺陷),检测细胞肿胀、cleaved GSDMD表达及细胞活力。
结果:U18666A处理显著增加nigericin诱导的焦亡(ARP-1 U18666A组细胞活力较对照组降低50%,n=3,P<0.001);LFM培养使细胞更易发生焦亡,回补LDL可逆转(ARP-1 LFM组肿胀细胞比例35% vs LFM+LDL组10%,n=3,P<0.01);野生型NPC1可回补NPC1-KO细胞的焦亡抗性,而P691S突变体无效。
产品关联:使用了MCE的U18666A(货号HY-107433)、Invitrogen的pRed-LDL(货号L34356)。
3.5 甲羟戊酸通路代谢物GGPP介导NPC1的焦亡调控
实验目的:解析NPC1下游调控焦亡的分子通路。
方法:整合NPC1关联胆固醇代谢基因与焦亡相关基因,筛选到甲羟戊酸(MVA)通路(合成胆固醇与香叶基香叶基焦磷酸GGPP);用simvastatin(MVA通路抑制剂,MCE,HY-17502)处理细胞,检测GGPP水平及RhoA prenylation(Western blot检测未prenylated RhoA);回补MVA(Sigma,43987)或GGPP(Sigma,G6025),检测cleaved caspase-1表达及细胞活力。
结果:NPC1缺失显著降低GGPP水平(ARP-1 sgNPC1组GGPP较sgNC组降低60%,n=3,P<0.001),增加未prenylated RhoA;回补MVA或GGPP可逆转NPC1缺失诱导的焦亡(ARP-1 sgNPC1+GGPP组cleaved caspase-1水平较sgNPC1组降低40%,n=3,P<0.01)。
产品关联:使用了Sigma的GGPP(货号G6025)、MVA(货号43987)、MCE的simvastatin(货号HY-17502)。
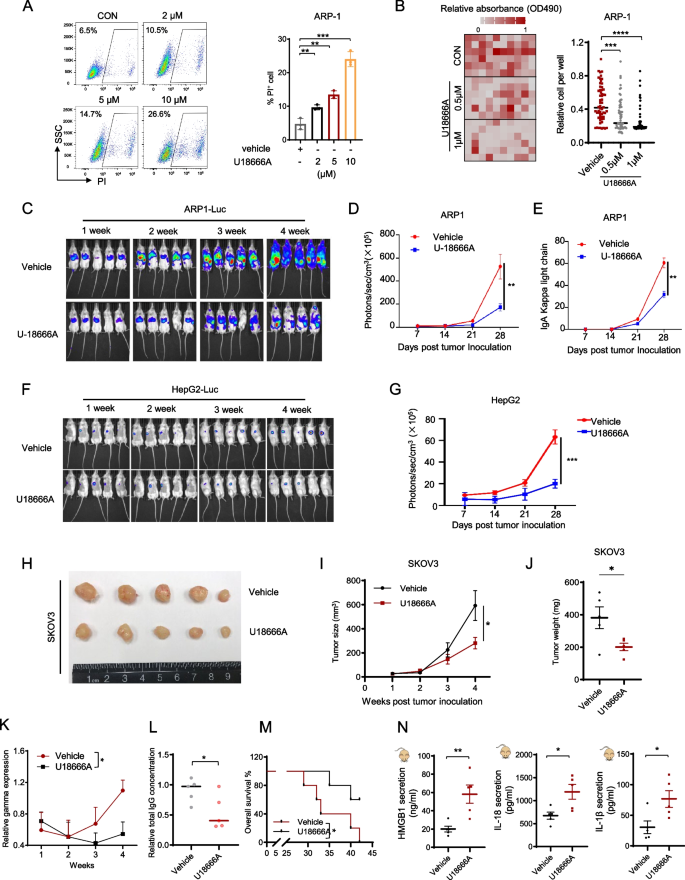
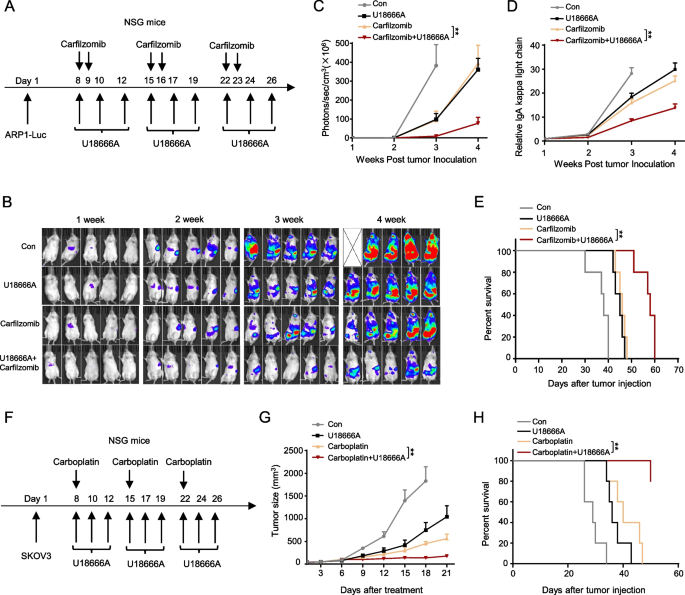
3.6 NPC1抑制剂U18666A的治疗潜力评估
实验目的:验证NPC1作为治疗靶点的可行性。
方法:用U18666A单药或联合化疗(carfilzomib、epirubicin、carboplatin)处理细胞,检测细胞活力;构建异种移植瘤模型(ARP-1、HepG2、SKOV3)及自发MM模型(VkMYC小鼠),评估U18666A的体内疗效(肿瘤负荷、生存期、血清IgG水平)。
结果:U18666A单药显著抑制肿瘤生长(SKOV3模型:U18666A组肿瘤重量0.5g vs对照组1.2g,n=5,P<0.001);联合化疗增效(ARP-1 U18666A+carfilzomib组肿瘤负荷较单药组降低60%,n=5,P<0.01);VkMYC模型中,U18666A处理延长生存期(中位生存期45天vs对照组30天,n=10,P<0.01),降低血清IgG水平(U18666A组1.2mg/ml vs对照组2.5mg/ml,n=10,P<0.001)。
产品关联:使用了MCE的carfilzomib(货号HY-10455)、epirubicin(货号HY-13624)、carboplatin(货号HY-17393)。
4. Biomarker研究及发现成果解析
本研究中,NPC1作为潜在的癌症Biomarker,其表达特征与功能关联为癌症诊断与治疗提供了新线索。
Biomarker定位
NPC1是胆固醇代谢相关的蛋白Biomarker,筛选逻辑为“临床数据挖掘(TCGA、GEO)→细胞系验证→临床样本验证→功能验证(焦亡调控)”,覆盖“表达-预后-功能”的完整链条。
研究过程详述
NPC1的来源包括临床癌组织(MM、HCC、KRCC)、癌细胞系(ARP-1、HepG2、SKOV3)及患者血浆细胞;验证方法涵盖qRT-PCR(mRNA表达)、Western blot(蛋白表达)、免疫荧光(组织定位)、流式细胞术(细胞表面表达);特异性与敏感性数据:
- MM患者血浆细胞中NPC1 MFI较健康对照高2.3倍(n=6,P<0.01);
- HCC患者中NPC1高表达组5年生存率(30%)显著低于低表达组(60%,n=207,P<0.001);
- TCGA多癌种分析显示,NPC1高表达与肺癌、乳腺癌等10种癌症的不良预后相关(HR=2.1,95%CI 1.5-2.9,P<0.001)。
核心成果提炼
- 预后Biomarker:NPC1在MM、HCC及多癌种中高表达,是独立预后因子——高表达患者生存期缩短2倍以上(P<0.001);
- 功能Biomarker:NPC1通过调控LDL摄取与MVA通路维持胆固醇稳态,保护癌细胞免受焦亡,是胆固醇代谢与焦亡关联的关键节点;
- 治疗靶点Biomarker:NPC1抑制剂U18666A单药或联合化疗可显著抑制肿瘤生长,为癌症治疗提供了新的代谢靶点。
本研究首次揭示NPC1在癌症焦亡调控中的作用,将胆固醇代谢重编程与焦亡抵抗联系起来,为癌症治疗提供了“代谢干预+细胞死亡诱导”的双重策略,具有重要的临床转化价值。
