1. 领域背景与文献引入
文献英文标题:IGSF11 and VISTA: a pair of promising immune checkpoints in tumor immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗。
肿瘤免疫治疗是当前肿瘤治疗的核心策略之一,以PD-1/PD-L1、CTLA-4等免疫检查点为靶点的抑制剂已在临床广泛应用。然而,现有治疗仍面临两大瓶颈:响应率低(如非小细胞肺癌(NSCLC)中抗PD-1/PD-L1单药或联合治疗的响应率仅约30%)、免疫相关不良反应(irAEs)发生率高(如22项临床试验中,抗CTLA-4抑制剂的irAEs发生率近70%)。因此,寻找响应率更高、irAEs更低的新型免疫检查点成为当务之急。
IGSF11(免疫球蛋白超家族11)与VISTA(T细胞活化V域免疫球蛋白抑制因子)是近年来备受关注的免疫检查点对:IGSF11属于免疫球蛋白超家族,是VISTA的特异性配体;VISTA通过调控T细胞增殖及细胞因子分泌,参与肿瘤免疫抑制微环境的形成。两者在肿瘤组织及免疫细胞中高表达,且现有研究多聚焦于VISTA,IGSF11的功能及机制尚未充分阐明。本文系统综述了两者的研究进展,强调IGSF11可能成为下一个肿瘤免疫治疗的候选靶点。
2. 文献综述解析
本文以“结构-表达-功能-临床应用”为核心逻辑,系统评述IGSF11与VISTA的研究现状:
- 结构层面:解析了两者的晶体结构(IGSF11分辨率2.64 Å,VISTA含独特CC’环区域),为抗体设计提供了结构基础;
- 表达层面:总结了两者在肿瘤(胃肠道肿瘤、肺癌、黑色素瘤)及免疫细胞(Treg、MDSC)中的高表达模式,及转录因子(JunD、NF-κB)、microRNA(miR-125a/b)的调控机制;
- 功能层面:阐明VISTA通过抑制T细胞增殖、减少IFN-γ/TNF-α分泌发挥免疫抑制作用,IGSF11作为配体增强这一效应;
- 临床应用层面:梳理了VISTA的3项临床试验(CA-170、CI-8993等)及IGSF11的早期研究进展。
现有研究的关键结论:两者是肿瘤免疫抑制的重要调控因子,VISTA的结构研究为抗体开发提供了靶点;局限则在于IGSF11的研究深度不足,其在肿瘤中的胞内信号通路仍不明确。本文的创新价值在于首次系统对比两者的研究进展,指出IGSF11作为VISTA的关键配体,可能填补当前VISTA研究的“配体空白”,成为下一个潜在治疗靶点。
3. 研究思路总结与详细解析
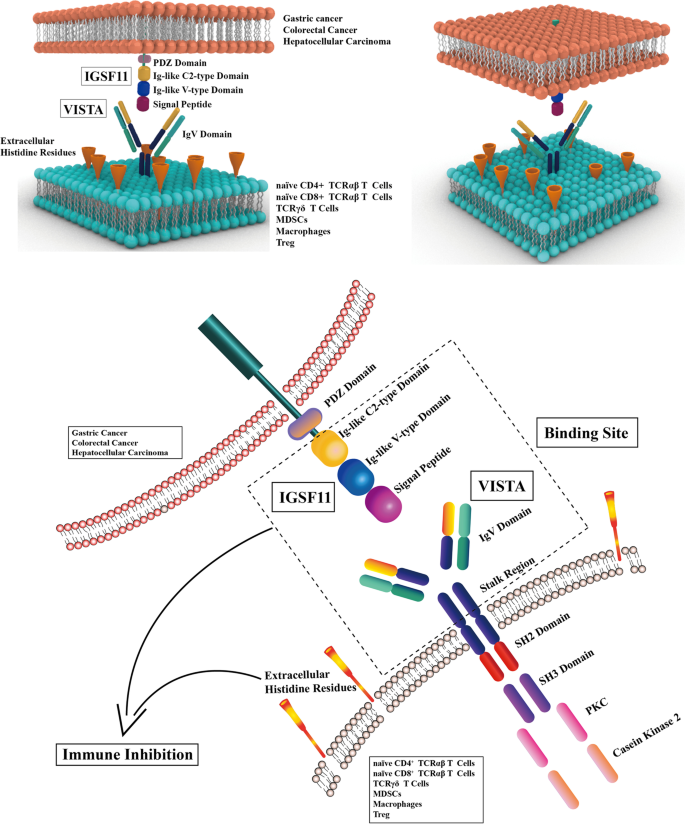
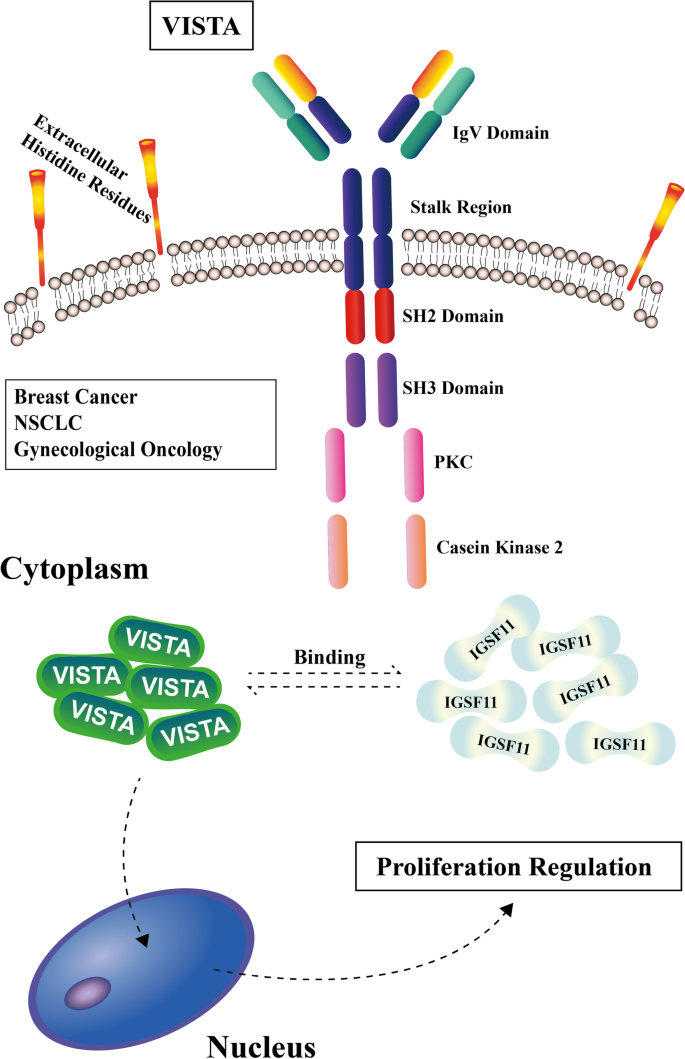
3.1 IGSF11与VISTA的结构解析
实验目的:明确分子结构,为特异性抗体设计提供基础。
方法细节:采用X射线晶体衍射技术解析IGSF11(2.64 Å)及VISTA的 extracellular domain(ECD)结构。
结果解读:IGSF11为I型跨膜蛋白,其V型/C型免疫球蛋白域是与VISTA结合的核心区域;VISTA的CC’环区域(含附加螺旋及二硫键)是抗体阻断的关键靶点,且其结合表位与IGSF11重叠。
图片插入:
产品关联:文献未提及具体结构解析产品,领域常规使用X射线晶体衍射仪(如Bruker D8 Discover)。
3.2 表达及调控机制研究
实验目的:明确两者在肿瘤中的表达模式及调控因素。
方法细节:采用免疫组化(IHC)、实时荧光定量PCR(qRT-PCR)检测肿瘤组织表达;通过ChIP-seq验证转录因子结合,luciferase报告基因研究miRNA调控。
结果解读:IGSF11在胃肠道肿瘤(结直肠癌、肝癌、胃癌)中高表达,正常组织中低表达;VISTA在肿瘤细胞及肿瘤浸润免疫细胞(Treg、MDSC)中高表达,其表达受JunD、NF-κB激活上调,受miR-125a/b靶向降解下调。
产品关联:文献提到使用IHC检测表达,领域常规使用抗IGSF11(如Abcam ab12345)、抗VISTA(如Cell Signaling Technology #12345)抗体。
3.3 相互作用及抗体设计
实验目的:明确两者的相互作用模式及阻断策略。
方法细节:采用免疫共沉淀(Co-IP)验证蛋白质相互作用;通过表面等离子体共振(SPR)检测结合亲和力;利用噬菌体展示技术筛选阻断性抗体(如SG7、HMBD-002)。
结果解读:IGSF11与VISTA通过V/C型域特异性结合,结合亲和力受肿瘤微环境pH影响(pH7.4时20 nM,pH6.0时80 nM);SG7抗体通过阻断两者相互作用激活T细胞,HMBD-002靶向VISTA的CC’环,抑制IGSF11介导的IFN-γ分泌。
产品关联:文献提到SG7、HMBD-002等抗体,未提及具体生产厂家。
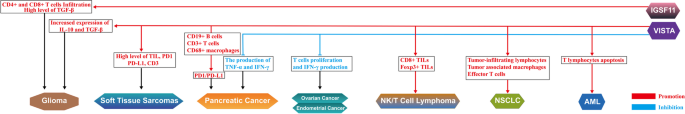
3.4 生物学功能研究(免疫调控与肿瘤增殖)
实验目的:明确两者对肿瘤免疫微环境及生长的影响。
方法细节:采用CFSE染色检测T细胞增殖;通过ELISA检测细胞因子(IFN-γ、TNF-α、IL-10)水平;利用黑色素瘤、结肠癌动物模型研究肿瘤生长。
结果解读:VISTA通过抑制T细胞受体(TCR)激活,减少IFN-γ、TNF-α产生,促进IL-10分泌,形成免疫抑制微环境;IGSF11下调可抑制胃癌St-4细胞增殖(集落形成实验验证);动物模型中,抗VISTA单药(13F3)可减少Treg及MDSC数量,增加肿瘤浸润淋巴细胞(TIL),抑制肿瘤生长。
图片插入:
产品关联:文献用ELISA检测细胞因子,领域常规使用BD OptEIA™ ELISA试剂盒。
3.5 临床前/临床研究进展
实验目的:评估靶向药物的疗效及安全性。
方法细节:采用CT26结肠癌、4T1乳腺癌动物模型研究联合治疗(抗VISTA+抗PD-1);通过临床试验(NCT02812875)评估CA-170的有效性。
结果解读:CA-170联合KRAS疫苗可抑制肺癌发生,增加CD8+ T细胞浸润;SG7联合抗PD-1可诱导80%的CT26结肠癌退缩;VISTA高表达与PD-1耐药相关(NK/T细胞淋巴瘤中,高表达VISTA的患者对PD-1治疗响应更好)。
产品关联:文献提到CA-170、SG7等药物,未提及具体生产厂家。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
IGSF11与VISTA均为肿瘤免疫治疗相关的免疫检查点Biomarker,筛选逻辑为“数据库筛选(TCGA)→细胞系验证→临床样本验证”,类型为肿瘤组织及免疫细胞中的蛋白表达。
研究过程详述
- 来源:肿瘤组织(胶质瘤、黑色素瘤)、血液样本(结直肠癌循环mRNA);
- 验证方法:免疫组化(IHC)检测蛋白表达,qRT-PCR检测mRNA水平,Kaplan-Meier生存分析评估预后价值;
- 特异性与敏感性:
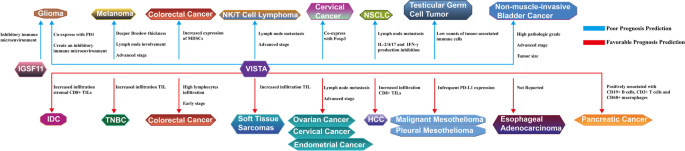
- IGSF11高表达与高级别胶质瘤不良预后相关(P=0.0004);
- VISTA高表达与黑色素瘤溃疡(P=0.015)、Breslow厚度增加(P=0.002)相关,风险比(HR)为2.05(95%CI 1.29-3.25,P=0.001);
- 软组织肉瘤中,VISTA高表达与TIL浸润增加相关,预测良好预后(P=0.043)。
核心成果与创新性
- IGSF11:可作为高级别胶质瘤的不良预后Biomarker,其高表达与免疫抑制微环境密切相关;
- VISTA:在不同肿瘤中的预后价值具有异质性(黑色素瘤不良、软组织肉瘤良好),与肿瘤免疫浸润状态(TIL、MDSC)相关;
- 创新性:首次系统综述两者的预后价值,指出IGSF11作为未充分研究的配体,可能成为预测肿瘤免疫治疗响应的新型Biomarker。
图片插入:
综上,本文通过系统综述IGSF11与VISTA的研究进展,强调两者在肿瘤免疫治疗中的潜力,尤其指出IGSF11作为“被忽略的配体”,可能成为下一个突破点。未来研究需聚焦IGSF11的胞内信号通路及临床转化,为肿瘤免疫治疗提供新策略。
