1. 领域背景与文献引入
文献英文标题:Whole gene expression profile in blood reveals multiple pathways deregulation in R6/2 mouse model;发表期刊:Biomarker Research;影响因子:未公开;研究领域:亨廷顿病(HD)分子病理与生物标志物研究。
亨廷顿病是一种致命的常染色体显性神经退行性疾病,核心病因是HTT基因第1外显子CAG三核苷酸重复异常扩增(正常6-26次,患者>36次),导致突变亨廷顿蛋白(mut-HTT)折叠错误并形成胞内包涵体,最终引发纹状体、大脑皮层神经元进行性丢失。其病理机制涉及转录失调(mut-HTT扣押CREB结合蛋白等转录因子)、线粒体功能障碍、氧化应激及免疫异常等。近年来,随着对mut-HTT“泛组织表达”特性的认识,外周组织(如血液、肌肉)的病理变化成为研究热点——外周组织不仅是mut-HTT的“储存库”,其分子改变还可能反映中枢神经系统的病变状态,为HD的早期诊断、病情监测提供无创生物标志物。
然而,作为HD研究的经典转基因小鼠模型(表达mut-HTT外显子1,12-16周出现运动障碍、体重下降等症状),R6/2小鼠的血液全基因表达谱尚未被系统分析,外周通路失调与中枢病变的关联也缺乏直接证据。本研究旨在填补这一空白,通过R6/2小鼠血液转录组测序结合多组织验证,揭示HD相关的外周通路异常,为生物标志物开发和治疗靶点探索提供实验依据。
2. 文献综述解析
文献综述以“HD核心病理→动物模型价值→现有研究局限”为评述逻辑,系统梳理领域现状:
首先,综述明确HD的分子病因是HTT基因CAG扩增导致mut-HTT的毒性作用,核心病理机制包括mut-HTT对转录 machinery的干扰(如抑制CREB介导的基因表达)、线粒体呼吸链损伤及氧化应激增加。其次,强调R6/2小鼠在HD研究中的不可替代性——该模型因携带mut-HTT外显子1、发病早、表型稳定,成为研究HD病理和测试治疗策略的“金标准”。
现有研究的优势在于:通过人类HD患者血液转录组(如Borovecki等2005年报道免疫相关基因失调)或蛋白质组分析,揭示了HD的免疫异常(补体系统激活)、代谢紊乱(PPAR信号失调);局限性在于:① 缺乏R6/2小鼠血液全基因表达谱的系统解析,无法直接对比动物模型与人类的外周病理关联;② 外周组织(如骨骼肌、皮肤)与中枢的病理联动研究不足,难以明确外周变化是中枢病变的“镜像反映”还是“独立驱动因素”。
本研究的创新点正是针对这些局限:首次对R6/2小鼠血液进行全基因表达谱测序,结合基因集富集分析(GSEA)系统解析失调通路,并通过RT-qPCR验证血液、骨骼肌、皮肤和脑等多组织的基因表达差异,建立了外周通路失调与中枢病变的关联,为HD生物标志物的跨物种验证提供了实验基础。
3. 研究思路总结与详细解析
本研究的整体框架为“样本收集→转录组分析→通路富集→多组织验证→关联分析”,核心目标是解析R6/2小鼠血液中的转录失调通路,并验证其在其他外周组织及脑中的表达差异,揭示HD的外周-中枢病理关联;核心科学问题是“R6/2小鼠血液中哪些通路因mut-HTT表达而失调,且这些失调是否参与HD的外周或中枢病理过程”。
3.1 实验动物与样本收集
实验目的是获取R6/2转基因小鼠(HD模型)与野生型(WT) littermate的血液及多组织样本,为后续转录组分析提供材料。
方法细节:研究纳入4只R6/2雄鼠(携带约110次CAG重复)和4只WT雄鼠,均饲养于12/12光暗周期、20-23℃环境中,自由饮食。16周龄时(R6/2进入症状显性期),通过心脏穿刺采集麻醉小鼠的全血(加入RNAprotect Animal Blood Tubes稳定RNA),随后收集脑(含纹状体和皮层)、骨骼肌(股四头肌)和腹部皮肤样本。所有样本经RNA质量检测(RIN值8.4-9.0),其中1只WT小鼠的血液RNA因质量不达标被排除,最终用于微阵列分析的样本为4只R6/2和3只WT。
结果:成功获得合格的血液及组织样本,为后续转录组和验证实验奠定基础。
实验所用关键产品:RNAprotect Animal Blood Tubes(BD QIAGEN,货号76544)、RNeasy Protect动物血液试剂盒(QIAGEN)。
3.2 血液全基因表达微阵列分析
实验目的是通过全基因表达谱分析,筛选R6/2与WT小鼠血液中的差异表达基因。
方法细节:从合格血液样本中提取总RNA,取500ng RNA制备扩增RNA(aRNA),杂交至Affymetrix Mouse Genome 430 2.0芯片(覆盖>34000个小鼠基因)。芯片数据通过R软件(Bioconductor包)处理:用RMA包进行分位数归一化,median-Polish算法总结探针集信号;用LIMMA包分析差异表达(筛选标准:p<0.05,绝对折叠变化|FC|>1.3)。
结果:共鉴定出约2200个差异转录本,其中1072个在R6/2中上调,1164个下调;进一步筛选出23个高度差异的探针集(p<0.001,|FC|>2),聚类分析可清晰区分R6/2与WT样本(图1)。
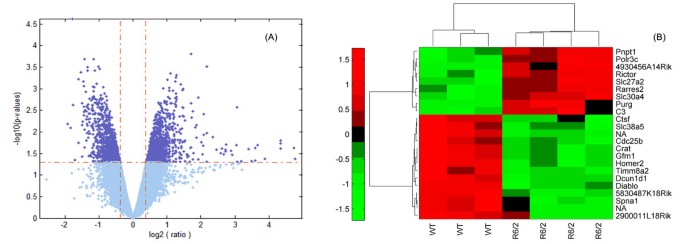
实验所用关键产品:Affymetrix Mouse Genome 430 2.0芯片,实验由Precision Biomarker Resources完成。
3.3 通路富集分析(GSEA)
实验目的是从差异表达基因中富集出具有生物学意义的通路,揭示R6/2小鼠血液中的通路失调模式。
方法细节:使用GSEA 2.07软件,基于MSigDB数据库的KEGG、Reactome、BioCarta通路集合及GeneOntology的生物学过程(Biological Processes),对微阵列数据进行通路富集分析(显著性标准:虚假发现率FDR<25%)。
结果:KEGG分析显示,R6/2小鼠血液中有19条通路显著富集(如补体与凝血 cascade、PPAR信号通路),2条通路在WT中富集(心肌收缩、扩张型心肌病);Reactome分析发现14条上调通路(如脂代谢相关通路);BioCarta分析有3条上调通路。其中,补体与凝血 cascade是R6/2中富集最显著的通路,PPAR信号通路次之(表1)。
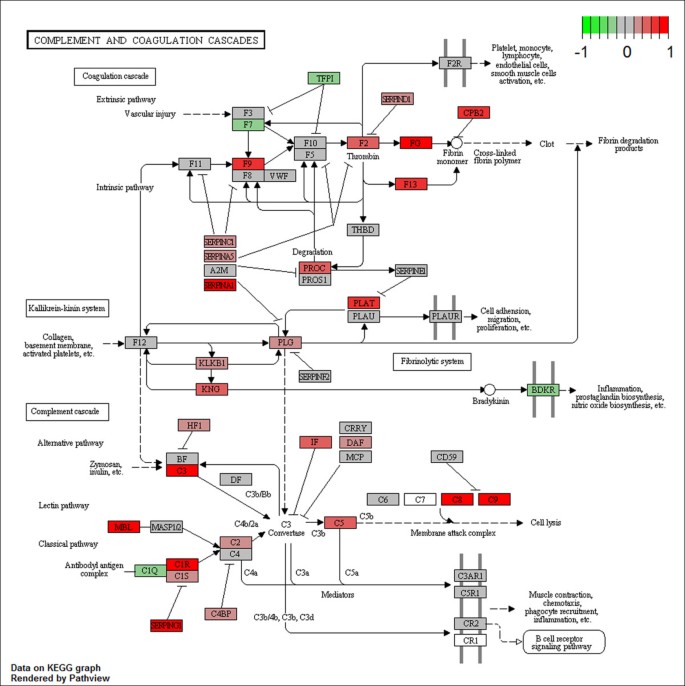
(补体与凝血 cascade通路图:红色标注为R6/2中上调的核心基因)
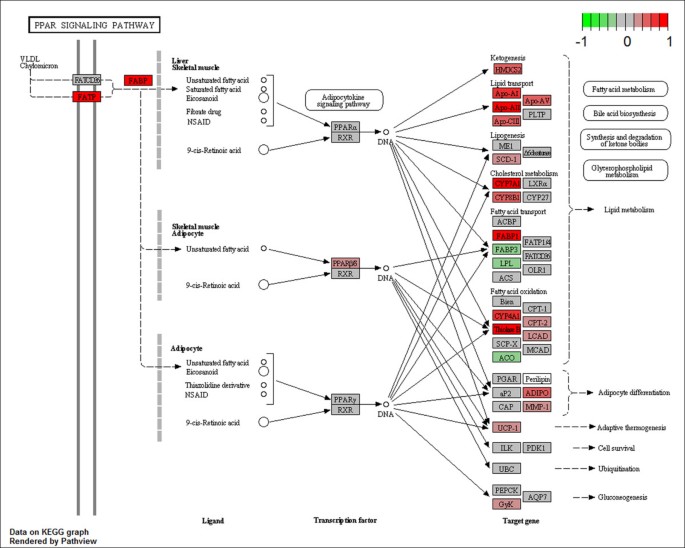
(PPAR信号通路图:红色标注为R6/2中上调的核心基因)
实验所用关键工具:GSEA 2.07软件,领域常规使用此类通路富集分析工具。
3.4 RT-qPCR验证与多组织分析
实验目的是验证微阵列结果的可靠性,并分析差异基因在其他外周组织(肌肉、皮肤)及脑中的表达情况,建立外周与中枢的病理关联。
方法细节:首先将R6/2和WT的血液RNA分别混合成Pooled样本(消除个体差异),用QuantiTect Reverse Transcription kit反转录为cDNA;对于肌肉、皮肤和脑样本,每个样本单独反转录。随后,用CFX96实时PCR系统(Bio-Rad)和iQ SYBR Green master mix,对候选基因(补体与凝血 cascade的C3、Serping1;PPAR信号的Fabp1、Slc27a2;心肌相关的Tpm2、Slc8a1)进行RT-qPCR检测。血液样本的表达数据归一化至Ppib、Actb、Ywhaz、Rpl13a的几何均值,其他组织归一化至Actb、B2m、Hprt、Rpl13a(骨骼肌排除Actb)。统计学分析采用Student’s t-test(p<0.05为显著)。
结果:① 血液中候选基因的表达趋势与微阵列一致(C3、Serping1、Slc27a2、Fabp1上调,Tpm2、Slc8a1下调);② 骨骼肌中C3、Serping1显著下调(p<0.05),提示肌肉局部补体通路抑制;③ 脑中有C3上调、Tpm2下调、Serping1下调(p<0.05),其中Serping1的表达趋势与血液相反(图6-9)。
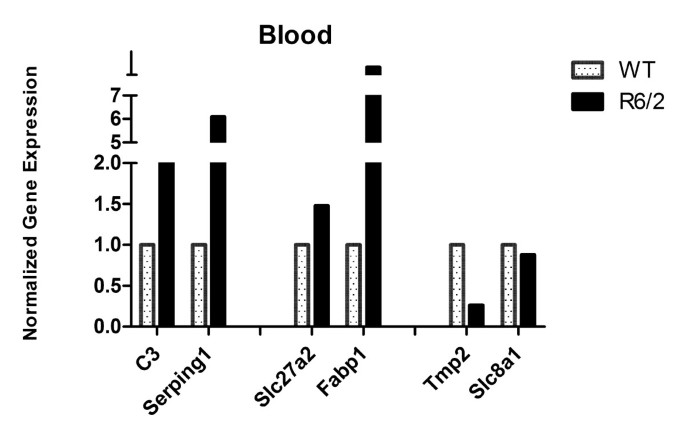
(血液RT-qPCR结果:Pooled样本验证微阵列趋势)
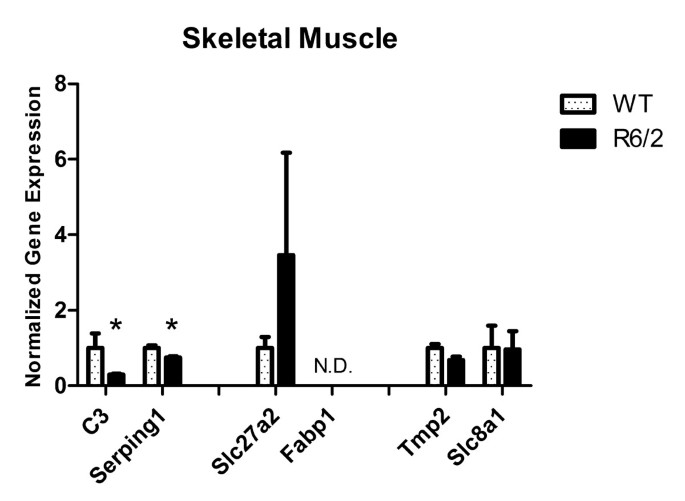
(骨骼肌RT-qPCR结果:C3、Serping1显著下调,*p<0.05)
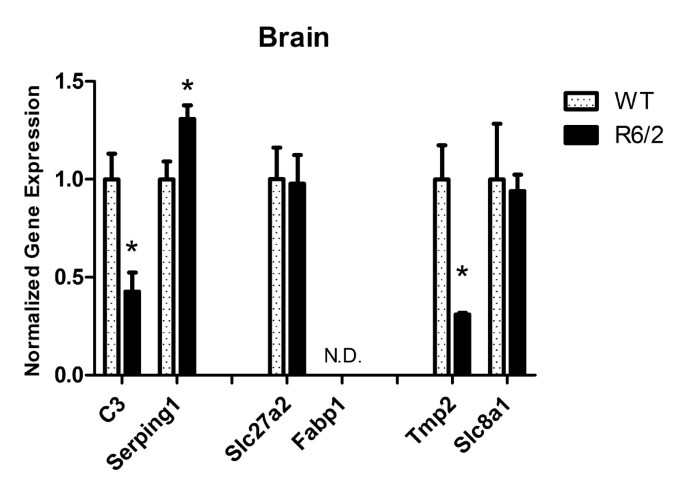
(脑RT-qPCR结果:C3、Tpm2、Serping1显著差异,*p<0.05)
实验所用关键产品:QuantiTect Reverse Transcription kit(QIAGEN)、iQ SYBR Green master mix(Bio-Rad)、CFX96 Real Time System(Bio-Rad)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究关注血液及外周组织中的差异表达基因作为HD的潜在Biomarker,筛选逻辑遵循“微阵列筛选差异基因→GSEA富集通路→RT-qPCR验证(血液、多组织)→关联中枢病变”的闭环,确保Biomarker的“稳定性”(跨技术验证)与“相关性”(跨组织关联)。
研究过程详述
- Biomarker来源:R6/2与WT小鼠的血液、骨骼肌、皮肤、脑样本(覆盖外周与中枢组织);
- 验证方法:结合高通量微阵列(筛选差异)与低通量RT-qPCR(验证可靠性),确保结果的重复性;
- 特异性与敏感性:血液中C3(R6/2 vs WT,上调)、Serping1(上调)、Tpm2(下调)等基因在R6/2中显著差异;骨骼肌中C3、Serping1下调具有统计学意义(p<0.05);脑中有C3、Tpm2、Serping1的显著差异(p<0.05),表明这些基因对HD具有组织特异性。
核心成果提炼
- 外周通路失调的Biomarker候选:首次在R6/2小鼠血液中发现补体与凝血 cascade、PPAR信号通路、心肌相关通路的失调,其差异基因(如C3、Serping1)可作为HD外周Biomarker候选。例如,血液中C3上调反映HD的炎症激活状态,与人类HD患者血浆中补体蛋白升高的研究一致(Dalrymple等2007年报道)。
- 肌肉病理的Biomarker:骨骼肌中C3、Serping1显著下调(p<0.05),提示补体通路抑制可能参与HD的肌肉萎缩病理——补体系统的正常功能是清除损伤细胞,其抑制可能导致肌肉细胞碎片堆积,加重萎缩。
- 外周与中枢的关联Biomarker:血液中Serping1上调与脑内Serping1下调的反向趋势,可能反映外周与中枢的不同病理阶段:血液处于炎症激活早期(Serping1作为补体抑制剂,上调以限制炎症过度),而脑处于炎症消退或神经元损伤阶段(Serping1下调导致补体过度激活,加重神经损伤)。
- 创新性:本研究的Biomarker突破了“单一组织”的局限,通过跨组织验证(血液→肌肉→脑),证明其能反映HD的多器官病理,为HD的无创监测(如血液检测)提供了新的候选指标。例如,血液中的C3可作为反映中枢补体激活的外周标志物(脑内C3上调),而肌肉中的C3下调可提示肌肉萎缩的进展。
综上,本研究通过R6/2小鼠血液全基因表达谱分析,揭示了HD的外周通路失调,为HD生物标志物开发和治疗靶点探索提供了重要实验依据,同时验证了R6/2小鼠作为HD预临床模型的可靠性。
