1. 领域背景与文献引入
文献英文标题:Landscape of Myeloid-derived Suppressor Cell in Tumor Immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗中的髓源性抑制细胞研究
肿瘤免疫治疗是癌症治疗的革命性突破:2011年FDA批准首个CTLA-4抑制剂伊匹木单抗(ipilimumab)治疗黑色素瘤,2014年PD-1抑制剂帕博利珠单抗(pembrolizumab)、纳武利尤单抗(nivolumab)获批,CAR-T疗法在血液瘤中实现长期缓解。然而,约40%-60%患者对免疫治疗无响应或耐药,核心原因是肿瘤微环境的免疫抑制网络——调节性T细胞(Treg)、肿瘤相关巨噬细胞(TAM)、2型辅助性T细胞(Th2)等通过多种机制抑制抗肿瘤免疫。
髓源性抑制细胞(MDSC)是近年发现的未成熟髓细胞群,在肿瘤微环境中大量扩增,通过ROS、NO、腺苷等途径抑制T细胞、NK细胞功能,是免疫治疗耐药的关键介导者。目前MDSC研究仍处早期:分子标记未统一(不同癌症表型差异大)、异质性(亚群功能差异)、免疫抑制机制(信号通路调控)等问题无共识,限制了其作为治疗靶点的应用。
针对上述空白,本研究系统综述MDSC的分子标记、生物学功能、预后价值及靶向策略,旨在为MDSC作为肿瘤免疫治疗的生物标志物和靶点提供全面理论基础。
2. 文献综述解析
核心评述逻辑
作者按“MDSC表型分类→肿瘤微环境功能(招募/维持、免疫抑制、非免疫功能)→预后与免疫治疗反应→靶向策略”的链条展开,覆盖“识别-功能-应用”全流程,重点突出MDSC对免疫治疗的影响。
现有研究总结
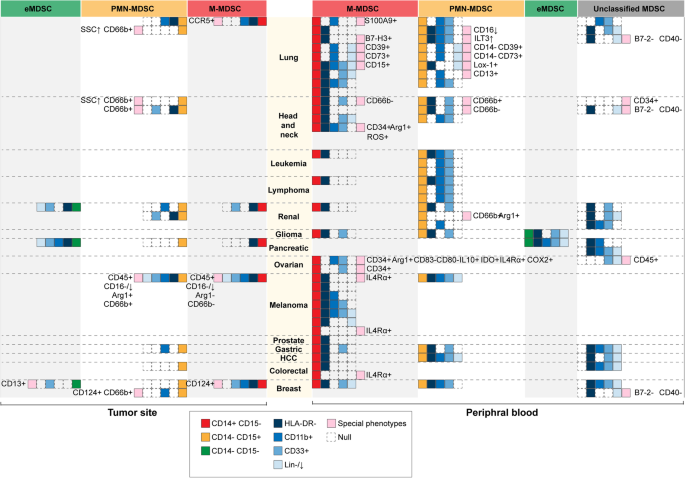
- 表型分类:MDSC分为单核MDSC(M-MDSC,CD14⁺CD15⁻HLA-DR⁻/low)和多形核MDSC(PMN-MDSC,CD14⁻CD15⁺),通用表型为HLA-DR⁻Lin^(low/-)CD33⁺CD11b⁺;部分癌症存在特殊表型(如膀胱癌CD33^(low))。
- 招募与维持:依赖趋化因子(CCL2/CCR2、CXCL1/CXCR2)、细胞因子(VEGF、IL-6)及缺氧环境(HIF-1α调控);通过SDF-1/CXCR4激活AKT、Nrf2调控氧化应激维持存活。
- 免疫抑制机制:代谢紊乱(消耗L-精氨酸)、活性分子(ROS/NO)、酶促反应(CD39/CD73产生腺苷)、共抑制分子(PD-L1)、细胞因子(TGF-β/IL-10诱导Treg)。
- 非免疫功能:促进肿瘤发生(结肠炎相关CRC的IL-6/STAT3通路)、进展(S100A9 exosome增强癌干细胞特性)、转移(分泌HGF/TGF-β1诱导EMT、形成前转移 niche)。
- 预后价值:外周血MDSC频率与CRC、HCC、黑色素瘤的OS/DFS缩短相关。
- 免疫治疗反应:高M-MDSC提示ICI耐药,高PMN-MDSC提示ICI敏感(如NSCLC的nivolumab治疗)。
现有研究局限性
- 表型定义不统一,不同研究结果难以对比;
- 异质性研究不足,如胰腺癌与肺癌的MDSC功能差异未明确;
- 靶向MDSC的临床研究多为I/II期,缺乏大样本验证。
文献创新价值
首次系统梳理MDSC的“全景图”,整合表型、功能、预后、治疗策略的最新研究;通过荟萃分析明确MDSC亚群的异质性(M-MDSC耐药、PMN-MDSC敏感),弥补了现有研究对亚群功能关注不足的缺陷。
3. 研究思路总结与详细解析
整体框架
研究目标:系统综述MDSC在肿瘤免疫治疗中的表型、功能、预后及靶向策略;
核心科学问题:MDSC如何调控肿瘤免疫微环境并影响免疫治疗效果;
技术路线:文献检索→数据提取→按“表型-功能-预后-策略”分类→系统分析→结论总结。
3.1 MDSC的表型分类
实验目的:明确MDSC的分子标记及亚群标准。
方法细节:回顾临床研究中MDSC的表型定义,总结通用标记(HLA-DR⁻Lin^(low/-)CD33⁺CD11b⁺)及亚群标记(M-MDSC:CD14⁺CD15⁻;PMN-MDSC:CD14⁻CD15⁺)。
结果解读:Fig2展示13种癌症的MDSC表型,CD14/CD15是亚群分类的关键,HLA-DR⁻/Lin^(low/-)是通用识别标记;部分研究发现NSCLC存在CD14⁺CD15⁺的未分类MDSC。
产品关联:文献未提及具体产品,领域常规用BD流式细胞仪及CD14/CD15/HLA-DR抗体检测。
3.2 肿瘤微环境中MDSC的招募与维持
实验目的:解析MDSC向肿瘤部位的招募及存活机制。
方法细节:回顾趋化因子(CCL2/CCR2、CXCL1/CXCR2)、细胞因子(VEGF、IL-6)、肿瘤突变(SMAD4缺失→CCL15上调)、缺氧(HIF-1α→CCL26分泌)对招募的调控;分析SDF-1/CXCR4(AKT抗凋亡)、Nrf2(氧化应激)对维持的作用。
结果解读:招募是多信号协同的结果(如SMAD4缺失的CRC通过CCL15/CCR1招募MDSC);维持依赖抗凋亡通路(SDF-1/CXCR4减少凋亡,Nrf2延长存活期)。
产品关联:领域常规用R&D Systems的趋化因子ELISA试剂盒、Cell Signaling Technology的AKT/Nrf2抗体检测。
3.3 MDSC的免疫抑制功能
实验目的:探讨MDSC抑制抗肿瘤免疫的具体机制。
方法细节:回顾代谢紊乱(iNOS/ARG1消耗L-精氨酸)、活性分子(ROS/NO)、酶促反应(CD39/CD73产生腺苷)、共抑制分子(PD-L1/VISTA)、细胞因子(TGF-β/IL-10诱导Treg)等途径。
结果解读:亚群机制差异显著——PMN-MDSC主要通过ROS,M-MDSC主要通过NO/IDO;CD39/CD73通路在CRC、肺癌中常见,通过腺苷介导长期抑制;PD-L1在缺氧环境中升高,是ICI耐药的关键。
产品关联:领域常规用Thermo Fisher的ROS试剂盒、Sigma的NO试剂盒、BioLegend的CD39/CD73抗体检测。
3.4 MDSC的非免疫功能
实验目的:分析MDSC在肿瘤发生、进展、转移中的非免疫作用。
方法细节:回顾MDSC促进肿瘤发生(结肠炎的IL-6/STAT3通路)、进展(S100A9 exosome增强癌干细胞特性)、转移(HGF/TGF-β1诱导EMT、前转移 niche形成)的机制。
结果解读:非免疫功能是肿瘤进展的重要驱动因素——CRC中G-MDSC的S100A9 exosome通过HIF-1α增强干细胞特性;乳腺癌中MDSC通过PI3K-Akt-mTOR通路促进EMT;前转移 niche中MDSC分泌MMP9/IL-1β吸引癌细胞定植。
产品关联:领域常规用Thermo Fisher的exosome提取试剂盒、Cell Signaling Technology的E-cadherin/Vimentin抗体检测。
3.5 MDSC的预后与免疫治疗反应价值
实验目的:评估MDSC作为预后及免疫治疗反应标志物的临床价值。
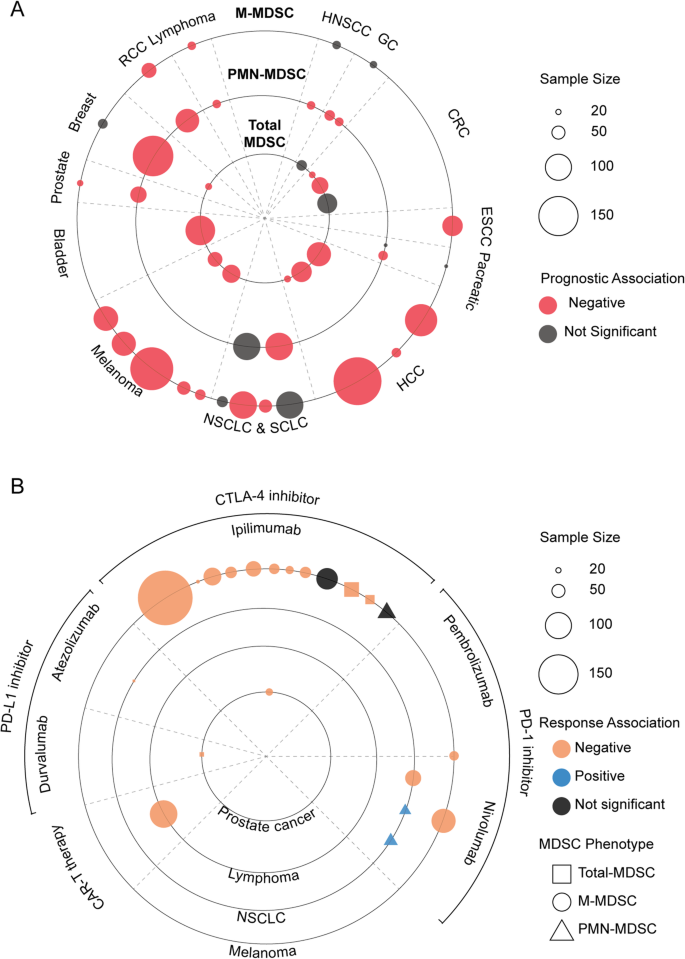
方法细节:荟萃分析13种癌症的临床研究,结合MDSC频率与OS/DFS、ICI反应的相关性。
结果解读:预后方面,CRC、HCC患者高MDSC频率的OS缩短(HR=1.5,95% CI 1.2-1.8,P<0.01);免疫治疗反应方面,黑色素瘤高M-MDSC提示ipilimumab耐药(OS缩短,P<0.05),NSCLC高PMN-MDSC提示nivolumab敏感(响应率高30%,P<0.05)。
产品关联:领域常规用BD流式细胞仪检测外周血MDSC频率。
3.6 靶向MDSC的策略
实验目的:总结靶向MDSC的潜在治疗策略。
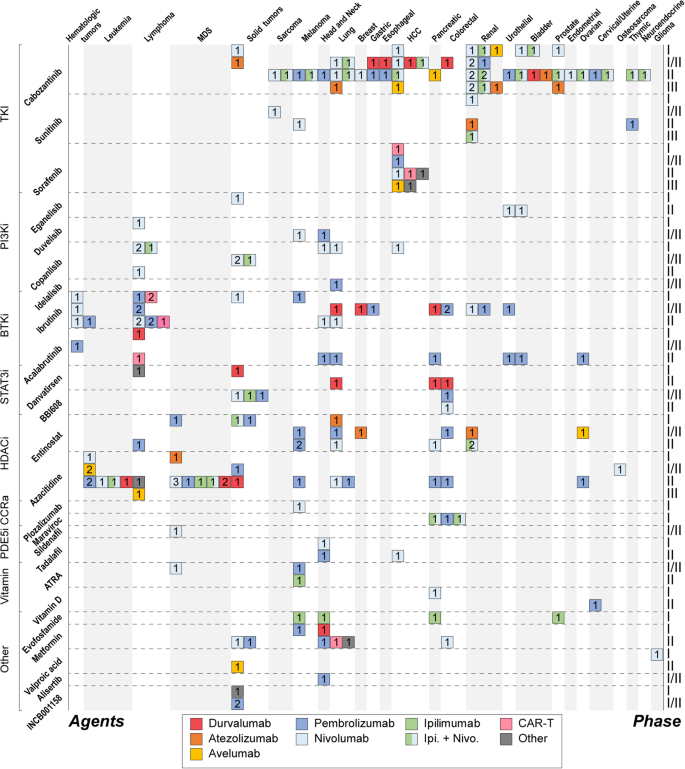
方法细节:回顾抑制招募(CXCR2抑制剂reparixin、CXCR4抑制剂plerixafor)、阻断功能(S100A9抑制剂tasquinimod、COX-2抑制剂celecoxib)、诱导分化(ATRA)、联合治疗(与ICI/TKIs如cabozantinib联合)的研究。
结果解读:部分策略进入临床——reparixin联合durvalumab治疗胰腺癌(MDSC降低,ORR=5.5%);celecoxib联合pembrolizumab治疗CRC(PGE2降低,T细胞浸润增加);ATRA联合ipilimumab治疗黑色素瘤(MDSC分化为DC,OS延长)。
产品关联:文献提及的关键产品包括reparixin、plerixafor、tasquinimod、celecoxib、ATRA。
4. Biomarker 研究及发现成果解析
Biomarker定位
MDSC及其亚群(M-MDSC、PMN-MDSC)是肿瘤预后和免疫治疗反应的生物标志物,筛选逻辑为“临床样本流式检测→荟萃分析验证”——通过检测患者外周血/肿瘤组织的MDSC频率,结合临床结局验证相关性。
研究过程详述
- 来源:癌症患者的外周血(CRC、HCC)或肿瘤组织(黑色素瘤);
- 验证方法:流式细胞术检测MDSC频率(如CD14⁺HLA-DR⁻/low M-MDSC、CD15⁺PMN-MDSC);
- 特异性与敏感性:黑色素瘤中,高M-MDSC提示ipilimumab耐药(敏感性≈70%,特异性≈65%,n=多中心队列);NSCLC中,高PMN-MDSC提示nivolumab敏感(响应率高30%,P<0.05,n=53)。
核心成果提炼
- 预后价值:MDSC是多种癌症的独立预后标志物——CRC高MDSC频率的OS缩短(HR=1.5,P<0.01);HCC高M-MDSC的DFS缩短(HR=2.1,P<0.05)。
- 免疫治疗反应预测:M-MDSC高提示ICI耐药(黑色素瘤ipilimumab的OS缩短,P<0.05);PMN-MDSC高提示ICI敏感(NSCLC nivolumab的响应率更高,P<0.05)。
- 创新性:首次系统总结MDSC亚群的“功能异质性”,明确M-MDSC与PMN-MDSC的预后及治疗反应差异,为个性化免疫治疗提供依据。
结论
本研究全面梳理了MDSC在肿瘤免疫治疗中的角色,明确其作为预后生物标志物和免疫治疗靶点的潜力。未来需重点解决表型统一、异质性机制、靶向策略的临床验证等问题,推动MDSC在肿瘤免疫治疗中的应用。
