1. 领域背景与文献引入
文献英文标题:Spatial resolved transcriptomics reveals distinct cross-talk between cancer cells and tumor-associated macrophages in intrahepatic cholangiocarcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝内胆管癌肿瘤微环境与细胞相互作用。
肝内胆管癌(intrahepatic cholangiocarcinoma, iCCA)是全球发病率持续上升的高度致命肝胆恶性肿瘤,患者5年生存率不足10%,其恶性进展与复杂的肿瘤微环境(tumor microenvironment, TME)密切相关。领域共识:iCCA的TME由肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)、癌相关成纤维细胞等多种细胞组成,其中TAMs作为最丰富的免疫细胞亚群,通过促进肿瘤增殖、血管生成及免疫抑制参与iCCA进展。然而,现有研究多基于bulk RNA-seq或单细胞RNA-seq(single-cell RNA sequencing, scRNA-seq)解析细胞异质性,缺乏空间分辨的iCCA TME细胞互作分析——TAMs在iCCA TME中的重编程机制、与癌细胞亚克隆的空间邻近性及功能互作尚未完全阐明。
本研究的核心初衷是通过空间转录组学(spatial transcriptomics, ST)与数字空间Profiler(digital spatial profiler, DSP)技术,在保留组织空间架构的前提下解析iCCA的细胞组成、空间异质性及癌细胞与TAMs的相互作用,填补iCCA TME空间机制的研究空白,为iCCA的免疫抑制微环境解析及靶向治疗策略开发提供新见解。
2. 文献综述解析
文献综述的核心评述逻辑围绕“iCCA TME复杂性→现有技术局限性→空间转录组学的解决价值”展开:作者首先总结iCCA的临床困境(高死亡率、TME异质性),强调TAMs作为TME关键细胞对肿瘤进展的驱动作用;随后指出,尽管scRNA-seq能解析细胞亚群异质性,但无法提供细胞的空间位置信息,难以揭示TME中细胞间的“邻近-功能”关联;最后提出,空间转录组学技术(如ST)可保留组织的空间架构,为解析iCCA TME的细胞互作提供“位置-基因-功能”的三维信息。
现有研究的关键结论包括:①TAMs通过表型重编程(如M2极化)促进iCCA发生发展;②iCCA癌细胞存在亚克隆异质性,但亚克隆与TAMs的空间互作未明。现有技术的优势是scRNA-seq的高分辨率细胞分群,局限性是缺失空间信息;而本研究的创新价值在于首次将ST与DSP技术结合,在空间分辨水平解析iCCA的TME架构,揭示TFF3(三叶因子3)介导的癌细胞与TAMs互作机制,为iCCA的免疫抑制微环境研究提供新视角。
3. 研究思路总结与详细解析
本研究的整体框架:以“解析iCCA空间转录组异质性及癌细胞-TAMs互作”为目标,围绕“空间细胞分群→互作预测→功能验证”的逻辑展开,技术路线为“临床样本收集→ST/DSP文库构建→空间细胞分群→受体-配体互作分析→体外细胞实验验证”。
3.1 临床样本收集与空间转录组文库构建
实验目的是获取iCCA临床样本并构建空间转录组文库,为后续分析提供基础。方法细节:收集3例iCCA患者手术标本(山东大学齐鲁医院),OCT包埋后制备10μm冷冻切片;HE染色后由病理学家标注肿瘤区、间质区及正常肝细胞区;采用10x Genomics Visium平台构建空间转录组文库,Illumina NovaSeq6000测序,每样本捕获约3000个spots(每个spot覆盖约10个细胞)。结果解读:成功构建3例iCCA样本的空间转录组文库,病理标注的肿瘤区高表达上皮细胞marker KRT19,间质区高表达成纤维细胞marker ACTA2,验证了文库的组织特异性。实验所用关键产品:SAKURA的OCT包埋剂(货号4583)、MP Biomedicals的Lysing Matrix D(货号116913050)、10x Genomics的Visium Spatial Gene Expression平台。
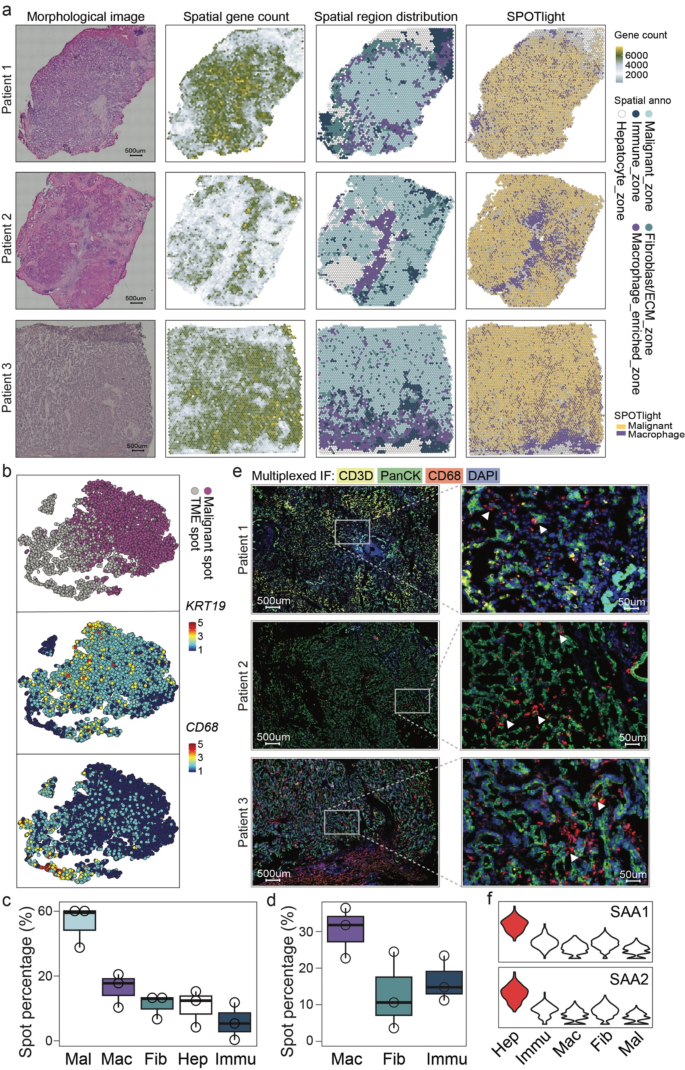
3.2 空间细胞分群与异质性分析
实验目的是解析iCCA的空间细胞组成及癌细胞亚克隆异质性。方法细节:用STUtility与Seurat软件分析ST数据,结合病理标注与marker基因(KRT19为癌细胞、CD68为巨噬细胞、ALB为肝细胞)将spots分为5类:癌细胞区(56.27%)、巨噬细胞富集区(14.72%)、肝细胞区(10.61%)、免疫细胞区(9.41%)及成纤维细胞/ECM区(8.99%);用SPOTlight工具整合GSE138709的scRNA-seq数据,解析每个spot的细胞类型比例;采用DSP技术在相邻切片上验证——通过PanCK(癌细胞)、CD68(巨噬细胞)、CD3(T细胞)抗体标记区域-of-interest(ROI),分析区域转录组相似性。结果解读:iCCA的TME中巨噬细胞是最丰富的免疫细胞,癌细胞区占比最高且呈空间异质性分布(如患者1的癌细胞分为TFF3高表达亚克隆、SLC2A1高表达亚克隆等);DSP验证显示,空间邻近的ROI转录组相似性高,与ST的空间分群结果一致,证实iCCA癌细胞亚克隆的空间分布受“物理邻近性”驱动。实验所用关键产品:Novus的PanCK抗体(货号NBP2-33200)、SantaCruz的CD3抗体(货号sc-20047AF594)、Proteintech的CD68抗体(货号16646-1-AP)。
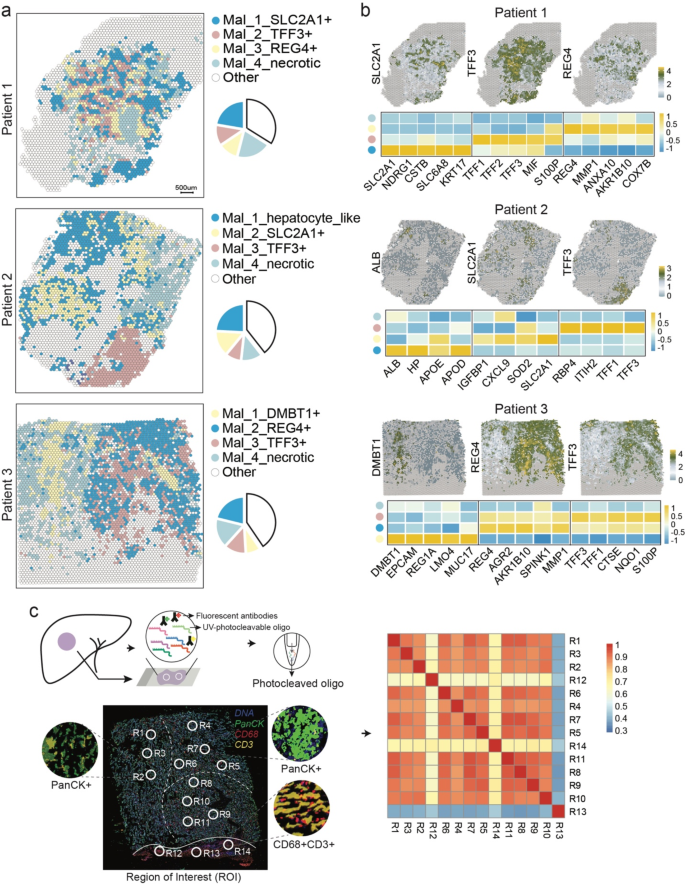
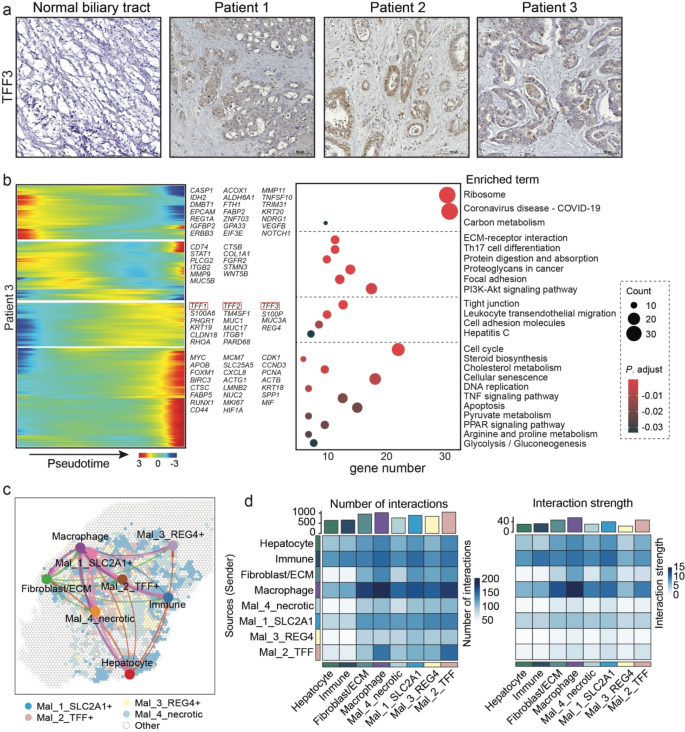
3.3 癌细胞与TAMs的互作解析
实验目的是揭示癌细胞与TAMs的空间互作机制。方法细节:用CellChat_v2工具分析ST数据中的受体-配体相互作用,预测细胞间信号传递;用Monocle软件构建癌细胞伪时间轨迹,分析TFF3的动态表达;通过免疫组化(immunohistochemistry, IHC)验证临床样本中TFF3的表达,用多重免疫荧光(multiplexed immunofluorescence, mIF)检测TFF3与CD163(M2巨噬细胞marker)、S100A4/S100A8(促肿瘤巨噬细胞marker)的共定位。结果解读:TFF3高表达的癌细胞亚克隆与巨噬细胞的互作强度最高(受体-配体对数量最多);伪时间分析显示TFF3在癌细胞进化过程中持续高表达,提示其参与肿瘤恶性进展;IHC显示TFF3在肿瘤区域显著高表达(AOD值高于正常胆管,n=3,P<0.05),mIF进一步证实TFF3阳性癌细胞周围聚集CD163、S100A4、S100A8阳性巨噬细胞,直接提示TFF3介导癌细胞与TAMs的空间互作。实验所用关键产品:Proteintech的TFF3抗体(货号23277-1-AP)、CD163抗体(货号16646-1-AP)、S100A4抗体(货号16105-1-AP)、S100A8抗体(货号15792-1-AP)。

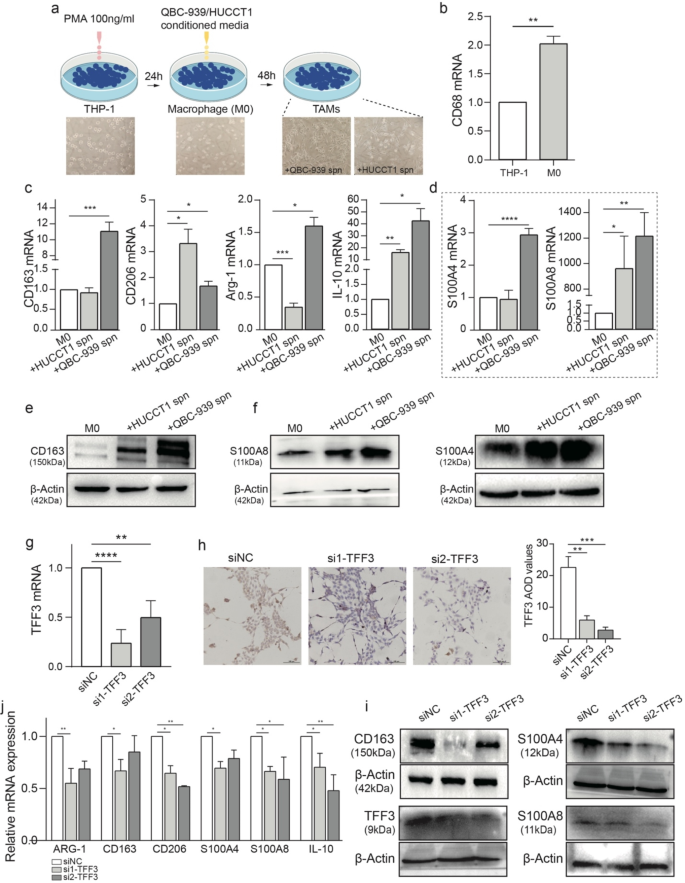
3.4 体外功能验证
实验目的是验证TFF3对巨噬细胞重编程的功能作用。方法细节:用100ng/ml佛波酯(phorbol-12-myristate-13-acetate, PMA)诱导人单核细胞系THP-1分化为M0巨噬细胞,与iCCA细胞系(QBC-939、HUCCT1)的条件培养基共培养48h;设计siRNA敲低QBC-939细胞的TFF3,通过qPCR检测巨噬细胞M2 marker(CD163、CD206、ARG-1、IL-10)及S100A4、S100A8的mRNA表达,免疫印迹验证蛋白水平。结果解读:iCCA细胞条件培养基显著诱导M0巨噬细胞向M2表型转化——M2 marker及S100A蛋白表达均显著上调(n=3,P<0.05);敲低TFF3后,上述基因/蛋白表达水平较对照组下降约50%(n=3,P<0.05),直接证实TFF3是癌细胞诱导巨噬细胞促肿瘤重编程的关键因子。实验所用关键产品:Thermo-Fisher Scientific的PMA(领域常规使用)、Qiagen的RNeasy Mini Kit、Applied Biosystems的Power SYBR Green Master Mix。
4. Biomarker 研究及发现成果解析
Biomarker定位与筛选逻辑
本研究聚焦的Biomarker为TFF3(三叶因子3),属于分泌型蛋白 Biomarker。其筛选与验证逻辑为“空间转录组筛选→临床样本验证→体外功能验证”:首先通过ST分析发现iCCA癌细胞亚克隆高表达TFF3;随后通过IHC验证临床样本中TFF3的肿瘤特异性表达;最后通过体外细胞实验证实其介导癌细胞与TAMs互作的功能。
研究过程详述
TFF3来源于iCCA癌细胞,主要通过癌细胞分泌进入TME。验证方法包括:①临床样本IHC:对3例研究样本及24例独立队列样本进行TFF3 IHC染色,结果显示TFF3在肿瘤区域显著高表达(AOD值高于正常胆管,n=3,P<0.05),24例独立队列中16例TFF3阳性且与CD163(M2巨噬细胞)共定位;②细胞系验证:通过qPCR与免疫印迹检测iCCA细胞系(QBC-939、HUCCT1)中TFF3的表达,证实其在癌细胞中高表达;③功能验证:通过siRNA敲低实验,证实TFF3是癌细胞诱导巨噬细胞促肿瘤重编程的关键因子。
特异性方面,TFF3在iCCA肿瘤区域的表达显著高于正常胆管组织(n=3,P<0.05);敏感性方面,文献未明确报道ROC曲线 AUC值,但24例独立队列中16例TFF3阳性(阳性率约66.7%),提示其具有一定的临床相关性。
核心成果提炼
TFF3的核心功能关联为“iCCA癌细胞分泌的促肿瘤因子,介导TAMs向M2表型重编程”:①TFF3高表达的癌细胞亚克隆与巨噬细胞互作最强,提示其在TME细胞通讯中的核心作用;②体外实验证实,TFF3敲低可显著抑制巨噬细胞M2 marker(CD163、IL-10)及S100A4/S100A8的表达,直接关联iCCA的免疫抑制微环境;③临床样本中TFF3与CD163的共定位,提示其与iCCA患者的不良预后相关(推测,文献未明确生存分析,但M2巨噬细胞富集通常提示预后不良)。
其创新性在于首次在空间分辨水平揭示TFF3介导的癌细胞与TAMs互作,突破了传统非空间技术无法解析“位置-功能”关联的局限,为iCCA的治疗靶点提供了新候选——靶向TFF3可能抑制TAMs的促肿瘤重编程,改善iCCA患者的免疫抑制状态。
本研究通过空间转录组学技术解析了iCCA的空间架构与细胞互作,为iCCA的TME研究提供了重要的空间视角,TFF3作为关键互作因子,有望成为iCCA的潜在治疗靶点。
