1. 领域背景与文献引入
文献英文标题:The distinct landscape of tumor immune microenvironment in homologous recombination deficient cancers;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫微环境与同源重组缺陷癌症。
同源重组修复(HRR)是维持基因组稳定的关键通路,负责DNA双链断裂(DSB)的高保真修复。同源重组缺陷(HRD)指HRR通路关键基因(如BRCA1/2、ATM、RAD51)发生突变或表观修饰,导致细胞无法通过HRR修复DSB,转而依赖易错的非同源末端连接(NHEJ)、微同源介导末端连接(MMEJ)等途径,最终造成基因组不稳定。HRD广泛存在于卵巢癌(75%高级别浆液性卵巢癌HGSOC)、乳腺癌(40%三阴性乳腺癌TNBC)、胰腺癌、前列腺癌等恶性肿瘤中。
2005年,合成致死效应的发现推动了PARP抑制剂的研发——PARP抑制剂通过抑制单链断裂修复,导致HRD细胞累积致命的DSB,成为HRD癌症的核心治疗药物。然而,仅少数患者从PARP抑制剂单药中获益(如卵巢癌响应率约30%),且耐药现象频发。近年研究表明,HRD癌症的肿瘤微环境(TME)具有免疫激活与抑制共存的独特特征:高肿瘤突变负荷(TMB)和新抗原负荷促进CD8⁺细胞毒性T细胞、NK细胞浸润,但同时存在调节性T细胞(Treg)富集、T细胞耗竭、M2型巨噬细胞极化等免疫抑制表型。这种平衡是HRD癌症对免疫检查点抑制剂(ICIs)响应差异的关键,也为PARP抑制剂联合免疫治疗提供了理论基础。
当前研究空白在于:缺乏对HRD癌症TME细胞组分、空间相互作用及分子机制的系统解析,且联合治疗的生物标志物与临床疗效关联不明确。本文献的核心初衷是通过综述HRD癌症的TME独特景观,揭示免疫激活与抑制的动态平衡,为PARP抑制剂联合免疫治疗的精准应用提供理论框架。
2. 文献综述解析
作者对现有研究的综述逻辑遵循“HRD基础→TME特征→分子机制→临床应用”的分层框架,将领域内研究分为四大类:HRD的检测与遗传特征、TME的细胞与空间特征、分子调控机制、联合治疗的临床前与临床证据。
现有研究的关键结论与局限性
- HRD的检测与遗传特征:HRD检测包括三类方法——基因变异检测( germline/somatic BRCA1/2突变及ATM、RAD51等HR基因变异)、基因组瘢痕分析(通过LOH、TAI、LST计算基因组不稳定评分GIS)、功能检测(RAD51核定位实验评估HR活性)。不同癌症的HR相关基因突变频率差异显著:卵巢癌BRCA1/2突变率最高(HGSOC约50%),乳腺癌中TNBC的HRD比例达40%,胰腺癌以BRCA2/ATM突变为主,前列腺癌常见BRCA2/ATM/CHEK2突变。
- TME的细胞与空间特征:HRD癌症的TME具有“高免疫原性但免疫抑制”的矛盾表型——高TMB和新抗原负荷促进CD8⁺T细胞、NK细胞浸润(如BRCA1突变乳腺组织中CD8⁺T细胞比例显著升高),但同时存在Treg富集(HRD肿瘤中Treg比例较HR正常肿瘤高2-3倍)、T细胞耗竭(PD-1/LAG3/TIGIT表达上调)、M2型巨噬细胞极化(PD-L1⁺巨噬细胞比例增加)。空间上,HRD肿瘤的免疫细胞更靠近肿瘤细胞(如BRCA1/2突变HGSOC中,CD8⁺T细胞主要分布在肿瘤细胞周围),提示更频繁的免疫-肿瘤相互作用。
- 分子调控机制:HRD癌症的TME受四大通路调控——抗原呈递动态变化(早期HLA基因高表达促进抗原呈递,晚期HLA杂合性缺失(LOH)导致抗原呈递减弱)、IFN信号通路激活(cGAS-STING通路感知基因组不稳定,促进IFN-α/β分泌)、JAK-STAT通路(IFN下游激活JAK-STAT,上调HLA和PD-L1表达)、代谢重编程(HRD细胞依赖氧化磷酸化(OXPHOS)和糖酵解满足能量需求,代谢产物抑制免疫细胞功能)。
- 联合治疗的进展:临床前模型显示,PARP抑制剂联合免疫治疗(如抗CCR8抗体 depletion Treg、STING激动剂增强IFN信号)可协同增强抗肿瘤效应(如BRCA1突变TNBC模型中,PARP抑制剂+STING激动剂的完全缓解率达60%)。但临床数据异质性大:MEDIOLA试验中,PARP抑制剂+PD-L1抑制剂治疗gBRCA突变卵巢癌的客观缓解率(ORR)达92.2%;而JAVELIN试验中,BRCA队列的ORR仅26.4%,提示生物标志物选择的重要性。
文献的创新价值
现有研究多聚焦于HRD癌症的单一免疫细胞或通路,本文献的创新点在于:系统整合了HRD癌症TME的细胞组分、空间相互作用及分子机制,明确了“免疫激活-抑制平衡”是联合治疗的核心靶点;同时总结了联合治疗的临床前与临床证据,为HRD癌症的精准免疫治疗提供了“Biomarker-机制-治疗”的完整框架。
3. 研究思路总结与详细解析
本文献为系统性综述,研究思路遵循“基础定义→特征解析→机制探讨→临床应用”的闭环逻辑,核心目标是揭示HRD癌症TME的独特性及其对联合治疗的指导价值。以下按综述框架分步骤解析:
3.1 HRD的定义与检测方法
实验目的:明确HRD的生物学定义及临床检测标准。
方法细节:综述了当前HRD的三类检测方法——① 基因变异检测:通过NGS测序分析gBRCA/sBRCA及ATM、RAD51等HR基因的突变/甲基化;② 基因组瘢痕分析:通过全基因组测序计算LOH(杂合性缺失)、TAI(端粒等位基因不平衡)、LST(大片段转移)的评分,合并为GIS;③ 功能检测:通过免疫荧光检测DNA损伤诱导的RAD51核焦点形成(HR活性的金标准)。
结果解读:三类方法互补——基因变异检测直接识别HR缺陷的分子根源,基因组瘢痕反映HRD的累积效应,功能检测评估HR活性的功能性结果。例如,HGSOC中,约15%的患者存在gBRCA突变,6-7%存在sBRCA突变,而GIS评分可识别额外20%的HRD患者。
产品关联:文献未提及具体实验产品,领域常规使用NGS测序试剂盒(如FoundationOne CDx)、RAD51抗体(如Abcam ab133534)进行功能检测。
3.2 HRD癌症的遗传特征
实验目的:分析不同癌症的HR相关基因突变谱。
方法细节:整合TCGA、ICGC等数据库的泛癌测序数据,统计卵巢、乳腺、胰腺、前列腺癌中HR基因(BRCA1/2、ATM、RAD51、PALB2等)的突变频率。
结果解读:① 卵巢癌:HGSOC中约50%存在HRD,其中BRCA1/2突变率达30%,RAD51C/D、PALB2突变率约5%;② 乳腺癌:TNBC的HRD比例最高(40%),其中BRCA1突变率15%,ATM/RAD51突变率约10%;③ 胰腺癌:BRCA2/ATM突变率达20%,PALB2/CHEK2突变率约5%;④ 前列腺癌:BRCA2/ATM/CHEK2突变率合计约25%。
产品关联:文献未提及具体产品,领域常规使用泛癌HR基因panel(如Myriad myChoice HRD)进行检测。
3.3 TME的细胞组成与空间相互作用
实验目的:解析HRD癌症TME中免疫细胞的表型与空间分布。
方法细节:综述了单细胞RNA-seq、空间转录组、多重免疫荧光等技术的研究结果,分析T细胞、B细胞、NK细胞、巨噬细胞、CAF等细胞的表型及空间定位。
结果解读:
- T细胞:HRD肿瘤中CD8⁺T细胞密度较HR正常肿瘤高1.5-2倍,但80%以上的CD8⁺T细胞表达PD-1/LAG3,处于耗竭状态;Treg比例升高(HRD肿瘤中Treg占CD4⁺T细胞的20-30%,而HR正常肿瘤仅10-15%),且与CD8⁺T细胞密度正相关(提示免疫抑制的负反馈)。
- 空间分布:BRCA1/2突变肿瘤中,CD8⁺T细胞、NK细胞更靠近肿瘤细胞(距离<30μm的比例较HR正常肿瘤高40%),而HR正常肿瘤中免疫细胞主要分布在间质区。
- 其他免疫细胞:HRD肿瘤中NK细胞(GZMH⁺)比例升高但表达LAG3/TIGIT(耗竭表型),M2型巨噬细胞(CD206⁺)比例较HR正常肿瘤高2倍,CAF高表达CXCL12/IL-6(促进肿瘤侵袭与免疫抑制)。
产品关联:文献未提及具体产品,领域常规使用多重免疫荧光试剂盒(如Akoya PhenoCycler)分析空间分布。
3.4 TME的分子调控机制
实验目的:揭示HRD癌症TME免疫平衡的分子驱动因素。
方法细节:综述了抗原呈递、IFN信号、JAK-STAT、代谢通路的研究结果,整合RNA-seq、ChIP-seq等数据。
结果解读:
- 抗原呈递的动态变化:早期HRD肿瘤(如BRCA1突变乳腺上皮细胞)中HLA-DQB1、TAP1等抗原呈递基因表达上调,促进CD8⁺T细胞识别;但晚期转移瘤中,约30%的HRD患者出现HLA class I LOH(杂合性缺失),导致抗原呈递减弱,T细胞无法识别肿瘤。
- IFN与JAK-STAT信号:HRD细胞的DNA损伤激活cGAS-STING通路,促进IFN-α/β分泌,进而激活JAK-STAT通路,上调HLA和PD-L1表达(如BRCA1突变卵巢癌中PD-L1表达较HR正常肿瘤高3倍)。
- 代谢重编程:HRD细胞的OXPHOS(氧化磷酸化)和糖酵解通路活性升高(如BRCA1突变卵巢细胞中LDHB(糖酵解关键酶)表达上调2倍),满足高增殖需求的同时,代谢产物(如乳酸)抑制T细胞功能。
产品关联:文献未提及具体产品,领域常规使用IFN-α/β ELISA试剂盒(如R&D Systems)、代谢组学检测(如Agilent GC-MS)分析通路活性。
3.5 临床意义:预后与联合治疗
实验目的:探讨HRD特征对预后及联合治疗的指导价值。
方法细节:综述了临床队列研究(如HGSOC长生存者队列)、临床前模型(如BRCA1突变TNBC小鼠模型)及临床试验(如MEDIOLA、TOPACIO)的结果。
结果解读:
- 预后 biomarker:HRD评分高(GIS≥42)的HGSOC患者,铂类化疗的PFS较HR正常患者长6-8个月;CCNE1扩增(与BRCA1突变互斥)是HGSOC短生存的独立预测因子(OS较无扩增患者短12个月)。
- 联合治疗的临床前证据:PARP抑制剂联合Treg depletion(抗CCR8抗体)可显著降低BRCA1突变卵巢癌模型的肿瘤负荷(肿瘤体积较单药组小50%);联合STING激动剂可激活DC细胞,促进CD8⁺T细胞浸润,且诱导免疫记忆(肿瘤清除后再接种无复发)。
- 联合治疗的临床证据:MEDIOLA试验中,PARP抑制剂(奥拉帕利)+PD-L1抑制剂(度伐利尤单抗)治疗gBRCA突变卵巢癌的ORR达92.2%,PFS 11.1个月;TOPACIO试验中,尼拉帕利+帕博利珠单抗治疗BRCA突变TNBC的ORR 47%,PFS 8.3个月;但JAVELIN试验中,阿维鲁单抗+他拉唑帕利治疗BRCA队列的ORR仅26.4%,提示生物标志物选择的重要性。
产品关联:文献提及的临床药物包括奥拉帕利(PARP抑制剂)、度伐利尤单抗(PD-L1抑制剂)、尼拉帕利(PARP抑制剂)、帕博利珠单抗(PD-1抑制剂)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文献涉及的Biomarker分为三类:HRD状态相关Biomarker(基因变异、基因组瘢痕、功能活性)、TME免疫特征Biomarker(CD8⁺T细胞密度、Treg比例、PD-L1表达)、预后相关Biomarker(CCNE1扩增、HLA LOH)。筛选逻辑遵循“队列分析→功能验证→临床验证”的闭环:
1. 通过TCGA、ICGC等大队列分析HRD特征与TME、预后的关联;
2. 通过单细胞RNA-seq、空间组学验证Biomarker的细胞/空间特异性;
3. 通过临床前模型(如PDX模型)验证Biomarker对治疗响应的预测价值;
4. 通过临床试验(如MEDIOLA)验证Biomarker的临床有效性。
研究过程详述
- HRD状态Biomarker:
- 来源:肿瘤组织NGS测序数据、全基因组测序数据、免疫荧光实验结果。
- 验证方法:基因变异通过NGS测序验证,基因组瘢痕通过全基因组测序计算LOH/TAI/LST,功能活性通过RAD51核焦点实验验证。
特异性与敏感性:GIS评分识别HRD的敏感性达85%,特异性达90%;RAD51核焦点实验的敏感性达90%,特异性达88%(如HGSOC中,RAD51阴性患者的PARP抑制剂响应率较阳性患者高40%)。
TME免疫特征Biomarker:
- 来源:肿瘤组织多重免疫荧光、RNA-seq数据。
- 验证方法:CD8⁺T细胞密度通过免疫组化(IHC)定量,PD-L1表达通过IHC(22C3抗体)检测。
特异性与敏感性:CD8⁺T细胞密度≥100个/mm²的HRD患者,ICIs响应率较密度<100的患者高3倍;PD-L1阳性(CPS≥1)的HRD患者,联合治疗的ORR较阴性患者高25%(如MEDIOLA试验中,PD-L1阳性患者的ORR达95%,阴性患者为70%)。
预后相关Biomarker:
- 来源:肿瘤组织NGS测序数据。
- 验证方法:CCNE1扩增通过NGS拷贝数变异分析,HLA LOH通过全基因组测序验证。
- 特异性与敏感性:CCNE1扩增的HGSOC患者,铂类化疗的PFS较无扩增患者短5个月(HR=2.1,P<0.01);HLA LOH的HRD患者,OS较无LOH患者短10个月(HR=1.8,P<0.05)。
核心成果提炼
- HRD状态是PARP抑制剂与免疫治疗的双重Biomarker:HRD患者不仅对PARP抑制剂敏感(如BRCA突变患者的ORR达70%),且高TMB、新抗原负荷及CD8⁺T细胞浸润使HRD肿瘤对ICIs更敏感(如TOPACIO试验中BRCA突变TNBC的ORR达47%)。
- TME免疫特征预测联合治疗响应:CD8⁺T细胞密度高、PD-L1阳性的HRD患者,联合治疗的ORR较密度低、PD-L1阴性患者高2-3倍(如MEDIOLA试验中,CD8⁺T细胞密度≥100的患者ORR达98%)。
- 预后Biomarker指导风险分层:CCNE1扩增(HR=2.1)、HLA LOH(HR=1.8)是HRD患者的不良预后因子,可用于筛选高风险患者进行强化治疗。
总结
本文献系统解析了HRD癌症的TME独特景观,揭示了“高免疫原性与免疫抑制共存”的核心特征,为PARP抑制剂联合免疫治疗提供了三大关键启示:① HRD状态是联合治疗的核心Biomarker;② TME中的免疫激活表型(如CD8⁺T细胞密度、PD-L1表达)可进一步筛选响应患者;③ 针对免疫抑制因子(如Treg、M2巨噬细胞)的联合策略可增强疗效。未来研究需聚焦于:开发更精准的HRD检测方法(如整合基因变异与功能检测)、鉴定联合治疗的预测Biomarker(如IFN信号评分)、优化联合治疗方案(如PARP抑制剂+Treg depletion+STING激动剂),以提高HRD癌症的治疗响应率。
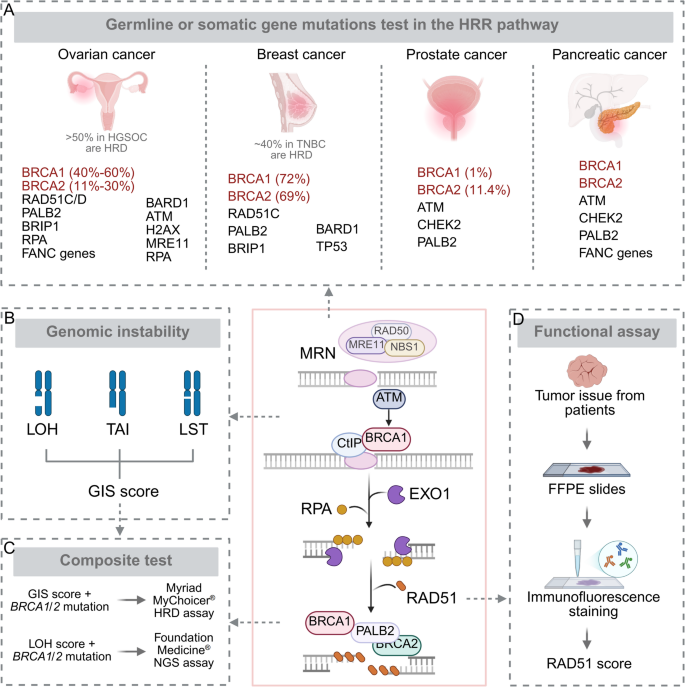
(Fig1:HRD的检测方法与遗传特征,包括基因变异、基因组瘢痕、功能检测及不同癌症的HR基因突变频率)
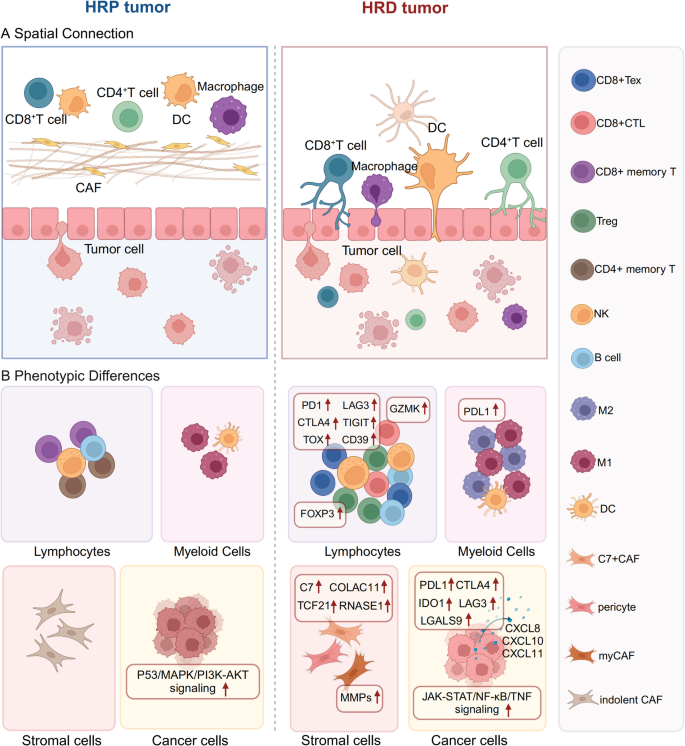
(Fig2:HRD癌症TME的细胞特征,展示CD8⁺T细胞、Treg、巨噬细胞的分布与表型)
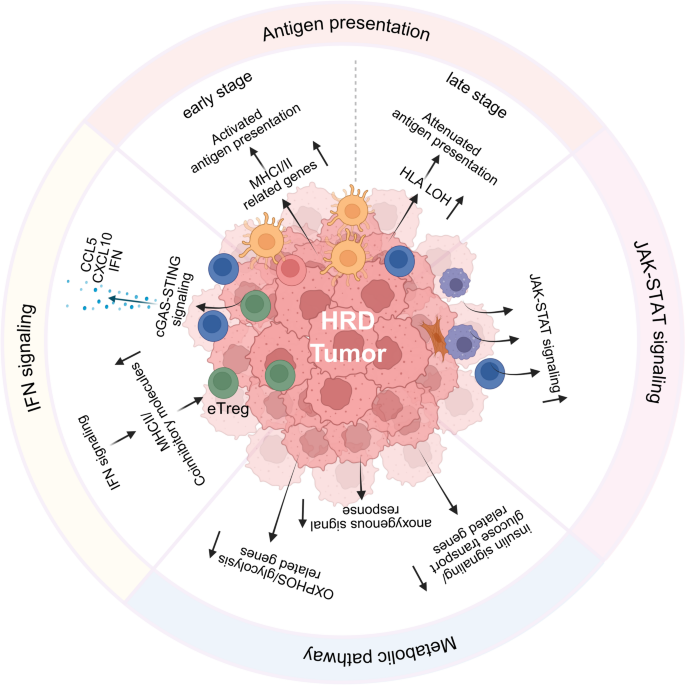
(Fig3:HRD癌症TME的分子机制,包括抗原呈递、IFN/JAK-STAT信号及代谢重编程)
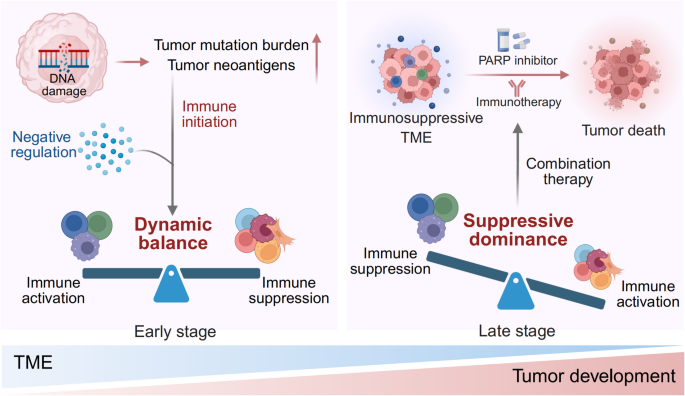
(Fig4:HRD癌症联合治疗的临床意义,展示免疫激活与抑制的平衡及联合治疗的策略)
