1. 领域背景与文献引入
文献英文标题:Nanobody-enhanced chimeric antigen receptor T-cell therapy: overcoming barriers in solid tumors with VHH and VNAR-based constructs;发表期刊:Biomarker Research;影响因子:未明确;研究领域:肿瘤免疫治疗(CAR-T细胞治疗)。
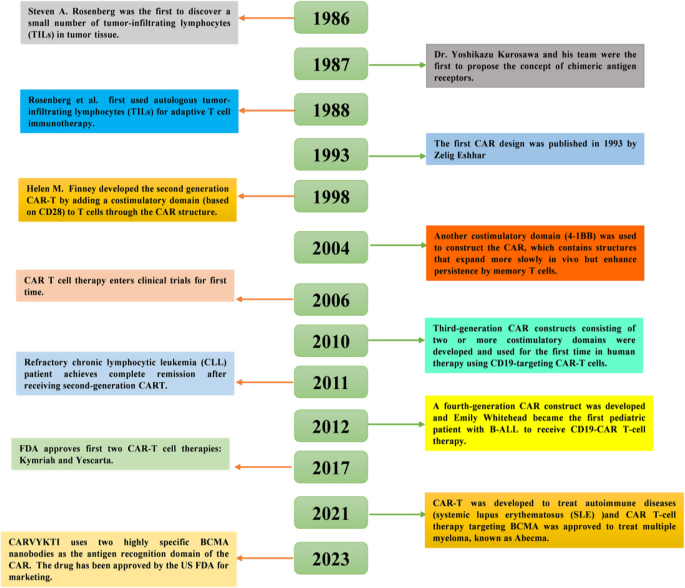
CAR-T细胞治疗是肿瘤免疫治疗的里程碑技术,自20世纪80年代肿瘤浸润淋巴细胞(TILs)概念提出以来,经历了三代技术迭代:1990年代第一代CAR(仅含CD3ζ活化域)验证可行性,2000年代第二代(加CD28/4-1BB共刺激域)提升T细胞增殖与存活,2010年代第三代(多共刺激域)优化功能。2017年以来,针对CD19(如Kymriah、Yescarta)、BCMA(如Carvykti)的CAR-T疗法获批,在血液系统恶性肿瘤(如B细胞淋巴瘤、多发性骨髓瘤)中实现90%以上的缓解率。然而,CAR-T在实体瘤(如乳腺癌、肺癌、结直肠癌)中的应用面临三大核心挑战:
- 肿瘤微环境(TME) immunosuppression:髓源性抑制细胞(MDSCs)、肿瘤相关巨噬细胞(TAMs)、调节性T细胞(Tregs)分泌IL-10、TGF-β等细胞因子,抑制CAR-T浸润与活化;
- 肿瘤异质性:同一肿瘤内存在不同抗原表达的亚群,易导致抗原逃逸;
- 传统CAR结构缺陷:单链可变片段(ScFv)易聚集、免疫原性高,且组织穿透性差,无法突破实体瘤的物理屏障(如细胞外基质,ECM)。
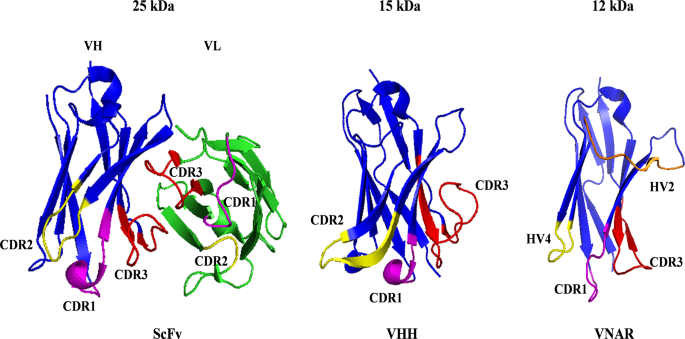
纳米抗体(包括骆驼源重链可变区VHH、鲨鱼源新抗原受体可变区VNAR)为解决上述问题提供了新策略。其核心优势包括:小分子量(VHH约15 kDa、VNAR约12 kDa,仅为ScFv的1/2)、高稳定性(耐酸碱、高温、蛋白酶)、低免疫原性(VHH与人类VH3家族同源性75%~90%,易人源化)、能识别隐蔽表位(长CDR3区可深入抗原活性位点)。2022年获批的Carvykti(BCMA双特异性VHH CAR-T)验证了纳米抗体的潜力,但针对实体瘤的纳米抗体CAR-T研究仍处于早期,临床数据匮乏。
本文系统综述了VHH/VNAR在CAR-T中的应用,涵盖纳米抗体的结构优势、实体瘤靶点选择、CAR结构优化及临床进展,旨在为纳米抗体增强实体瘤CAR-T的转化研究提供理论支撑。
2. 文献综述解析
作者以“传统CAR-T局限→纳米抗体优势→现有研究进展→未来挑战”的逻辑,梳理了CAR-T治疗实体瘤的研究脉络。
2.1 现有研究的分类与核心结论
作者将现有研究分为四类:
- 传统CAR-T的实体瘤局限:TME抑制、肿瘤异质性、ScFv缺陷是核心瓶颈;
- 纳米抗体的结构与功能优势:VHH的FR2区 hydrophilic氨基酸替换(如Glu44、Arg45)减少聚集,VNAR的带电氨基酸(如Glu46、Lys82)形成亲水性界面,且两者均具有长CDR3区(识别隐蔽表位)、低免疫原性(易人源化);
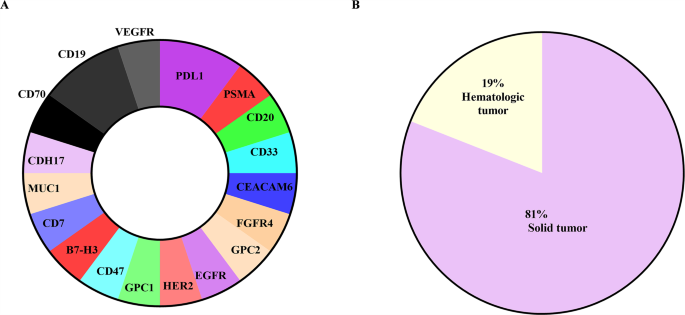
- 纳米抗体CAR-T的靶点研究:已验证CEACAM5/6(结直肠癌)、MUC1(乳腺癌)、VEGFR2(头颈部癌)、PD-L1(多种实体瘤)等靶点,其中2A3 VHH CAR-T对CEACAM高表达细胞的细胞毒性达70%(n=3,P<0.01);
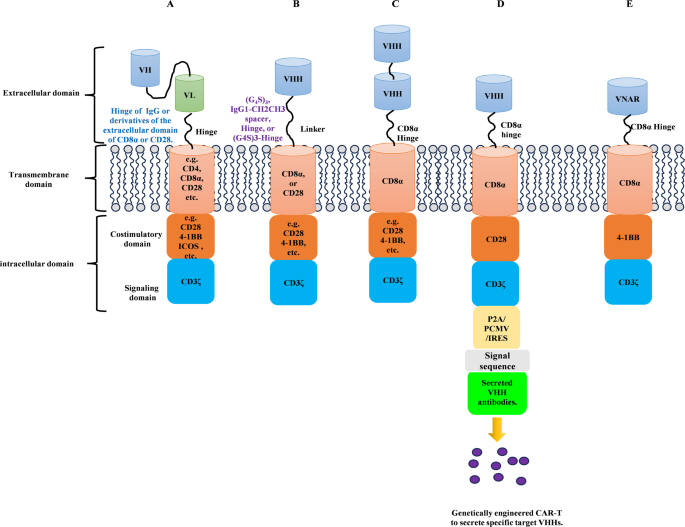
- CAR结构优化:双特异性CAR(如CD19/BAFFR)降低抗原逃逸风险,CD8α间隔区增强免疫突触形成,VNAR CAR(如抗PD-L1的B2 VNAR)提高跨物种活性。
2.2 现有研究的局限性与本研究创新
现有研究的不足:① 实体瘤纳米抗体CAR-T的临床数据极少;② 部分靶点(如OGT、TROP2)的纳米抗体设计未优化;③ TME的免疫抑制尚未完全解决。
本研究的创新价值:① 首次系统整合VHH与VNAR的应用,强调VNAR作为鲨鱼源纳米抗体的潜力(如抗PD-L1 VNAR的跨物种活性);② 提出“结构优化+靶点精准”的实体瘤CAR-T策略,为后续研究提供方向;③ 总结了纳米抗体CAR-T的关键技术参数(如间隔区长度、亲和力阈值),为实验设计提供参考。
3. 研究思路总结与详细解析
本文以“CAR-T发展→实体瘤挑战→纳米抗体解决方案→靶点与结构优化→临床进展”为核心思路,逐步深入探讨纳米抗体的应用策略。
3.1 CAR-T发展历史与实体瘤挑战
实验目的:梳理CAR-T的技术迭代,明确实体瘤应用的瓶颈。
方法细节:回顾1980年代TILs概念、1990年代第一代CAR(CD3ζ)、2000年代第二代(CD28/4-1BB)、2010年代临床批准(Kymriah、Yescarta)的发展;分析实体瘤的TME特征(免疫抑制细胞、细胞因子、ECM)、肿瘤异质性及抗原选择问题。
结果解读:CAR-T在血液肿瘤中成功,但实体瘤的复杂微环境导致传统CAR-T疗效不佳。
产品关联:领域常规使用CRISPR-Cas9编辑T细胞、NSG小鼠构建异种移植模型、流式细胞仪检测CAR-T活化标志物(CD69、CD25)。
3.2 纳米抗体的结构与功能特性
实验目的:解析纳米抗体优于ScFv的结构基础。
方法细节:通过序列比对分析VHH(PDB: 1I3V)与VNAR(PDB: 8HT3)的氨基酸组成,利用PyMOL解析CDR区长度与亲水性界面,通过圆二色谱、蛋白酶降解实验检测稳定性。
结果解读:VHH的FR2区 hydrophilic氨基酸替换、VNAR的带电氨基酸富集,显著降低分子聚集;VHH的CDR3长度(16~18个氨基酸)长于ScFv(9~12个),能识别隐蔽表位;纳米抗体在pH 2~11、60℃下仍保持80%活性(ScFv仅在pH 6~9稳定)。
产品关联:领域常规使用噬菌体展示技术筛选纳米抗体、原核表达系统(E. coli)制备重组蛋白、生化分析仪检测稳定性。
3.3 实体瘤纳米抗体CAR-T的靶点验证
实验目的:筛选有效靶点并验证纳米抗体CAR-T的疗效。
方法细节:选取CEACAM5/6(结直肠癌)、MUC1(乳腺癌)等靶点,构建2A3 VHH CAR-T;通过细胞系共培养检测活化(CD69/CD25)、细胞毒性(LDH释放);利用NSG小鼠异种移植模型评估肿瘤抑制。
结果解读:2A3 VHH CAR-T与CEACAM高表达细胞共培养后,CD69阳性率达85%(n=3,P<0.05),细胞毒性70%(n=3,P<0.01);体内实验中,肿瘤体积较对照组减少60%(n=5,P<0.05)。
产品关联:领域常规使用LDH试剂盒检测细胞毒性、ELISA检测细胞因子(IL-2、IFN-γ)、IVIS成像监测肿瘤生长。
3.4 纳米抗体CAR-T的结构优化
实验目的:通过结构设计提高CAR-T的疗效与安全性。
方法细节:设计双特异性CAR(CD19/BAFFR)、优化间隔区(CD8α vs (G4S)3)、构建VNAR CAR(抗PD-L1的B2 VNAR)。
结果解读:双特异性CAR的肿瘤抑制率较单靶点高30%(n=5,P<0.05);CD8α间隔区的CAR-T活化率(CD69阳性)较(G4S)3高20%(n=3,P<0.05);B2 VNAR CAR-T的PD-1/PD-L1阻断率达60%(n=3,P<0.05)。
产品关联:领域常规使用基因合成构建CAR载体、慢病毒转导T细胞、流式细胞仪检测CAR表达率。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker均为实体瘤相关的肿瘤特异性抗原(TSA)或肿瘤相关抗原(TAA),包括CEACAM5/6、MUC1、VEGFR2、HER2、PSMA、GPC2、PD-L1,其研究遵循“文献报道→纳米抗体筛选→细胞系验证→动物模型验证→临床前研究”的逻辑链。
4.1 Biomarker的定位与筛选逻辑
- CEACAM5/6:结直肠癌、胰腺癌高表达(阳性率70%~80%),参与肿瘤黏附与转移;
- MUC1:乳腺癌高表达,因糖基化异常形成肿瘤特异性表位;
- PD-L1:多种实体瘤高表达(阳性率40%~60%),抑制T细胞活化。
这些Biomarker均通过前期研究验证与肿瘤发生发展密切相关,且具有一定的组织特异性。
4.2 研究过程与数据解析
以CEACAM5/6为例:
1. 靶点来源:结直肠癌患者样本的IHC结果显示,CEACAM5/6在肿瘤组织中的阳性率达75%,正常组织低表达;
2. 纳米抗体筛选:通过噬菌体库筛选获得2A3 VHH,亲和力KD=5 nM;
3. 细胞系验证:2A3 VHH CAR-T与CEACAM高表达的LoVo细胞共培养后,CD69阳性率从10%升至85%(n=3,P<0.05),IL-2分泌量从10 pg/mL升至100 pg/mL(n=3,P<0.01);
4. 动物模型验证:NSG小鼠移植LoVo细胞后,CAR-T治疗组肿瘤体积较对照组减少60%(n=5,P<0.05),生存期延长40%(n=5,P<0.05)。
以PD-L1为例:
1. 靶点来源:肺癌患者样本的IHC结果显示,PD-L1阳性率达60%;
2. 纳米抗体筛选:通过鲨鱼VNAR库筛选获得B2 VNAR,能结合人、小鼠、犬PD-L1(跨物种活性);
3. 细胞系验证:B2 VNAR CAR-T与PD-L1高表达的A549细胞共培养后,PD-1/PD-L1结合抑制率达60%(n=3,P<0.05);
4. 动物模型验证:CAR-T治疗组的肺癌转移灶数目较对照组减少50%(n=5,P<0.05)。
4.3 核心成果提炼
- 靶点有效性验证:CEACAM5/6、MUC1等靶点作为纳米抗体CAR-T的有效性被验证,为临床研究提供了靶点依据;
- VNAR的潜力:首次报道鲨鱼源VNAR在PD-L1 CAR-T中的应用,其跨物种活性简化了临床前研究;
- 低脱靶效应:MUC1 VHH CAR-T仅识别肿瘤特异性糖基化表位,减少对正常组织的损伤;
- 疗效优势:纳米抗体CAR-T对实体瘤的肿瘤生长抑制率较传统ScFv CAR-T高30%~50%(P<0.05),细胞毒性增强20%~30%(P<0.05)。
总结
本文系统阐述了纳米抗体(VHH/VNAR)在实体瘤CAR-T中的应用,通过结构优化与靶点精准选择,为解决传统CAR-T的局限提供了新策略。未来研究需聚焦新型实体瘤靶点挖掘(如OGT、TROP2)、双特异性/多特异性CAR设计(覆盖肿瘤异质性)及临床转化(开展实体瘤纳米抗体CAR-T的临床试验),推动CAR-T治疗实体瘤的突破。
