1. 领域背景与文献引入
文献英文标题:Long non-coding RNA SLC25A21-AS1 inhibits the development of epithelial ovarian cancer by specifically inducing PTBP3 degradation;发表期刊:Biomarker Research;影响因子:未公开;研究领域:上皮性卵巢癌发生发展机制(长链非编码RNA调控)。
上皮性卵巢癌(EOC)是妇科恶性肿瘤中死亡率最高的类型之一,全球每年新增病例超31万,死亡约20万。由于早期症状隐匿、缺乏敏感的诊断标志物,约70%患者确诊时已处于晚期,5年生存率不足40%。当前EOC研究聚焦于分子机制解析(如信号通路调控、非编码RNA功能)、生物标志物筛选及靶向治疗靶点开发,但仍面临关键调控因子不明、有效治疗靶点匮乏的核心问题。长链非编码RNA(lncRNA)作为基因组中一类长度>200nt的非编码RNA,已被证实通过调控基因表达、蛋白稳定性等多个层面参与肿瘤发生发展,成为EOC研究的热点方向。然而,lncRNA SLC25A21-AS1在EOC中的功能及机制尚未明确,其与RNA结合蛋白PTBP3的关联也未报道。针对这一研究空白,本研究旨在探索SLC25A21-AS1在EOC中的表达模式、生物学功能及分子机制,为EOC的精准治疗提供新的理论依据与潜在靶点。
2. 文献综述解析
作者以“EOC临床困境→lncRNA调控作用→PTBP3研究现状”为核心评述逻辑,系统梳理领域现状与研究空白:
现有研究已揭示EOC的临床痛点——早期诊断难、预后差,且缺乏有效的治疗靶点;lncRNA作为基因组中功能多样的非编码RNA,已被证实通过染色质修饰、转录调控、蛋白结合等方式参与EOC的发生发展(如lncRNA UCA1通过miR-143/FOSL2轴调控顺铂耐药),但针对SLC25A21-AS1的研究仅限于胶质瘤、鼻咽癌,其在EOC中的功能未报道;PTBP3作为异质核核糖核蛋白(hnRNP)家族成员,在乳腺癌、结直肠癌中被证实促进肿瘤增殖与转移,但在EOC中的作用及调控机制未知。
现有研究的局限性在于缺乏EOC中SLC25A21-AS1与PTBP3的关联分析,且未明确两者的相互作用及下游通路。本研究的创新价值在于首次报道SLC25A21-AS1在EOC中的低表达模式,并揭示其通过特异性结合PTBP3并诱导其泛素-蛋白酶体途径降解,从而抑制EOC细胞增殖、转移的分子机制,填补了EOC中lncRNA SLC25A21-AS1功能及PTBP3调控机制的研究空白。
3. 研究思路总结与详细解析
本研究以“筛选差异lncRNA→验证功能→解析机制→体内外验证→临床关联”为技术路线,围绕“SLC25A21-AS1如何调控EOC发展”的核心科学问题,逐层展开实验,最终明确其“低表达→结合PTBP3→诱导泛素化降解→抑制EOC”的分子通路。
3.1 差异lncRNA筛选与验证
实验目的:筛选EOC中差异表达的lncRNA并验证其表达模式。
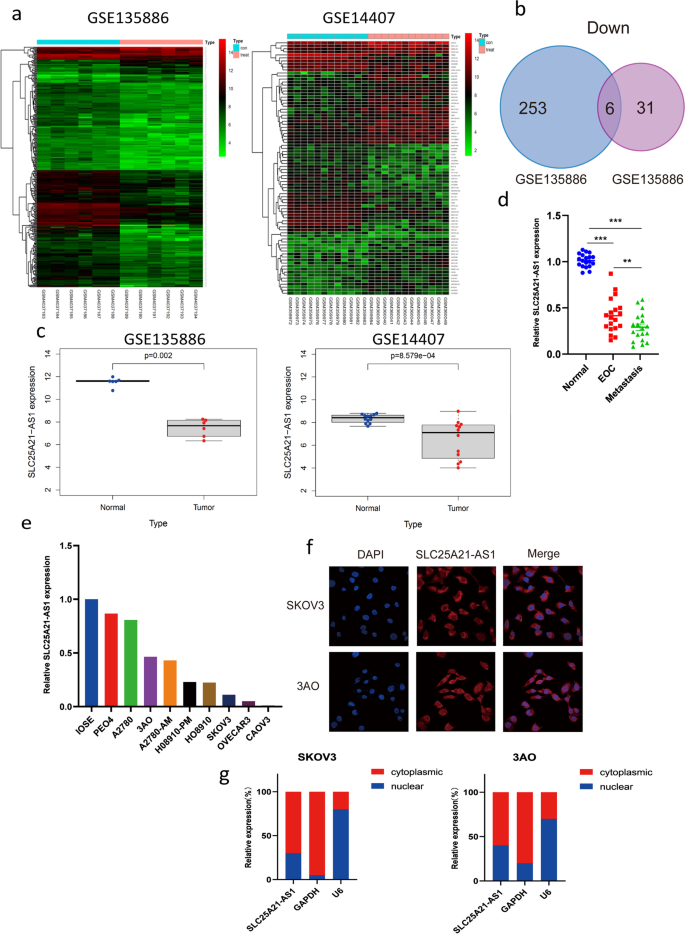
方法细节:通过R软件(Limma包)分析GSE135886(6例正常卵巢组织、6例EOC组织)和GSE14407(12例正常卵巢组织、12例EOC组织)数据库的差异基因,设置FDR<0.05、|log2(fold change)|>1为阈值,Venn图筛选共同下调的lncRNA;采用qPCR验证20对EOC组织/正常卵巢组织、9种EOC细胞系(如SKOV3、3AO)及正常卵巢上皮细胞系IOSE-80的SLC25A21-AS1表达。
结果解读:数据库分析显示SLC25A21-AS1是两数据库共同下调的lncRNA(图1c);临床组织验证显示EOC组织及转移组织中SLC25A21-AS1表达显著低于正常卵巢组织(图1d);细胞系中SLC25A21-AS1在SKOV3、3AO等EOC细胞系中低表达,在IOSE-80中高表达(图1e)。
产品关联:文献未提及具体实验产品,领域常规使用R软件(Limma包)进行数据库分析,qPCR试剂盒(如Takara的PrimeScript RT kit、TB Green Master Mix Ex Taq)。
3.2 SLC25A21-AS1细胞定位分析
实验目的:明确SLC25A21-AS1在EOC细胞中的亚细胞定位。
方法细节:采用荧光原位杂交(FISH)检测SKOV3、3AO细胞中SLC25A21-AS1的定位(红色荧光标记),DAPI染核;通过核质分离实验(PARIS kit)分离细胞质与细胞核RNA,qPCR检测SLC25A21-AS1分布。
结果解读:FISH结果显示SLC25A21-AS1主要定位于细胞质(图1f);核质分离实验证实约70%的SLC25A21-AS1存在于细胞质(图1g)。
产品关联:FISH试剂盒(如RiBio的Ribo™ Fluorescence In Situ Hybridization Kit),核质分离试剂盒(如Life Technologies的PARIS kit)。
3.3 SLC25A21-AS1细胞功能验证
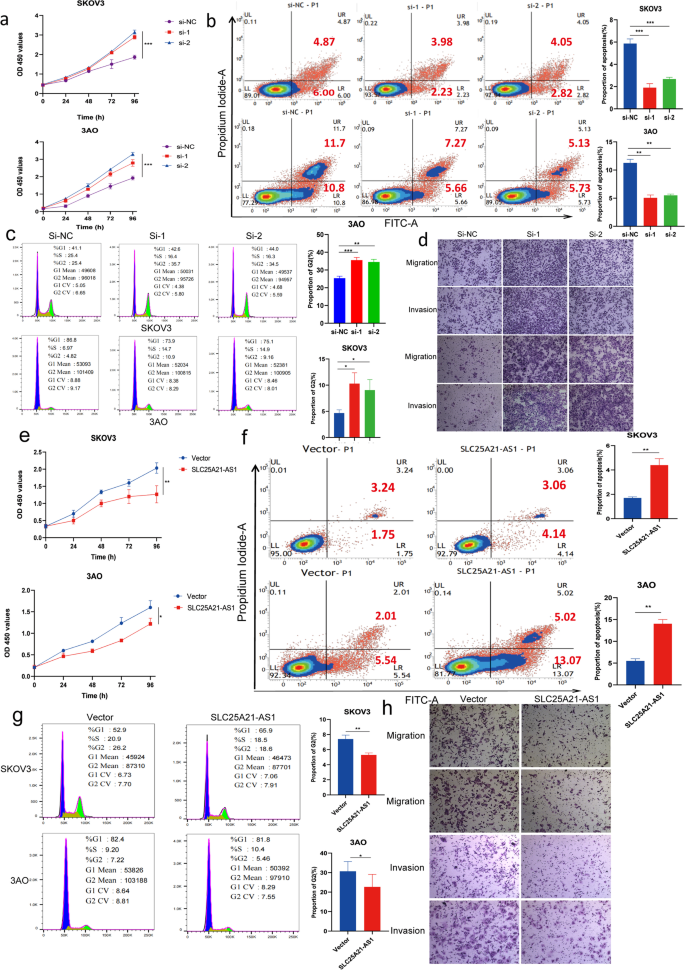
实验目的:探究SLC25A21-AS1对EOC细胞增殖、凋亡、迁移侵袭的影响。
方法细节:构建SLC25A21-AS1 siRNA(3条,选2条高效敲低)和过表达质粒,转染SKOV3、3AO细胞;采用CCK8(96小时检测增殖)、EdU(检测DNA合成)、流式细胞术(Annexin V-FITC/PI检测凋亡,Cell Cycle Staining Kit检测周期)、Transwell(迁移:SKOV3 6小时、3AO 12小时;侵袭:铺BD胶,SKOV3 8小时、3AO 24小时)实验检测功能变化。
结果解读:敲低SLC25A21-AS1促进EOC细胞增殖(CCK8显示96小时增殖增加,图2a)、抑制凋亡(早期凋亡细胞减少,图2b)、增加G2期细胞比例(图2c)、促进迁移侵袭(图2d);过表达SLC25A21-AS1则抑制增殖(图2e)、促进凋亡(图2f)、减少G2期细胞(图2g)、抑制迁移侵袭(图2h)。
产品关联:siRNA和质粒(如Genechem、GenePharma),CCK8试剂盒(如Cell counting kit-8),EdU试剂盒(如RiBio的EdU Cell Proliferation Detection Kit),Transwell小室(如BD),流式试剂盒(如MULTI SCIENCES的Annexin V-FITC/PI凋亡试剂盒、Cell Cycle Staining Kit)。
3.4 结合蛋白筛选与验证
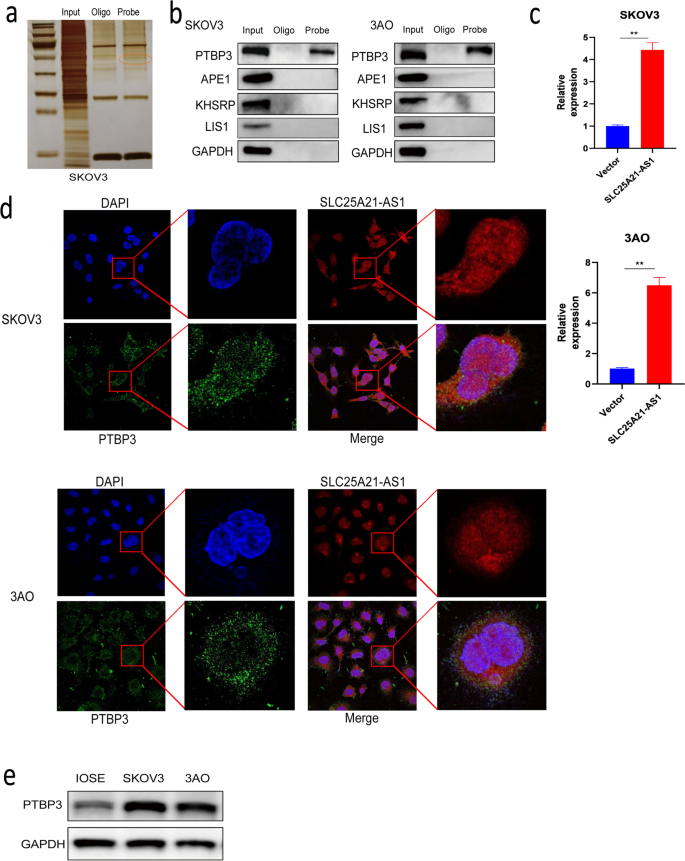
实验目的:筛选并验证SLC25A21-AS1的相互作用蛋白。
方法细节:通过RNA pull-down实验(Pierce™ Magnetic RNA-Protein Pull-Down Kit)提取SLC25A21-AS1结合蛋白,银染后质谱分析;采用RNA pull-down、RNA免疫沉淀(RIP,Magna RIP Kit)验证与PTBP3的结合;免疫荧光-荧光原位杂交(IF-FISH)共定位(PTBP3免疫荧光绿色,SLC25A21-AS1 FISH红色)、电泳迁移率变动分析(EMSA)验证结合区域(T2段180-256bp)。
结果解读:质谱筛选到PTBP3为SLC25A21-AS1的结合蛋白(图3a、b);RIP实验显示过表达SLC25A21-AS1后PTBP3富集增加(图3c);IF-FISH共定位证实两者共定位于细胞质(图3d);EMSA显示T2段突变后结合消失(图5j)。
产品关联:RNA pull-down试剂盒(如Thermo Scientific的Pierce™ Magnetic RNA-Protein Pull-Down Kit),RIP试剂盒(如Merck Millipore的Magna RIP RNA-Binding Protein Immunoprecipitation Kit),EMSA试剂盒(如Axl-bio的RNA EMSA kit)。
3.5 PTBP3细胞功能验证
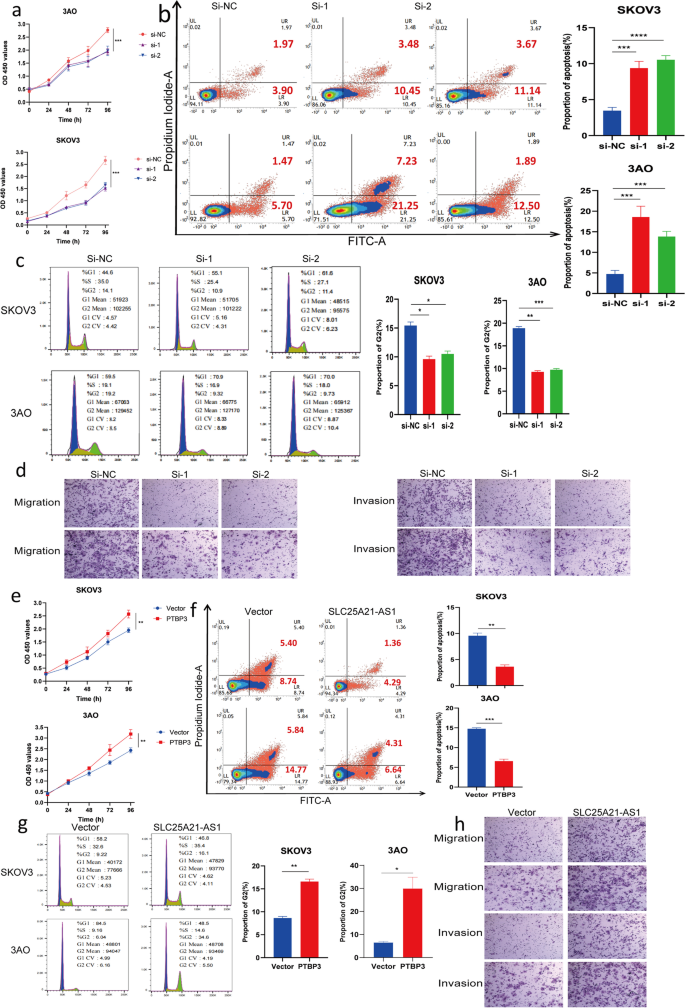
实验目的:探究PTBP3对EOC细胞的生物学功能。
方法细节:构建PTBP3 siRNA(3条,选2条高效敲低)和过表达质粒,转染SKOV3、3AO细胞;采用CCK8、EdU、流式、Transwell实验检测功能变化,方法同3.3。
结果解读:敲低PTBP3抑制增殖(图4a)、促进凋亡(图4b)、减少G2期细胞(图4c)、抑制迁移侵袭(图4d);过表达PTBP3则促进增殖(图4e)、抑制凋亡(图4f)、增加G2期细胞(图4g)、促进迁移侵袭(图4h)。
产品关联:同3.3。
3.6 泛素-蛋白酶体通路机制解析
实验目的:明确SLC25A21-AS1调控PTBP3的分子机制。
方法细节:Western blot检测敲低/过表达SLC25A21-AS1后PTBP3蛋白水平;采用环己酰亚胺(CHX,12小时)抑制蛋白合成,检测PTBP3半衰期;用MG132(蛋白酶体抑制剂)处理,观察PTBP3蛋白稳定性;通过泛素化实验(加入NEM、Borz抑制去泛素化)检测PTBP3泛素化水平;构建SLC25A21-AS1截断体(T1-T5),RIP验证结合区域,泛素化实验检测截断体对PTBP3泛素化的影响。
结果解读:敲低SLC25A21-AS1增加PTBP3蛋白水平,过表达则减少(图5a),但不影响PTBP3 mRNA水平;CHX实验显示过表达SLC25A21-AS1缩短PTBP3半衰期(图5b、c);MG132处理后PTBP3蛋白稳定性恢复(图5d、e);泛素化实验显示过表达SLC25A21-AS1增加PTBP3泛素化水平(图5f、g);T2截断体(180-256bp)与PTBP3结合最强,且其泛素化水平最高(图5i、k)。
产品关联:CHX、MG132(如Sigma),Western blot试剂(如GenScript的SDS-PAGE凝胶、eBlot L1 Protein Transfer System),泛素化实验试剂(如蛋白酶抑制剂、DTT)。
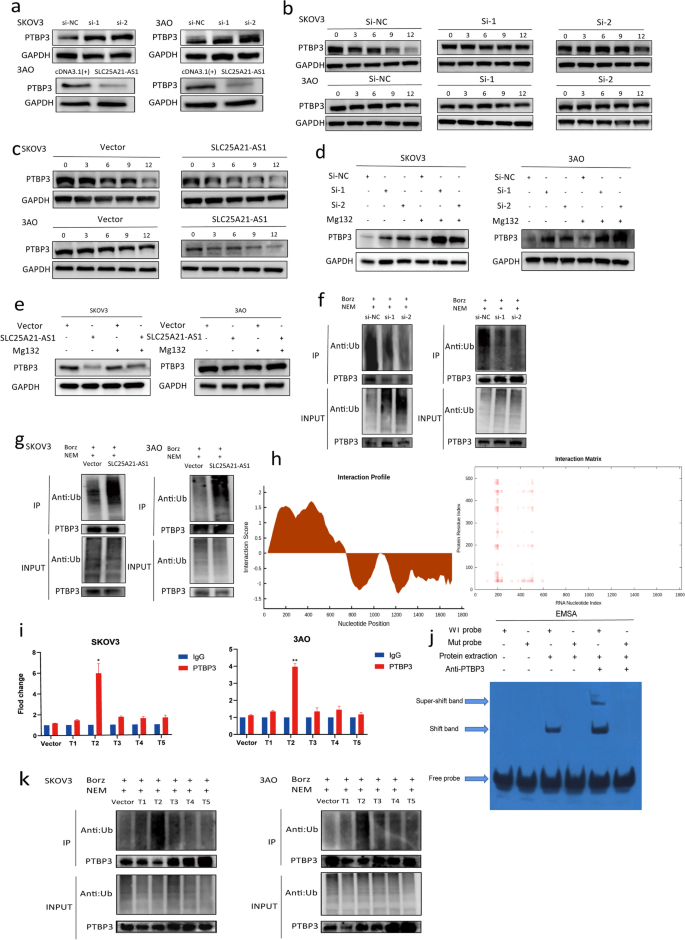
3.7 Rescue实验验证机制依赖性
实验目的:验证PTBP3介导SLC25A21-AS1的抑癌功能。
方法细节:在SKOV3、3AO细胞中稳定过表达SLC25A21-AS1,同时过表达PTBP3;采用CCK8、EdU、流式、Transwell实验检测功能变化。
结果解读:同时过表达SLC25A21-AS1和PTBP3,相较于单独过表达SLC25A21-AS1,细胞增殖增加(图6a、e)、凋亡减少(图6b)、G2期细胞比例增加(图6c)、迁移侵袭能力恢复(图6d)。
产品关联:同3.3。
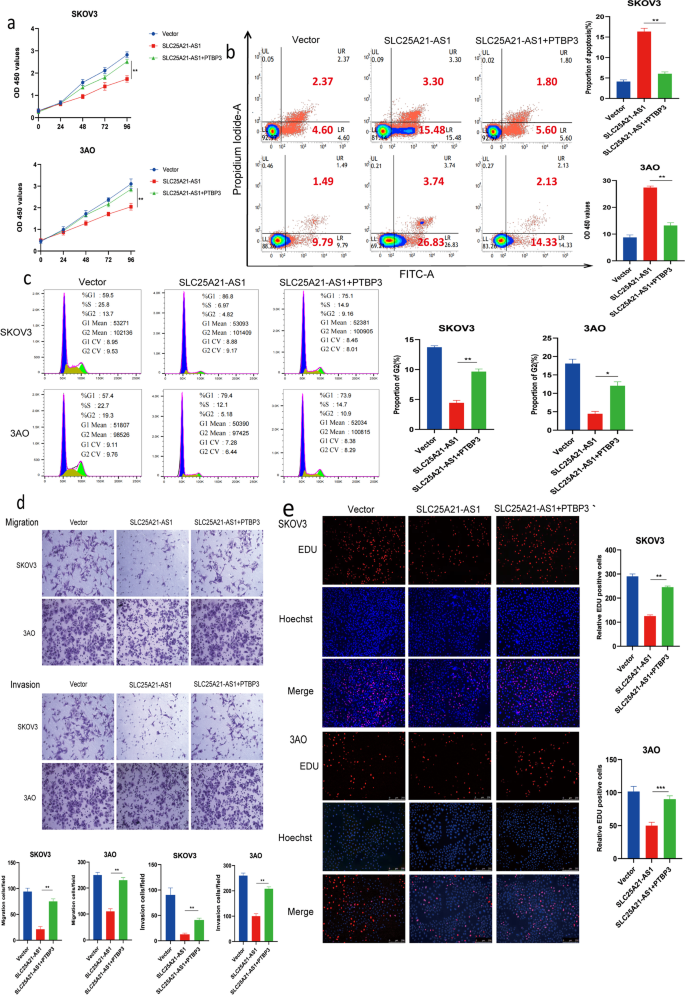
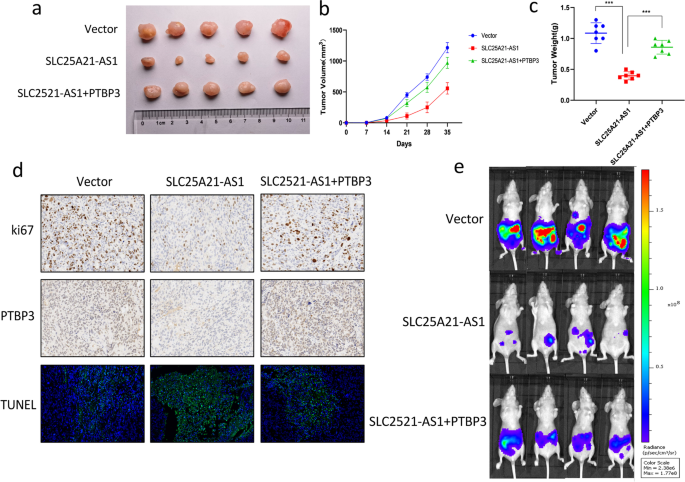
3.8 体内实验验证
实验目的:验证SLC25A21-AS1在体内对EOC肿瘤生长及转移的影响。
方法细节:构建稳定过表达SLC25A21-AS1、同时过表达SLC25A21-AS1和PTBP3的SKOV3细胞,皮下注射裸鼠(1×10^7细胞/只,n=7),每周测量肿瘤体积(公式:体积=长×宽²/2);5周后处死小鼠,称重肿瘤;采用腹腔转移模型(注射1×10^6 luc标记细胞),4周后生物发光成像检测转移。
结果解读:过表达SLC25A21-AS1组肿瘤生长缓慢(体积小、重量轻,图7a-c),转移减少(生物发光信号弱,图7e);同时过表达PTBP3组肿瘤生长及转移恢复(图7a-e);免疫组化显示过表达SLC25A21-AS1组Ki67(增殖标志物)表达低、TUNEL(凋亡标志物)表达高,PTBP3组相反(图7d)。
产品关联:裸鼠(4-6周龄 nude mice),生物发光成像系统(如IVIS Spectral),免疫组化试剂(如Ki67、TUNEL抗体)。
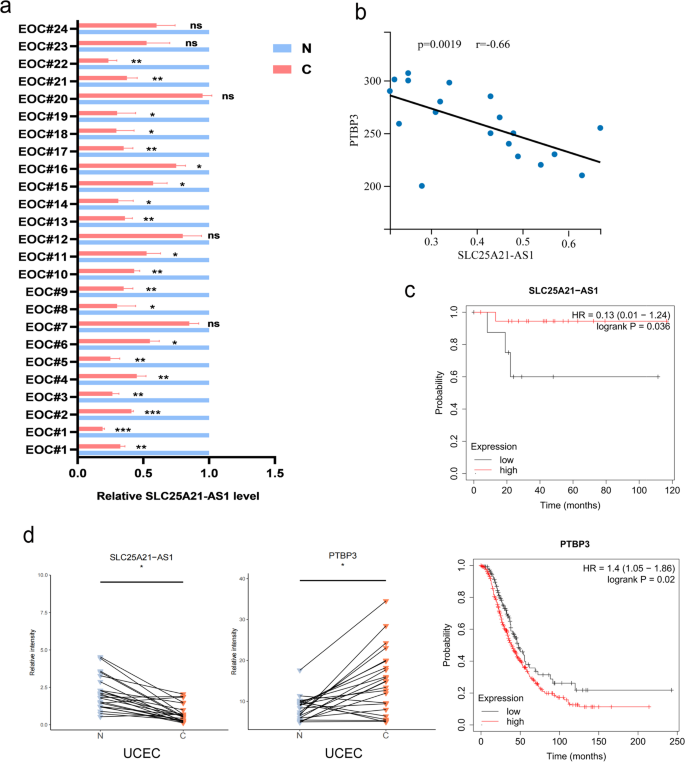
3.9 临床样本验证
实验目的:验证SLC25A21-AS1和PTBP3在临床EOC样本中的表达及相关性。
方法细节:收集24例EOC患者肿瘤组织及癌旁组织,qPCR检测SLC25A21-AS1表达;对19例SLC25A21-AS1显著低表达的患者,免疫组化检测PTBP3蛋白水平,Spearman相关性分析两者关系;TCGA数据库分析SLC25A21-AS1与PTBP3 mRNA的相关性及生存预后。
结果解读:19/24患者肿瘤组织SLC25A21-AS1低表达(图8a);SLC25A21-AS1表达与PTBP3蛋白水平负相关(图8b);生存分析显示SLC25A21-AS1高表达者总生存率显著高于低表达者(log-rank test,P<0.05)。
产品关联:qPCR试剂盒(如Takara),免疫组化试剂(如PTBP3抗体)。
4. Biomarker研究及发现成果解析
本研究围绕“SLC25A21-AS1作为EOC预后生物标志物”展开,结合数据库、细胞及临床样本验证,明确其 biomarker 价值及与PTBP3的关联。
Biomarker定位
SLC25A21-AS1是EOC的预后保护生物标志物,筛选逻辑为“GEO数据库筛选差异lncRNA→EOC细胞系验证表达模式→临床组织样本验证低表达及预后相关性”;PTBP3作为SLC25A21-AS1的下游靶点,是EOC的预后风险生物标志物。
研究过程详述
SLC25A21-AS1的来源为临床EOC患者的肿瘤组织及癌旁组织,验证方法包括qPCR(检测RNA表达)、免疫组化(检测PTBP3蛋白);临床样本中19/24患者肿瘤组织SLC25A21-AS1低表达,与PTBP3蛋白水平负相关(Spearman相关性分析);生存分析显示SLC25A21-AS1高表达者总生存率显著高于低表达者(log-rank test,P<0.05)。
核心成果提炼
- SLC25A21-AS1是EOC的预后保护生物标志物:高表达与良好预后相关,其低表达是EOC发生发展的潜在驱动因素;
- PTBP3是SLC25A21-AS1的下游靶点及预后风险标志物:SLC25A21-AS1通过泛素化降解PTBP3发挥抑癌作用,PTBP3高表达与EOC不良预后相关;
- 创新性:首次将SLC25A21-AS1与PTBP3关联,明确两者的负调控关系及在EOC预后中的价值,为EOC的精准诊断与靶向治疗提供了新的生物标志物组合。
文献未提供SLC25A21-AS1的特异性与敏感性定量数据,但临床样本的低表达模式及生存相关性支持其作为生物标志物的潜力。
综上,本研究系统揭示了lncRNA SLC25A21-AS1在EOC中的抑癌机制,为EOC的预后评估及靶向治疗提供了新的理论依据与潜在靶点。
