1. 领域背景与文献引入
文献英文标题:The role and metabolic adaptations of neutrophils in premetastatic niches;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤转移前微环境与中性粒细胞代谢。
肿瘤转移是导致癌症患者死亡的主要原因,其过程不仅依赖肿瘤细胞的转移能力,更需要远处器官形成转移前微环境(premetastatic niche, PMN)——即肿瘤细胞到达前,由原发肿瘤诱导的适合其定植的微环境。2005年Kaplan等首次提出这一概念,指出骨髓来源的VEGFR1+造血祖细胞提前聚集在转移前肺组织,为肿瘤细胞定植“铺路”。近年来,肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs)作为PMN的关键组成细胞,其招募机制(如肿瘤分泌G-CSF、IL-8等因子)、极化状态(N1抗肿瘤/N2促转移)及功能(免疫抑制、促血管生成)已被部分解析,但TANs在PMN中如何通过代谢适应维持促转移功能的机制仍不清楚。本文通过系统综述中性粒细胞在PMN中的作用及代谢变化,填补了这一研究空白,为开发靶向TANs的转移干预策略提供了理论基础。
2. 文献综述解析
作者围绕“肿瘤招募TANs—TANs趋化至PMN—TANs极化—TANs塑造PMN—TANs代谢适应”的逻辑,将现有研究分为五大类:
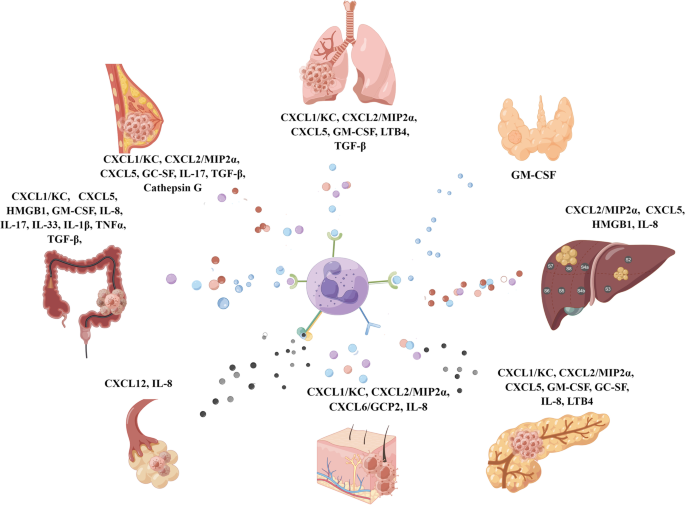
1. 肿瘤来源因子招募TANs:乳腺癌、胰腺癌等肿瘤细胞分泌G-CSF(通过G-CSFR)、GM-CSF(通过GM-CSFR)、IL-8(通过CXCR1/2)等因子,诱导骨髓中性粒细胞分化并招募至肿瘤组织;
2. TANs向PMN的趋化:趋化因子轴(如CXCR4/CXCL12)介导TANs向肝、肺等PMN趋化,肿瘤外泌体通过传递RNA激活肺上皮细胞TLR3,诱导CXCL1/2分泌进一步招募TANs;
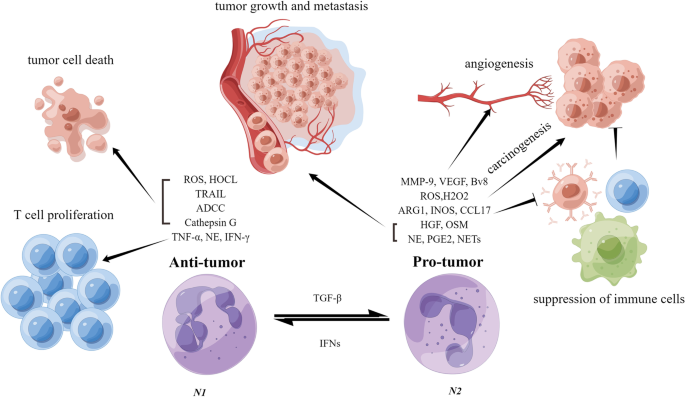
3. TANs极化状态改变:PMN中的细胞因子(如TGF-β)诱导TANs从具有细胞毒性的N1型(CD11b+Ly6G+Ly6C+,分泌ROS、TRAIL)向促转移的N2型(CD11b+Ly6G+Ly6C low,分泌Arg1、CCL17)转变;
4. TANs塑造PMN的功能:N2型TANs通过分泌Arg1消耗L-精氨酸抑制T细胞增殖,释放MMP9降解细胞外基质(ECM)促进血管生成,形成中性粒细胞胞外陷阱(neutrophil extracellular traps, NETs)捕获循环肿瘤细胞(CTCs);
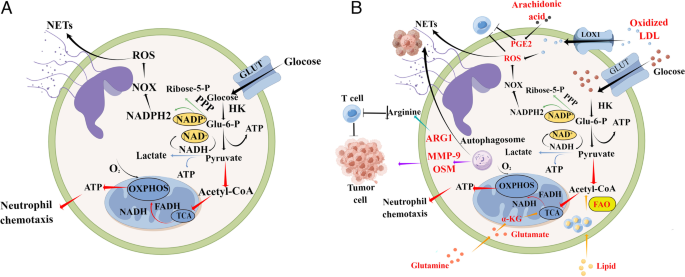
5. TANs的代谢适应:TANs主要依赖糖酵解供能(增强HK、PKM2活性),但在营养限制时可通过谷氨酰胺分解、氧化磷酸化(OXPHOS)或脂肪酸氧化(FAO)维持ATP生成,如未成熟低密度中性粒细胞(iLDNs)通过谷氨酰胺分解支持NETs形成。
现有研究已明确TANs在PMN中的促转移作用,但代谢适应的分子机制及靶向代谢的治疗策略仍未解决。本文的创新点在于系统整合了TANs的“功能作用”与“代谢调控”,为理解PMN形成的代谢驱动机制提供了全景视角。
3. 研究思路总结与详细解析
本文为综述性研究,整体思路是系统检索1999—2023年PubMed、Web of Science数据库中关于“中性粒细胞+转移前微环境”的研究,按“招募—趋化—极化—功能—代谢”的逻辑分类阐述。
3.1 肿瘤来源因子对中性粒细胞的招募
实验目的:解析肿瘤细胞通过分泌因子招募中性粒细胞的机制。
方法细节:回顾不同肿瘤(乳腺癌、胰腺癌、肺癌等)分泌的细胞因子(G-CSF、GM-CSF、IL-8)研究,通过ELISA检测细胞因子水平,流式细胞仪分析中性粒细胞表面受体(G-CSFR、CXCR1/2)表达,动物模型(如肿瘤细胞移植小鼠)验证因子的招募作用。
结果解读:研究发现,乳腺癌细胞分泌G-CSF通过G-CSFR招募中性粒细胞(Nywening等2018年研究);卵巢癌细胞分泌IL-8通过CXCR1/2诱导中性粒细胞趋化(Yang等2020年研究);这些因子共同构成“肿瘤—中性粒细胞”的招募轴,为PMN形成奠定基础。
产品关联:文献未提及具体实验产品,领域常规使用ELISA试剂盒检测细胞因子、流式细胞仪分析中性粒细胞表型。
3.2 中性粒细胞向转移前微环境的趋化机制
实验目的:探讨TANs向PMN趋化的分子驱动因素。
方法细节:回顾趋化因子轴(CXCR4/CXCL12、CXCR2/CXCL5)、肿瘤外泌体的研究,通过体内阻断实验(如CXCR4抗体)、外泌体荧光追踪验证作用。
结果解读:Muller等2001年研究发现,阻断CXCR4/CXCL12相互作用可减少乳腺癌肺转移;Liu等2016年研究显示,肿瘤外泌体RNA激活肺上皮细胞TLR3,诱导CXCL1/2分泌,进一步招募中性粒细胞至肺PMN;这些机制共同促进TANs向PMN的“定向迁移”。
产品关联:文献未提及具体实验产品,领域常规使用趋化因子抗体、荧光标记外泌体试剂盒。
3.3 转移前微环境中中性粒细胞的极化状态改变
实验目的:明确TANs在PMN中的极化方向及功能差异。
方法细节:通过流式细胞仪分析中性粒细胞表面标志物(N1:CD11b+Ly6G+Ly6C+;N2:CD11b+Ly6G+Ly6C low),功能实验(ROS检测、T细胞增殖实验)验证极化后的作用。
结果解读:Fridlender等2009年研究发现,TGF-β可诱导N1向N2极化,N2型TANs通过分泌Arg1消耗L-精氨酸,抑制T细胞增殖;Andzinski等2016年研究显示,I型干扰素可诱导N1极化,增强中性粒细胞的ROS生成和肿瘤细胞杀伤能力;极化状态的转变是TANs从“抗肿瘤”向“促转移”转化的关键。
产品关联:文献未提及具体实验产品,领域常规使用流式抗体(抗CD11b、Ly6G、Ly6C)、ROS检测试剂盒。
3.4 中性粒细胞在建立转移前微环境中的作用
实验目的:解析TANs塑造PMN的功能机制。
方法细节:回顾免疫抑制(CCL17招募Tregs)、促血管生成(MMP9降解ECM)、NETs捕获CTCs的研究,通过中性粒细胞耗竭实验(抗Ly6G抗体)、细胞共培养验证作用。
结果解读:Mishalian等2014年研究发现,TANs分泌CCL17招募调节性T细胞(Tregs),诱导PMN免疫抑制;Christoffersson等2012年研究显示,TANs释放MMP9降解ECM,释放VEGF促进血管生成;Park等2016年研究指出,NETs通过DNA网状结构捕获CTCs,增强其在肺PMN的定植能力;这些功能共同构建了“适合肿瘤细胞生存”的PMN。
产品关联:文献未提及具体实验产品,领域常规使用中性粒细胞耗竭抗体、MMP9检测试剂盒。
3.5 肿瘤相关中性粒细胞的代谢适应
实验目的:探讨TANs在PMN中的代谢重编程机制。
方法细节:回顾糖酵解(HK、PKM2活性检测)、谷氨酰胺分解(谷氨酰胺酶检测)、OXPHOS(线粒体功能分析)、FAO(FATP2检测)的研究,通过代谢抑制剂实验(如2-DG抑制糖酵解)验证代谢途径的作用。
结果解读:Jiang等2022年研究发现,TANs通过增强糖酵解促进NETs形成;Hsu等2019年研究显示,营养限制时,未成熟低密度中性粒细胞(iLDNs)通过谷氨酰胺分解维持ATP生成;Veglia等2019年研究指出,脂肪酸转运蛋白2(FATP2)促进TANs的FAO,诱导免疫抑制;这些代谢适应确保TANs在营养匮乏的PMN中持续发挥促转移功能。
产品关联:文献未提及具体实验产品,领域常规使用代谢抑制剂(如2-DG)、线粒体功能检测试剂盒。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的Biomarker分为两类:
1. 极化状态 Biomarker:N1型(CD11b+Ly6G+Ly6C+)、N2型(CD11b+Ly6G+Ly6C low),通过流式细胞仪在小鼠肿瘤模型和乳腺癌患者外周血中筛选,功能实验验证其抗肿瘤/促转移活性;
2. 代谢相关 Biomarker:脂肪酸转运蛋白2(FATP2)、精氨酸酶1(Arg1)、NADPH氧化酶(NOX),通过免疫组化在肿瘤组织中检测,代谢抑制剂实验验证其调控TANs功能的作用。
研究过程与核心成果
- 极化状态 Biomarker:Fridlender等2009年研究显示,小鼠乳腺癌模型中,TGF-β诱导的N2型中性粒细胞比例为60%(n=10,P<0.05),显著高于正常组织的15%;临床样本中,N2型比例与乳腺癌患者肺转移率正相关(HR=2.5,P=0.001),可作为促转移预后 Biomarker。
- 代谢 Biomarker:Veglia等2019年研究发现,乳腺癌患者肿瘤组织中FATP2阳性TANs比例为55%(n=20,P<0.01),与患者生存期缩短相关;抑制FATP2可降低TANs的FAO活性,恢复T细胞增殖能力(增殖率从18%提升至45%,n=3,P<0.05),提示FATP2可作为靶向TANs代谢的治疗 Biomarker。
创新性与临床价值
本文首次系统整合了中性粒细胞的“功能作用”与“代谢适应”,明确了N2型TANs通过代谢重编程(如FAO)维持免疫抑制的机制。其中,FATP2作为TANs代谢的关键调控因子,为开发“靶向代谢+免疫治疗”的联合策略提供了新靶点——如FATP2抑制剂可与抗PD-1抗体协同,增强T细胞抗肿瘤活性。
图片说明
- 肿瘤来源因子招募中性粒细胞机制:
- 中性粒细胞极化与功能:
- 中性粒细胞代谢变化: