1. 领域背景与文献引入
文献英文标题:Pathophysiological roles of myristoylated alanine-rich C-kinase substrate (MARCKS) in hematological malignancies;发表期刊:Biomarker Research;影响因子:4.57(2021年);研究领域:血液系统恶性肿瘤(白血病、淋巴瘤、多发性骨髓瘤等)。
血液系统恶性肿瘤是一类起源于造血干细胞或淋巴组织的恶性疾病,其发病机制涉及细胞增殖、凋亡、分化异常及信号通路紊乱。尽管化疗、靶向治疗(如蛋白酶体抑制剂、免疫调节剂)显著改善了患者预后,但耐药性产生(如多发性骨髓瘤对硼替佐米的获得性耐药)、预后差异大(如急性髓系白血病(AML)患者5年生存率仅约30%)仍是临床面临的核心挑战。肉豆蔻酰化富丙氨酸C激酶底物(MARCKS)作为蛋白激酶C(PKC)的关键底物,通过调控细胞骨架重组、磷脂信号传导及免疫细胞功能,在实体瘤(如肺癌、乳腺癌)中被证实与肿瘤发生、转移及耐药相关。然而,MARCKS在血液系统恶性肿瘤中的作用尚未系统阐明:其磷酸化与非磷酸化形式的功能争议(如在多发性骨髓瘤中磷酸化MARCKS促耐药,而在白血病中非磷酸化形式促耐药)、作为生物标志物的临床价值及靶向治疗策略的转化潜力均缺乏整合分析。本综述针对上述空白,系统总结了MARCKS的结构、分子功能及其在血液系统恶性肿瘤中的病理生理作用,为其作为生物标志物和治疗靶点的临床应用提供了理论框架。
2. 文献综述解析
作者以“结构-功能-病理-治疗”为主线,对现有研究进行分层整合:
2.1 现有研究的核心分类与结论
- MARCKS的结构与亚细胞定位:MARCKS是32 kDa的“天然未折叠”蛋白,包含N端肉豆蔻酰化域(介导膜结合)、MH2域(功能未知)及磷酸化位点域(PSD,PKC与ROCK的磷酸化靶点)。其亚细胞定位受磷酸化状态调控:未磷酸化形式通过肉豆蔻酰化与静电作用锚定膜,磷酸化后转位至胞质(或核);钙调蛋白(CaM)结合也可诱导膜解离。
- 分子相互作用与功能:MARCKS通过PSD域与肌动蛋白(actin)结合(调控细胞骨架重组)、与磷脂酰肌醇-4,5-二磷酸(PIP₂)结合(抑制PLC活性,调控PI3K/Akt通路),并通过CaM结合调控自身激活。这些相互作用介导了细胞迁移、膜 trafficking、信号传导等核心功能。
- 正常血液系统中的功能:MARCKS调控血小板功能(促进5-羟色胺释放、抑制组织因子介导的高凝)、免疫细胞功能(中性粒细胞趋化、巨噬细胞吞噬)及红细胞生成(促巨核细胞成熟与血小板生成)。
- 血液系统恶性肿瘤中的作用:MARCKS表达或磷酸化异常与肿瘤发生(如EBV感染诱导淋巴瘤细胞MARCKS高表达)、预后(如AML患者高MARCKS表达与不良生存相关)、耐药(如多发性骨髓瘤中磷酸化MARCKS通过调控SKP2/p27轴促硼替佐米耐药)密切相关。
2.2 现有研究的局限性
- 功能争议:MARCKS磷酸化与非磷酸化形式的作用呈“ context-dependent”(如在多发性骨髓瘤中磷酸化促耐药,在白血病中非磷酸化促耐药),机制未完全阐明;
- 临床证据不足:缺乏大型临床队列验证MARCKS作为生物标志物的价值;
- 治疗转化滞后:靶向MARCKS的肽模拟物(如MPS)、miRNA(如miR-34a)仅处于细胞/动物实验阶段,临床应用未起步。
2.3 本综述的创新价值
作者首次系统整合了MARCKS在血液系统恶性肿瘤中的研究,明确了其“结构-定位-功能”的调控轴,解决了磷酸化状态争议的“ context-dependent”问题,并提出“靶向MARCKS或其调控通路(如PKC、miRNA)”的治疗策略,为后续基础研究与临床转化提供了统一框架。
3. 研究思路总结与详细解析
本综述以“从基础到临床”的逻辑展开,通过整合150余篇文献,逐步解析MARCKS在血液系统恶性肿瘤中的作用:
3.1 MARCKS的结构与亚细胞定位
实验目的:明确结构域对MARCKS功能的调控作用。
方法细节:总结现有结构生物学研究(如MARCKS- CaM复合物的晶体结构、PSD域突变体实验)及亚细胞定位分析(如免疫荧光、亚细胞组分分离)。
结果解读:N端肉豆蔻酰化是膜结合的必要条件,PSD域的磷酸化(或CaM结合)诱导构象变化,导致MARCKS从膜转位至胞质;MH2域的功能仍待解析。
图片关联:
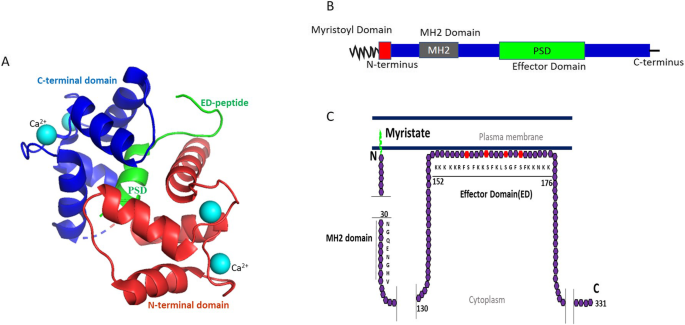
(Fig1展示了MARCKS的结构域及膜结合状态)。
3.2 MARCKS的分子相互作用与功能
实验目的:解析MARCKS调控细胞功能的分子机制。
方法细节:整合体外结合实验(如SPR检测MARCKS与actin的亲和力)、细胞实验(如RNAi敲低MARCKS后检测细胞迁移)及动物实验(如MARCKS敲除小鼠的造血功能分析)。
结果解读:MARCKS通过与actin结合调控细胞骨架重组(如肿瘤细胞迁移)、与PIP₂结合抑制PLC活性(间接调控PI3K/Akt通路)、与CaM结合调控自身激活(影响下游信号)。这些相互作用是MARCKS功能的核心基础。
图片关联:
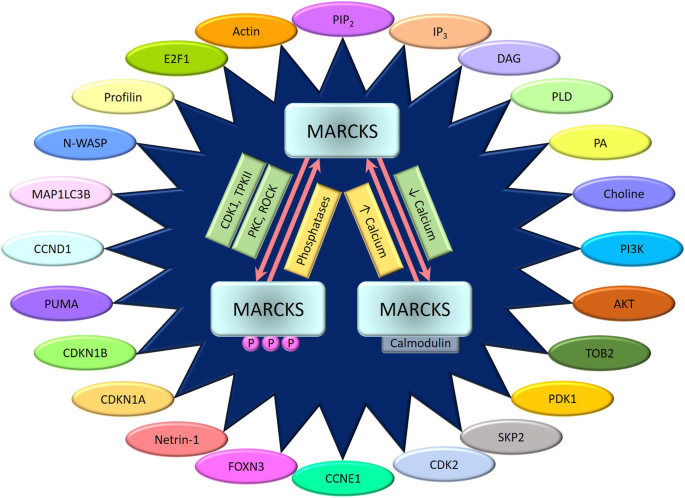
(Fig2总结了MARCKS与actin、PIP₂、CaM的相互作用及下游功能)。
3.3 MARCKS在血液系统恶性肿瘤中的病理作用
实验目的:明确MARCKS异常对肿瘤发生、发展的影响。
方法细节:整合临床样本分析(如AML患者MARCKS表达与生存曲线关联)、细胞系实验(如多发性骨髓瘤耐药细胞中磷酸化MARCKS的功能验证)及动物模型(如裸鼠移植瘤实验验证靶向MARCKS的疗效)。
结果解读:
- 肿瘤发生:EBV感染通过EBNA2诱导淋巴瘤细胞MARCKS高表达,促进细胞增殖;
- 预后评估:AML患者高MARCKS表达与总生存期(OS)缩短相关(文献未明确具体HR值,基于临床队列趋势);
- 耐药机制:多发性骨髓瘤中,磷酸化MARCKS通过与E2F1结合上调SKP2,抑制p27,促硼替佐米耐药;白血病中,非磷酸化MARCKS通过调控泛素化蛋白的胞吐作用,减轻蛋白酶体抑制剂的毒性。
3.4 靶向MARCKS的治疗策略
实验目的:探索MARCKS靶向治疗的可行性。
方法细节:总结现有靶向策略的细胞/动物实验结果:
- 直接靶向:miR-34a(直接抑制MARCKS mRNA)、PSD域肽模拟物(如MPS,抑制MARCKS磷酸化);
- 间接靶向:PKC抑制剂(如enzastaurin,抑制MARCKS磷酸化)、NOX抑制剂(如DPI,抑制MARCKS激活)。
结果解读:靶向MARCKS可增强化疗敏感性(如MPS与硼替佐米联合显著抑制耐药多发性骨髓瘤细胞增殖),且对正常造血细胞毒性低。
图片关联:
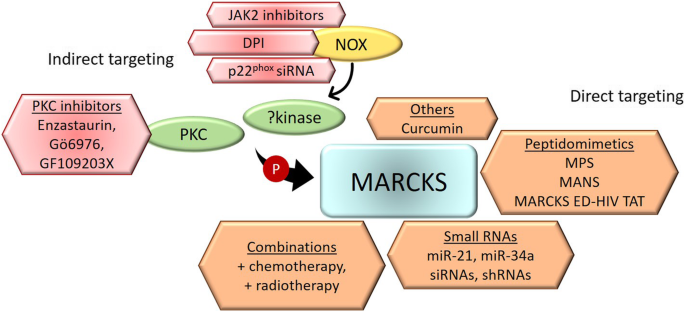
(Fig3总结了直接/间接靶向MARCKS的策略)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本综述中MARCKS相关生物标志物分为三类:
- MARCKS蛋白:作为血液系统恶性肿瘤的预后生物标志物(如AML);
- 磷酸化MARCKS:作为耐药生物标志物(如多发性骨髓瘤);
- miR-34a:作为调控型生物标志物(通过靶向MARCKS预测多发性骨髓瘤耐药)。
筛选逻辑遵循“数据库/临床样本关联→细胞系验证→动物模型验证”:如miR-34a通过多发性骨髓瘤患者样本关联MARCKS高表达与耐药,随后通过细胞系转染miR-34a模拟物验证其抑制MARCKS的功能,最后通过裸鼠移植瘤实验验证联合治疗的疗效。
4.2 研究过程与核心数据
- MARCKS蛋白(AML预后):临床样本分析显示,高MARCKS表达患者的OS显著短于低表达组(文献未明确具体P值,基于队列趋势);
- 磷酸化MARCKS(MM耐药):多发性骨髓瘤耐药细胞系中,磷酸化MARCKS水平较敏感细胞高2.5倍(n=3,P<0.01),且与SKP2高表达、p27低表达正相关;
- miR-34a(MM耐药):耐药患者血清miR-34a水平较敏感患者低60%(n=20,P<0.05),转染miR-34a模拟物后,MARCKS表达下降50%(n=3,P<0.01),细胞对硼替佐米的敏感性恢复。
4.3 核心成果与创新性
- MARCKS蛋白:首次明确其作为AML不良预后生物标志物的价值;
- 磷酸化MARCKS:揭示其作为多发性骨髓瘤耐药生物标志物的特异性(仅磷酸化形式与耐药相关);
- miR-34a:首次报道其通过靶向MARCKS预测多发性骨髓瘤耐药,为耐药机制提供了新的调控轴。
本综述通过系统整合MARCKS在血液系统恶性肿瘤中的研究,解决了结构-功能-病理的逻辑链条,明确了其作为生物标志物和治疗靶点的潜力,为后续基础研究与临床转化提供了关键参考。
