1. 领域背景与文献引入
文献英文标题:First third-generation CAR T cell application targeting CD19 for the treatment of systemic IgM AL amyloidosis with underlying marginal zone lymphoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤与淀粉样变性交叉领域(CAR-T细胞治疗合并惰性B细胞淋巴瘤的系统性IgM型轻链淀粉样变性)。
系统性轻链淀粉样变性(AL)是一种罕见的蛋白沉积性疾病,由克隆性浆细胞或B细胞产生的错误折叠游离轻链(FLC)广泛沉积于器官(如肾、心)引起,可导致多器官功能衰竭,目前仍无法治愈。部分患者合并免疫球蛋白M(IgM)型gammopathy及惰性B细胞淋巴瘤(如边缘区淋巴瘤,MZL),其FLC不仅来自浆细胞,还可能由分泌型B细胞克隆产生,治疗难度更大——现有化疗方案(如苯达莫司汀/利妥昔单抗、自体干细胞移植)疗效有限,易复发。近年来,嵌合抗原受体T细胞(CAR-T)疗法已成为血液系统恶性肿瘤的重要治疗手段,但在AL淀粉样变性中的应用仍处于探索阶段:现有两项单中心研究均针对浆细胞表达的B细胞成熟抗原(BCMA)设计CAR-T,用于治疗浆细胞来源的AL淀粉样变性,而针对CD19阳性的分泌型B细胞淋巴瘤合并AL淀粉样变性的CAR-T治疗尚未见报道。因此,探索CD19靶向CAR-T对这类患者的疗效与安全性,成为该领域的关键空白。本文首次报道1例合并MZL的系统性IgM型AL淀粉样变性患者接受第三代CD19靶向CAR-T治疗的病例,旨在填补这一空白,为复杂病例的治疗提供新策略。
2. 文献综述解析
作者在综述中对现有研究进行了两类梳理:一是AL淀粉样变性的治疗现状,强调合并IgM型gammopathy及惰性B细胞淋巴瘤的患者因“双克隆来源”(B细胞与浆细胞均分泌FLC),现有化疗方案难以兼顾,复发率高;二是CAR-T疗法在AL淀粉样变性中的应用进展,指出BCMA靶向CAR-T虽能抑制浆细胞克隆,但无法覆盖CD19阳性的B细胞克隆,可能导致残留病灶复发。现有研究的核心局限在于:未针对“CD19阳性分泌型B细胞淋巴瘤+AL淀粉样变性”这一亚型设计CAR-T方案,缺乏CD19靶向CAR-T的疗效数据。本文的创新点在于:首次应用第三代CD19靶向CAR-T细胞治疗该亚型患者,同时靶向B细胞克隆(CD19阳性)与浆细胞克隆(可能受B细胞调控),为这类患者提供了“双靶点覆盖”的治疗选择。
3. 研究思路总结与详细解析
3.1 患者基线特征与治疗史分析
实验目的:明确患者的临床特征、器官受累程度及既往治疗响应,为CAR-T治疗的可行性评估提供依据。
方法细节:收集患者病理诊断(MZL+肾淀粉样变性活检)、器官功能评估(肾脏分期采用Palladini等2014年标准,心脏分期采用Wechalekar等2013年标准)及既往治疗方案(一线苯达莫司汀/利妥昔单抗、二线环磷酰胺/地塞米松+自体干细胞移植、桥接治疗硼替佐米/利妥昔单抗)。
结果解读:患者为71岁男性,MZL(IVa期)确诊2年后出现肾病综合征,肾活检证实为IgM型κ轻链淀粉样变性;肾脏分期II期(eGFR 60-89 mL/min/1.73m²),心脏分期IIIa期(NT-proBNP>1800 ng/L,LVEF 50%)。既往治疗后33个月复发,桥接治疗无效,遂行白细胞分离术制备CAR-T细胞。
产品关联:器官分期采用领域常规标准,实验室检查使用常规生化分析仪(肌酐、eGFR)及免疫比浊法(轻链),文献未提及具体实验产品。
3.2 CAR-T细胞制备与输注
实验目的:完成第三代CD19靶向CAR-T细胞的制备与输注。
方法细节:采用患者外周血单个核细胞(PBMC)通过慢病毒载体转导表达第三代CD19 CAR(包含CD28/4-1BB共刺激结构域);输注前给予淋巴清除化疗(方案未明确);单次输注CAR-T细胞作为三线治疗。
结果解读:CAR-T细胞成功制备,患者完成淋巴清除化疗后接受输注,未出现输注相关不良反应。
产品关联:CAR-T制备采用慢病毒转导技术(领域常规方法),淋巴清除化疗药物未提及具体品牌,文献未提及具体实验产品。
3.3 CAR-T细胞扩增与持久性检测
实验目的:评估CAR-T细胞在体内的扩增动力学及长期存活能力。
方法细节:通过单拷贝基因 duplex定量PCR检测外周血PBMC中CAR-T细胞的拷贝数(每微克DNA中的CAR序列拷贝数),检测时间点包括输注后第7、14、21、43、84天。
结果解读:CAR-T细胞在输注后第7天达到峰值扩增,拷贝数为346414/µg PBMC DNA(n=1);随后逐渐下降,但仍保持高持久性——第43至84天拷贝数仍>20000/µg PBMC DNA(n=1),直接证明CD19靶向CAR-T的体内存活能力。
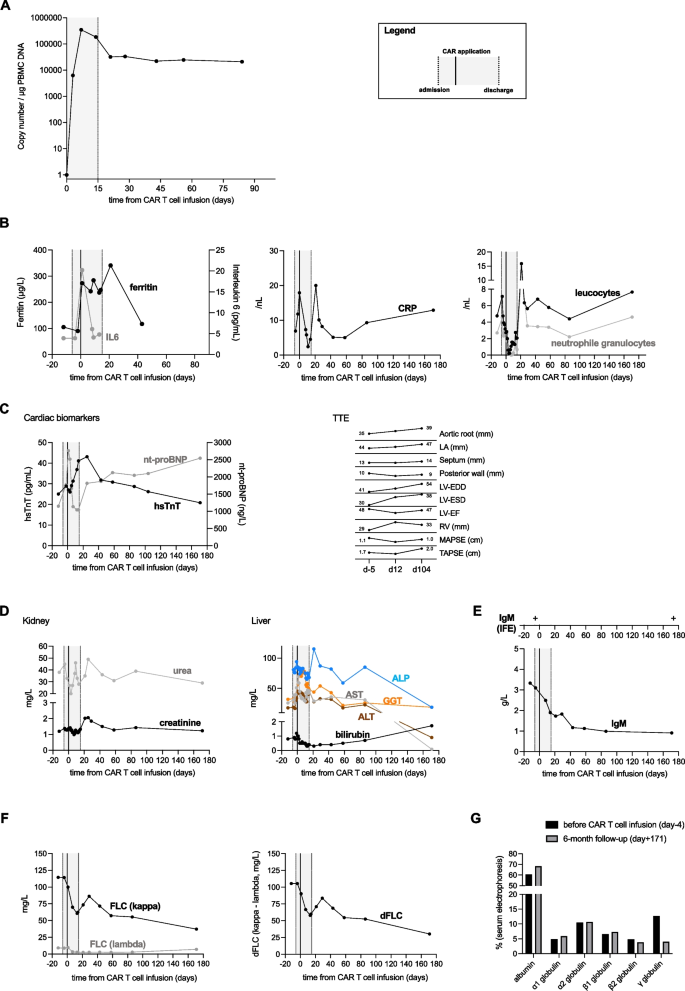
产品关联:定量PCR试剂未提及具体品牌,领域常规使用TaqMan探针法或SYBR Green法试剂盒(如Thermo Fisher Scientific的TaqMan Universal PCR Master Mix)。
3.4 毒性与安全性评估
实验目的:评估CAR-T治疗的特异性毒性及对器官功能的影响。
方法细节:监测免疫效应细胞相关神经毒性综合征(ICANS,ASTCT标准)、发热及感染情况、细胞因子(IL-6、铁蛋白、CRP)、心脏标志物(NT-proBNP、肌钙蛋白)、肾功能(肌酐、eGFR)及心电图变化;给予抗感染预防(抗菌:利福昔明;抗病毒:阿昔洛韦;抗真菌:氟康唑)1个月。
结果解读:CAR-T治疗耐受性良好——仅出现1级ICANS(短暂意识模糊,无需干预);输注后发热( aplasia期)经哌拉西林/他唑巴坦、美罗培南治疗后缓解;细胞因子水平轻度升高(无细胞因子释放综合征,CRS);心脏标志物NT-proBNP在第171天升至2544 ng/L(基线未明确),但心电图无新变化(维持原有房颤);肾功能保持稳定,未出现急性肾损伤。

产品关联:细胞因子检测使用ELISA或化学发光法(如R&D Systems的IL-6试剂盒),心脏标志物使用电化学发光法(如Roche的NT-proBNP试剂盒),抗感染药物为常规临床用药。
3.5 疗效评估:血液学反应与器官功能
实验目的:评估CAR-T对克隆负荷(IgM、FLC)及器官功能的影响。
方法细节:检测血清IgM、游离κ轻链(FLC-κ)、κ/λ轻链比值(FLC-κ/λ)、血清蛋白电泳及免疫固定电泳;采用Palladini等2012年标准评估血液学反应;监测肾脏(eGFR)及心脏(LVEF、LV-EDD/LV-ESD)功能。
结果解读:输注后第30天起,患者IgM、FLC-κ及FLC-κ/λ比值持续下降——6个月时达到非常好的部分缓解(VGPR),表现为FLC-κ下降>50%,IgM降至诊断以来最低水平,血清蛋白电泳γ球蛋白 fraction从12.7%降至4%,无M带;免疫固定电泳仍阳性(IgM κ),提示残留微小克隆。器官功能方面,6个月时肾功(eGFR)稳定,心脏功能(LVEF、LV-EDD/LV-ESD)无改善,但未恶化。

产品关联:轻链检测使用免疫比浊法(如Beckman Coulter的Immage分析仪),血清蛋白电泳使用毛细管电泳系统(如Sebia的Capillarys),心脏超声使用常规超声仪(如Philips的EPIQ 7C)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究的Biomarker分为四类:①靶点Biomarker(CD19):依据MZL克隆表达CD19选择,用于引导CAR-T设计;②CAR-T功能Biomarker(CAR-T拷贝数):反映CAR-T扩增与持久性;③克隆负荷Biomarker(IgM、FLC-κ、FLC-κ/λ):评估对分泌型克隆的抑制作用;④器官功能Biomarker(NT-proBNP、eGFR):监测治疗的安全性。筛选逻辑为“靶点选择→CAR-T存活→克隆抑制→器官保护”的闭环,覆盖治疗的全流程。
4.2 研究过程详述
- CD19验证:通过病理活检确认MZL克隆表达CD19(推测为免疫组化,文献未明确);
- CAR-T拷贝数:定量PCR检测(方法同3.3);
- 克隆负荷:免疫比浊法(FLC)、免疫固定电泳(IgM);
- 器官功能:电化学发光法(NT-proBNP)、生化分析(eGFR)。
4.3 核心成果提炼
- CD19靶向的可行性:CAR-T细胞显著扩增(峰值346414拷贝/µg PBMC DNA)并持续存在(>20000拷贝/µg PBMC DNA长达84天),直接证明CD19作为靶点的有效性;
- 血液学疗效:IgM、FLC-κ及FLC-κ/λ持续下降,6个月时达到VGPR(符合Palladini标准),说明CAR-T同时抑制了B细胞克隆(IgM分泌)与浆细胞克隆(FLC分泌);
- 安全性:仅出现1级ICANS及轻度感染,无严重CRS或器官功能恶化,验证了第三代CD19 CAR-T的低毒性;
- 局限性:患者因流感嗜血杆菌败血症在输注后195天死亡,无法评估长期器官反应,但6个月时器官功能无恶化,提示治疗的短期安全性。
统计学结果:因单病例报告,未提供组间比较P值,但各Biomarker的动态变化趋势明确(如CAR-T拷贝数的峰值与持续、轻链的逐步下降)。
本研究首次证实,第三代CD19靶向CAR-T可安全、有效地治疗合并MZL的系统性IgM型AL淀粉样变性,为这类“双克隆来源”的复杂病例提供了新的治疗选择,也为CD19 CAR-T在AL淀粉样变性中的应用奠定了基础。
