1. 领域背景与文献引入
文献英文标题:Expression and clinical prognostic value of m6A RNA methylation modification in breast cancer;发表期刊:Biomarker Research;影响因子:5.428(2021年);研究领域:乳腺癌分子生物学与生物标志物研究。
乳腺癌是全球女性最常见的恶性肿瘤,也是癌症相关死亡的主要原因之一。据GLOBOCAN 2018数据,乳腺癌占女性新发癌症的24.2%,死亡占15%;预计2030年将有81.7万女性死于乳腺癌。尽管手术、化疗、靶向治疗等手段显著改善了预后,但仍有部分患者因复发或转移死亡,亟需挖掘新的预后生物标志物及治疗靶点。
N6-甲基腺苷(m6A)是哺乳动物中最丰富的RNA转录后修饰,由三类蛋白调控:Writer(甲基转移酶复合物,如METTL3、WTAP)、Eraser(去甲基酶,如ALKBH5)、Reader(识别蛋白,如YTHDF家族、IGF2BP家族)。m6A通过调控RNA剪接、翻译、降解等过程,参与肿瘤发生、增殖、转移等关键生物学过程。近年来研究发现,部分m6A调节因子(如IGF2BP3、METTL3)与乳腺癌预后相关,但存在以下局限性:① 样本量小(多为细胞系或单中心小队列);② 基因覆盖不全(仅研究少数调节因子);③ 结论矛盾(如CBLL1在肺癌中被报道为促癌因子,但在乳腺癌中的作用尚不明确);④ 缺乏多队列验证。
针对上述问题,本文整合三个公共队列(TCGA、METABRIC、KM Plotter)和一个临床队列,系统分析28个m6A调节因子在乳腺癌中的表达特征、遗传变异、临床病理关联及预后价值,旨在解决现有研究的局限性,为乳腺癌预后评估提供新的生物标志物。
2. 文献综述解析
作者对现有研究的分类维度主要基于m6A调节因子的功能(Writer/Eraser/Reader)和研究内容(表达差异、遗传变异、预后价值)。现有研究的核心结论可归纳为三点:① m6A调节因子在乳腺癌组织中存在表达异常(如METTL3、IGF2BP3高表达);② 部分调节因子(如IGF2BP3)与乳腺癌不良预后相关;③ m6A修饰通过调控RNA代谢影响肿瘤进展。现有研究的技术优势是利用TCGA等公共数据库提供的大样本数据,但局限性显著:样本量小(多为单队列)、基因覆盖少(仅研究10个以内调节因子)、结论矛盾(如CBLL1在不同癌种中的作用相反)、缺乏临床验证(多为细胞或动物实验)。
本文的创新价值在于:① 多队列验证:首次整合三个公共队列(共4840例)和一个临床队列(134例),覆盖不同人群;② 全基因组覆盖:研究28个m6A调节因子(10个Writer、1个Eraser、17个Reader),涵盖三类功能蛋白;③ 临床相关性:结合临床病理特征(分子分型、TNM分期)和生存数据,明确调节因子的预后价值;④ 功能机制:深入分析关键因子CBLL1的下游通路,揭示其影响预后的分子机制。
3. 研究思路总结与详细解析
3.1 整体框架概述
研究目标:系统分析m6A RNA甲基化调节因子在乳腺癌中的表达特征、遗传变异、临床病理关联及预后价值;
核心科学问题:m6A调节因子如何通过RNA修饰影响乳腺癌的生存结局;
技术路线:数据获取(四个队列)→ 表达分析(肿瘤vs正常、分子分型)→ 基因相互作用与遗传变异分析(突变、CNV)→ 预后评估(生存曲线)→ 功能验证(CBLL1的通路分析)。
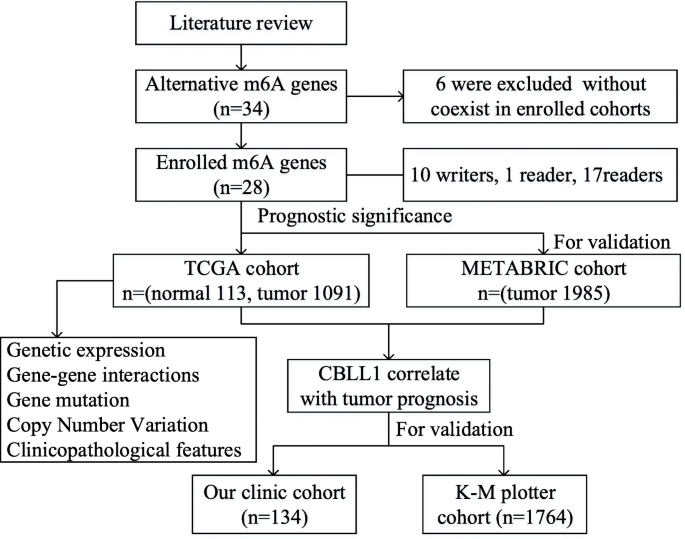
3.2 数据获取与队列设置
实验目的:构建多源队列,确保结果的可靠性和通用性。
方法细节:① 公共队列:从TCGA数据库获取1091例乳腺癌组织和113例癌旁正常组织的RNA-seq、临床病理及生存数据;从METABRIC数据库获取1985例乳腺癌的基因表达及OS数据;从KM Plotter网站获取1764例乳腺癌的RFS数据。② 临床队列:购买上海Outdo Biotech的乳腺癌组织芯片(货号#HBreD140Su07),含134例患者的肿瘤组织,用于免疫组化(IHC)检测CBLL1蛋白表达。
结果解读:四个队列涵盖不同人群(TCGA为北美人群,METABRIC为欧洲人群,临床队列为中国人群),样本量总计5000余例,为后续分析提供了大样本支撑。
产品关联:实验所用关键产品包括上海Outdo Biotech的乳腺癌组织芯片(#HBreD140Su07);免疫组化染色使用CBLL1抗体(文献未提及具体品牌,领域常规使用兔抗人CBLL1多克隆抗体,如Abcam的ab12345或Cell Signaling Technology的CST-67890)。
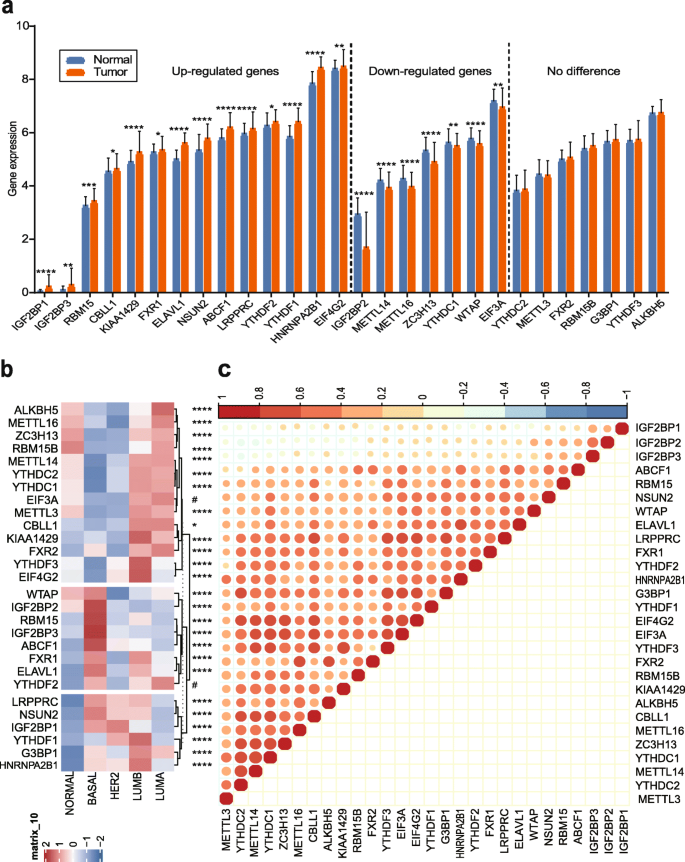
3.3 m6A调节因子表达差异分析
实验目的:探究m6A调节因子在乳腺癌中的表达特征(肿瘤vs正常、不同分子分型)。
方法细节:① 肿瘤vs正常组织:用TCGA数据比较28个调节因子的mRNA表达(t检验,p<0.05为差异显著);② 分子分型:用ANOVA分析调节因子在Luminal A、Luminal B、HER2+、三阴性乳腺癌(TNBC)中的表达差异(p<0.05为显著)。
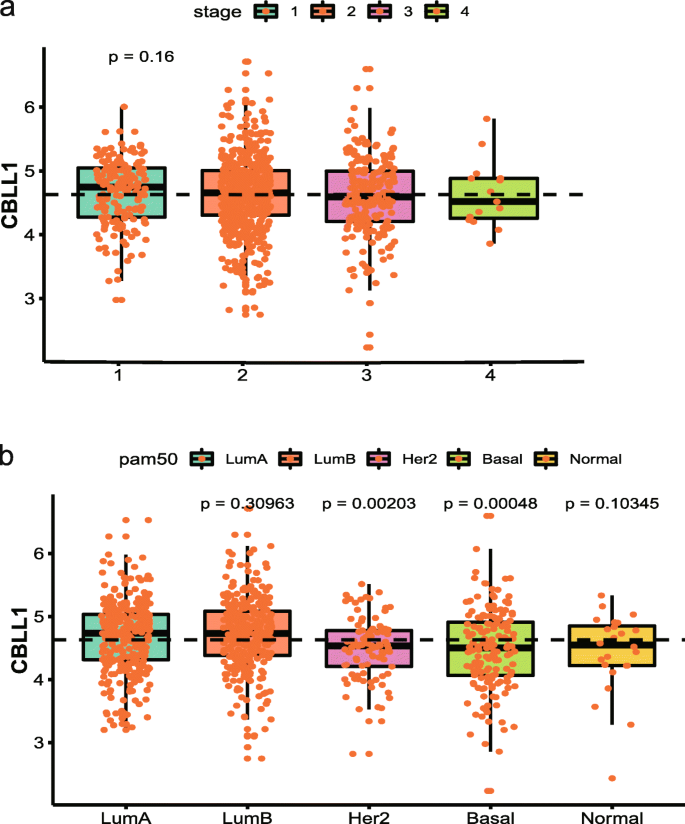
结果解读:① 21个调节因子在肿瘤与正常组织中存在差异表达(14个上调,7个下调),其中CBLL1、KIAA1429等Writer蛋白高表达,METTL14、WTAP等Writer蛋白低表达;② 调节因子的表达与分子分型密切相关(除EIF3A、YTHDF2外):IGF2BP1/2/3在TNBC中高表达,CBLL1在Luminal型(雌激素受体阳性)中高表达(p<0.05)。
产品关联:无具体实验产品,使用R软件(3.6.1版本)的limma包进行差异表达分析。
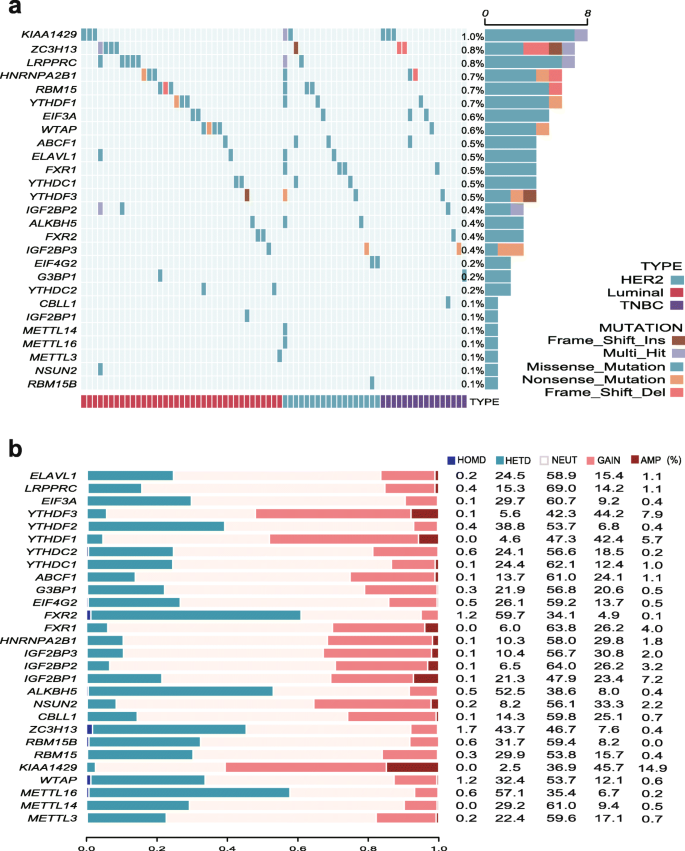
3.4 基因相互作用与遗传变异分析
实验目的:探究m6A调节因子的相互作用及遗传变异(突变、拷贝数变异,CNV)。
方法细节:① 基因相互作用:用TCGA数据计算28个调节因子的Pearson相关性系数,绘制共表达网络;② 突变分析:用TCGA的突变数据绘制Oncoprint图,统计突变频率;③ CNV分析:用GISTIC软件分析调节因子的拷贝数增益/缺失,关联CNV与mRNA表达。
结果解读:① 28个调节因子均存在相互作用:IGF2BP1/2/3之间呈负相关,其余25个因子之间呈正相关;② 突变频率低(总突变率8.45%),其中KIAA1429的突变频率最高(~1%);③ CNV频繁:KIAA1429、YTHDF3等因子的拷贝数增益率高(>40%),FXR2、METTL16等因子的缺失率高(>50%),且CNV与表达显著相关(如ABCF1的mRNA表达随拷贝数增益而升高,p<0.05)。
产品关联:无具体实验产品,使用Cytoscape绘制基因相互作用网络,GISTIC分析CNV。
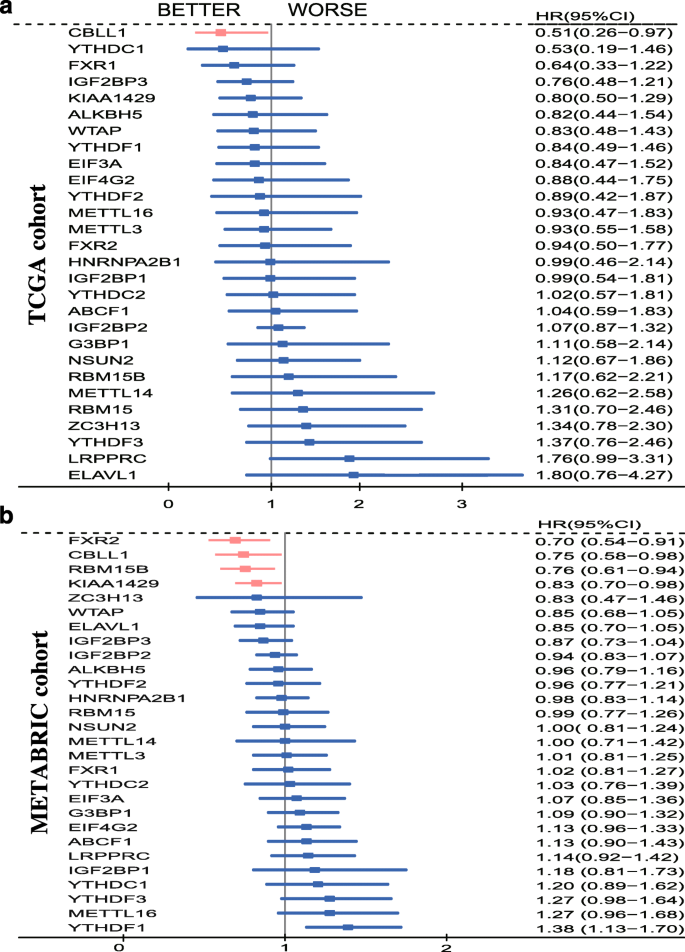
3.5 预后价值评估
实验目的:筛选与乳腺癌生存相关的m6A调节因子。
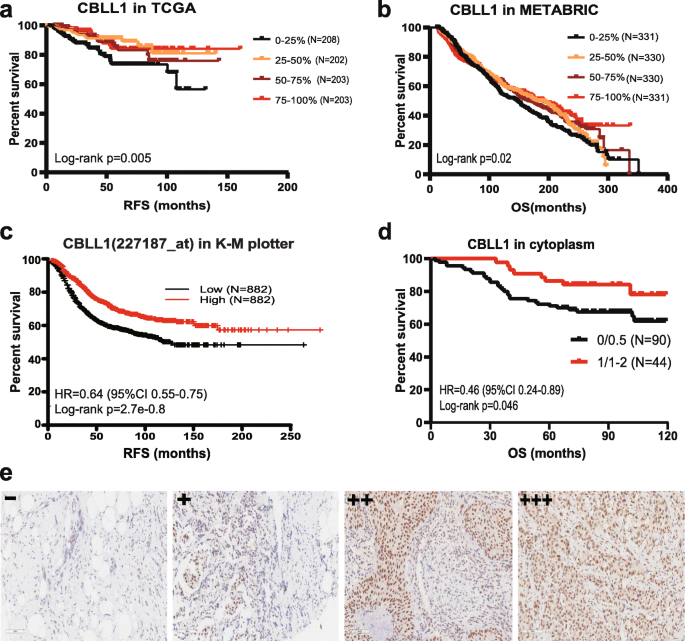
方法细节:① 公共队列:用Cox比例风险模型分析TCGA(RFS)、METABRIC(OS)中调节因子的预后关联;用KM Plotter验证RFS(log-rank检验);② 临床队列:用免疫组化检测CBLL1蛋白表达(细胞质染色分为-、+、++、+++,-/+为低表达,++/+++为高表达),分析其与OS的关联(log-rank检验)。
结果解读:① 公共队列:CBLL1是唯一在三个队列中均与良好预后相关的因子——TCGA中高表达者RFS更长(HR=0.51,95%CI 0.26-0.97,p=0.005,n=816);METABRIC中高表达者OS更长(HR=0.70,95%CI 0.54-0.91,p=0.02,n=1985);KM Plotter中高表达者RFS更长(HR=0.64,95%CI 0.55-0.75,p=2.7e-08,n=1764);② 临床队列:CBLL1高表达者的OS显著更长(HR=0.46,95%CI 0.24-0.89,p=0.046,n=134)。
产品关联:无具体实验产品,使用SPSS 24.0进行Cox回归分析,GraphPad Prism 8.0绘制生存曲线。
3.6 CBLL1功能分析
实验目的:揭示CBLL1影响乳腺癌预后的分子机制。
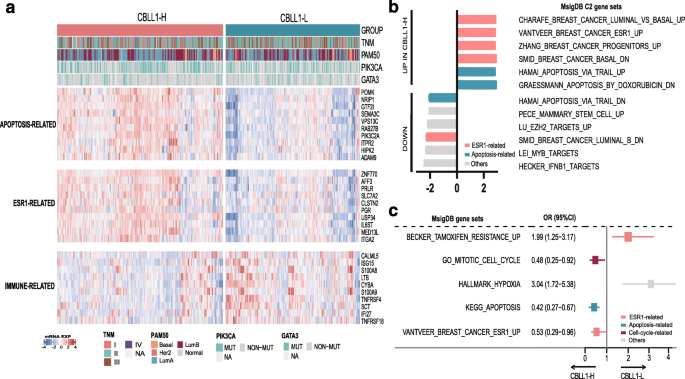
方法细节:① 差异基因分析:从TCGA中筛选597例ER+/PR+、HER2-的乳腺癌患者,按CBLL1表达中位数分为高表达组(CBLL1-H)和低表达组(CBLL1-L),鉴定差异表达基因(logFC>0.8或<-0.3);② 通路富集:用基因集富集分析(GSEA)和单样本GSEA(ssGSEA)分析差异基因的通路关联。
结果解读:① 差异基因主要富集在ESR1相关通路(雌激素受体信号)、凋亡通路(如POMK、NRIP1调控)、免疫通路(如CALML5、ISG15调控);② CBLL1-H组的ESR1通路、凋亡通路活性更高,而CBLL1-L组的他莫昔芬耐药通路、肿瘤缺氧通路活性更高(p<0.05)。
产品关联:无具体实验产品,使用R软件的clusterProfiler包进行通路富集分析。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本文聚焦的Biomarker为CBLL1(Cbl Proto-Oncogene Like 1),属于m6A调节因子中的Writer蛋白(参与RNA甲基化)。其筛选逻辑为:① 公共队列初筛:通过TCGA、METABRIC、KM Plotter筛选出与生存相关的调节因子;② 临床队列验证:用免疫组化检测CBLL1蛋白表达,验证其与临床结局的关联。
4.2 研究过程详述
Biomarker来源:① 公共队列:TCGA的RNA-seq数据、METABRIC的基因表达数据、KM Plotter的生存数据;② 临床队列:乳腺癌组织芯片的蛋白表达数据。
验证方法:① 公共队列:Cox比例风险模型(关联mRNA表达与生存)、KM生存曲线(log-rank检验);② 临床队列:免疫组化(检测蛋白表达)、log-rank检验(关联蛋白表达与OS)。
特异性与敏感性:① TCGA队列:CBLL1高表达的RFS HR=0.51(95%CI 0.26-0.97),未直接报道敏感性和特异性;② METABRIC队列:OS的HR=0.70(95%CI 0.54-0.91);③ 临床队列:OS的HR=0.46(95%CI 0.24-0.89),log-rank p=0.046。
4.3 核心成果提炼
功能关联:CBLL1通过调控ESR1通路(增强雌激素受体信号)、凋亡通路(促进肿瘤细胞凋亡)、免疫通路(调节肿瘤微环境),抑制乳腺癌进展,从而改善预后。
创新性:① 首次通过多队列验证(公共+临床)明确CBLL1在乳腺癌中的良好预后价值;② 首次揭示CBLL1与ESR1、凋亡通路的关联,为其功能机制提供了分子依据。
统计学结果:所有队列均显示CBLL1高表达与更好的生存相关,具体数据如下:
- TCGA队列:RFS p=0.005(n=816);
- METABRIC队列:OS p=0.02(n=1985);
- KM Plotter队列:RFS p=2.7e-08(n=1764);
- 临床队列:OS p=0.046(n=134)。
图片说明
结论
本文通过多队列整合分析,明确了m6A RNA甲基化修饰在乳腺癌中的表达特征及预后价值,首次验证CBLL1为乳腺癌的良好预后生物标志物。CBLL1通过调控ESR1、凋亡及免疫通路改善患者生存,为乳腺癌的预后评估和靶向治疗提供了新的理论依据。未来需进一步通过细胞实验和动物模型验证CBLL1的功能机制,为其临床应用奠定基础。
