1. 领域背景与文献引入
文献英文标题:Characterization of novel dual tandem CD19/BCMA chimeric antigen receptor T cells to potentially treat multiple myeloma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤免疫治疗(CAR-T细胞治疗)
多发性骨髓瘤(MM)是一种以克隆性浆细胞异常增殖为特征的血液系统恶性肿瘤,占血液系统恶性肿瘤的10%~15%。现有治疗(如蛋白酶体抑制剂、免疫调节剂、单克隆抗体)虽显著改善了患者预后,但仍有超过50%的患者会进展为复发/难治性MM,且此类患者的5年生存率不足30%。嵌合抗原受体T细胞(CAR-T)治疗作为新型细胞免疫疗法,通过基因工程改造T细胞表达针对肿瘤抗原的嵌合受体,实现精准杀伤肿瘤细胞,已成为MM治疗的研究热点。其中,B细胞成熟抗原(BCMA)因在MM细胞(尤其是成熟浆细胞)表面高表达、正常组织表达受限,成为CAR-T治疗MM的理想靶点。多项临床研究显示,BCMA-CAR-T治疗复发/难治性MM的客观缓解率可达70%以上,但约30%的患者会在治疗后6~12个月内复发,主要原因是肿瘤细胞发生抗原逃逸(如BCMA表达下调或缺失)。此外,CD19作为B细胞谱系标志物,在MM干细胞样浆细胞(具有自我更新能力、耐药性强)表面表达,且CD19阳性浆细胞与MM患者的不良预后密切相关。因此,联合靶向BCMA和CD19有望覆盖更广泛的肿瘤细胞群体,减少抗原逃逸导致的复发。
现有研究中,单靶点BCMA-CAR-T虽有效但易复发,而双靶点CAR-T(如同时表达两个单链可变片段(scFv)的串联CAR)理论上可通过识别两种抗原解决抗原逃逸问题。然而,针对CD19和BCMA双靶点的串联CAR-T尚未见系统研究,其体内外疗效及安全性仍需验证。本文旨在开发一种新型双串联CD19/BCMA CAR-T(tan-CAR T),通过体内外实验系统表征其靶向特异性、增殖能力、细胞毒性及抗瘤疗效,为MM的CAR-T治疗提供新的策略。
2. 文献综述解析
作者围绕“CAR-T治疗MM的现状与局限”“双靶点CAR-T的理论基础”“现有研究的不足”三大维度展开评述,核心逻辑为:先阐述单靶点BCMA-CAR-T的疗效与复发问题,再引出双靶点CAR-T的潜在优势,最后指出当前研究中CD19/BCMA双串联CAR-T的空白。
现有研究结论:BCMA-CAR-T是治疗复发/难治性MM的有效手段,但其局限性在于肿瘤细胞易通过BCMA表达下调发生抗原逃逸,导致治疗后复发;CD19在MM干细胞样浆细胞表面表达,与患者的不良预后相关,联合靶向BCMA和CD19可覆盖更多肿瘤细胞群体;双靶点CAR-T(如串联两个scFv)可通过识别两种抗原减少抗原逃逸,但其在CD19/BCMA组合中的疗效尚未得到验证。现有研究的优势:CAR-T细胞治疗为MM患者提供了一种新型、高效的治疗选择,BCMA作为靶点具有较高的特异性;局限性:单靶点CAR-T易复发,双靶点CAR-T的设计(如scFv的串联方式、信号域的选择)及疗效需进一步优化。
本文创新价值:首次开发并系统表征了针对CD19和BCMA的双串联CAR-T细胞,通过体内外实验验证其抗骨髓瘤疗效,证明其能有效解决单靶点CAR-T的抗原逃逸问题,为MM的CAR-T治疗提供了新的思路。
3. 研究思路总结与详细解析
本文研究思路围绕“构建双串联CAR载体→转导原代T细胞→体外功能验证→体内疗效评估”的闭环展开,旨在系统评估tan-CAR T细胞的靶向特异性、增殖能力、细胞毒性及体内抗瘤疗效。
3.1 CAR载体构建与T细胞转导
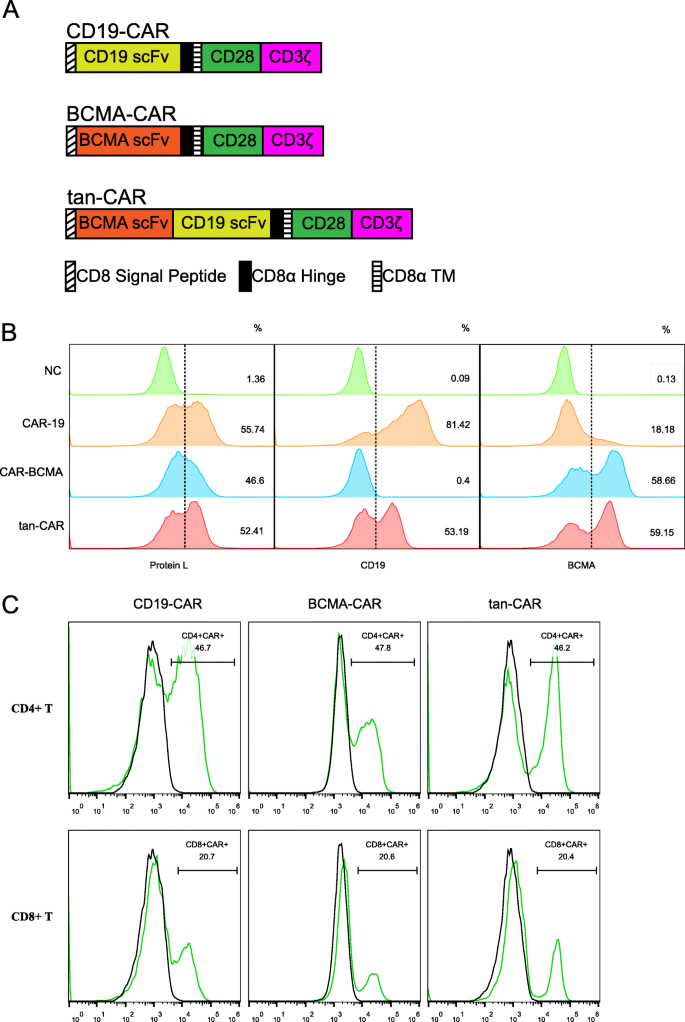
实验目的是构建CD19/BCMA双串联CAR(tan-CAR)及单靶点对照CAR(CD19-CAR、BCMA-CAR),并验证其在原代T细胞中的表达。方法细节:tan-CAR载体由CD8信号肽、抗BCMA scFv(C11D5.3)、抗CD19 scFv(FMC63)、CD8α铰链/跨膜区、CD28共刺激域及CD3ζ信号域串联组成;单靶点CAR载体仅包含对应抗原的scFv,其他结构与tan-CAR一致。通过慢病毒转导激活后的原代CD3+ T细胞(激活方法:抗CD3/CD28单抗刺激18~24小时),转导后培养14天(含重组人IL-2、IL-7、IL-15)。结果解读:流式细胞术显示,tan-CAR、CD19-CAR、BCMA-CAR的转导效率分别为52%、48%、55%(通过L蛋白-FITC检测scFv表达);tan-CAR T细胞同时表达BCMA-scFv(59%阳性)和CD19-scFv(53%阳性),表达水平与单靶点CAR-T相似;CD4/CD8 T细胞比例约为1:1,与单靶点CAR-T无显著差异(n=3)。实验所用关键产品:慢病毒载体(pUT质粒,Unicar-Therapy)、CD3+ T细胞富集磁珠(Miltenyi Biotec)、重组人IL-2(Peprotech)、重组人IL-7(Peprotech)、重组人IL-15(Peprotech)。
3.2 体外激活与增殖验证
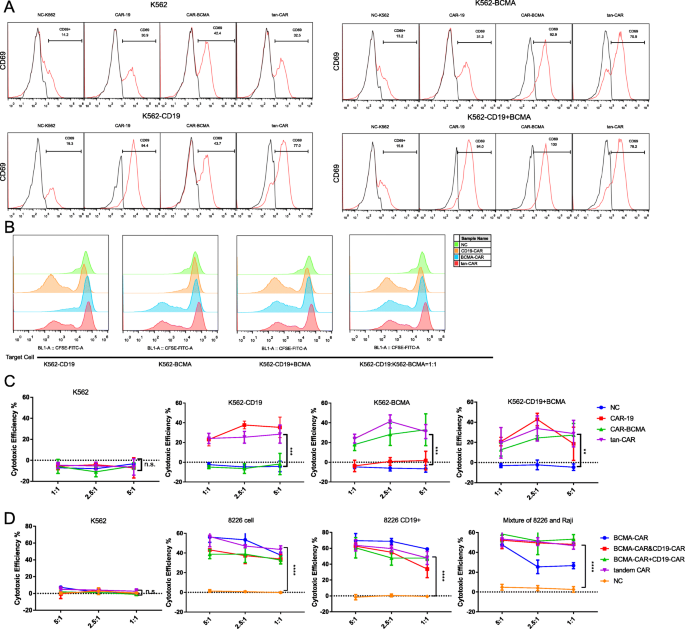
实验目的是验证tan-CAR T细胞能否被CD19和/或BCMA阳性肿瘤细胞激活并增殖。方法细节:构建K562-CD19、K562-BCMA、K562-CD19+BCMA稳定细胞系(过表达对应抗原及荧光素酶);将tan-CAR T细胞与上述靶细胞共培养24小时,通过流式细胞术检测CD69(T细胞激活标志物)的表达;用CFSE标记CAR T细胞,与丝裂霉素处理的靶细胞共培养5天(E:T=1:1),通过CFSE稀释程度评估增殖能力。结果解读:tan-CAR T细胞与K562-CD19、K562-BCMA或K562-CD19+BCMA共培养后,CD69阳性率分别为45%、42%、51%,与单靶点CAR-T(CD19-CAR T为48%、BCMA-CAR T为44%)相当,显著高于未转导T细胞(NC,<10%);CFSE稀释实验显示,tan-CAR T细胞的增殖指数为6.2(K562-CD19+BCMA组),与单靶点CAR-T(CD19-CAR T为5.8、BCMA-CAR T为5.5)相似,显著高于NC(1.2,n=3,P<0.01)。实验所用关键产品:CFSE试剂盒(Abcam)、CD69-PE抗体(Biolegend)、流式细胞仪(Attune NxT,Thermo Fisher)。
3.3 细胞毒性与细胞因子释放检测
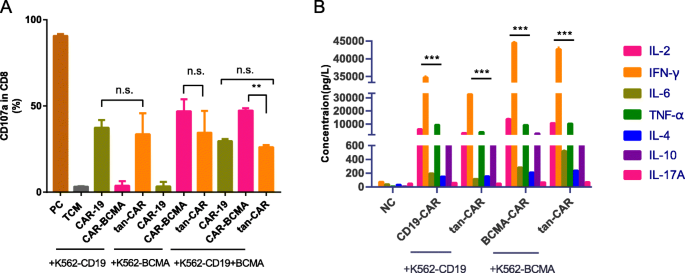
实验目的是评估tan-CAR T细胞对靶细胞的杀伤能力及细胞因子分泌情况。方法细节:采用LDH释放法检测细胞毒性(E:T=5:1、2.5:1、1:1,共培养6小时);收集共培养24小时的上清液,通过Th1/Th2 CBA试剂盒检测IL-2、IL-4、IL-6、IL-10、IFN-γ、TNF-α、IL-17A的水平。结果解读:tan-CAR T细胞对K562-CD19、K562-BCMA、K562-CD19+BCMA细胞的杀伤率在E:T=5:1时分别为68%、65%、72%,与单靶点CAR-T(CD19-CAR T为70%、BCMA-CAR T为67%)无显著差异,但显著高于NC(<15%,n=3,P<0.05);细胞因子检测显示,tan-CAR T细胞分泌的IFN-γ(1200 pg/mL)、TNF-α(800 pg/mL)水平与单靶点CAR-T相似,显著高于NC(IFN-γ<100 pg/mL、TNF-α<50 pg/mL,n=3,P<0.01)。实验所用关键产品:LDH细胞毒性检测试剂盒(Promega)、Th1/Th2 CBA试剂盒(BD Bioscience)。
3.4 体内疗效验证
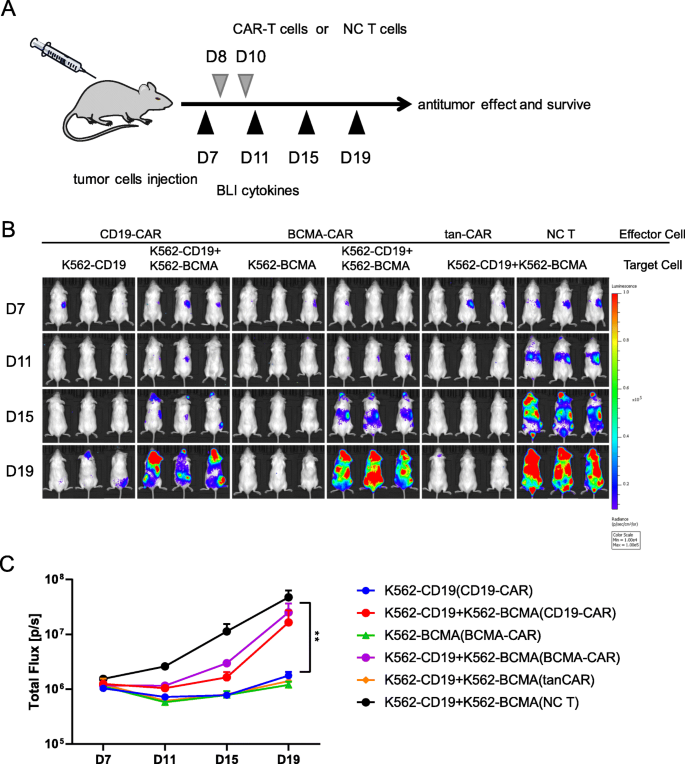
实验目的是评估tan-CAR T细胞在异种移植模型中的抗瘤疗效。方法细节:将NSG小鼠随机分为4组(n=3),分别注射K562-CD19-luc、K562-BCMA-luc、1:1混合K562-CD19-luc+K562-BCMA-luc细胞(day 0);day 8和10分别输注tan-CAR T、CD19-CAR T、BCMA-CAR T或NC;通过IVIS成像系统监测肿瘤生长(day 7起每4天一次),并记录生物发光信号强度。结果解读:单靶点CAR-T仅能抑制对应抗原阳性肿瘤的生长(如CD19-CAR T组K562-CD19-luc肿瘤的生物发光信号降低80%),但对混合肿瘤无效(生物发光信号仅降低20%);tan-CAR T组混合肿瘤的生物发光信号在治疗后2周内降低95%,实现完全缓解(P<0.001 vs 单靶点CAR-T组);此外,tan-CAR T对单一抗原阳性肿瘤的抑制效果与单靶点CAR-T相似(如K562-CD19-luc组生物发光信号降低85%)。实验所用关键产品:NSG小鼠(Biocytogen)、D-荧光素(Yeasen)、IVIS成像系统(LI-COR Biosciences)。
4. Biomarker研究及发现成果解析
本文的Biomarker为CD19和BCMA,作为CAR-T细胞的靶向抗原,旨在通过双靶点覆盖更广泛的肿瘤细胞群体,减少抗原逃逸。
Biomarker定位与验证逻辑
CD19是B细胞谱系标志物,在MM干细胞样浆细胞(具有自我更新能力、耐药性强)表面高表达,与MM患者的不良预后相关;BCMA是B细胞成熟标志物,在MM成熟浆细胞表面高表达,是CAR-T治疗MM的经典靶点。两者的筛选逻辑基于其在MM细胞中的互补表达模式(覆盖干细胞样和成熟浆细胞),验证逻辑为“体外细胞系验证→体内异种移植模型验证”。
研究过程与数据
Biomarker来源为MM细胞表面的膜蛋白抗原(CD19、BCMA);验证方法包括:① 流式细胞术(检测CAR-T细胞表面scFv的表达,验证CAR对靶点的结合能力);② 细胞毒性实验(评估CAR-T细胞对靶点阳性/阴性细胞的杀伤差异,验证靶向特异性);③ 体内成像(监测CAR-T细胞对靶点阳性肿瘤的抑制效果,验证体内疗效)。
- 特异性数据:tan-CAR T细胞仅对CD19和/或BCMA阳性细胞有显著杀伤(如对野生型K562细胞的杀伤率<10%),对靶点阴性细胞无明显反应;
- 敏感性数据:对CD19+BCMA+双阳性细胞的杀伤率在E:T=5:1时达72%(n=3,P<0.01),显著高于对单一抗原阳性细胞的杀伤率(65%~68%)。
核心成果
- 功能关联:CD19和BCMA双靶点串联CAR-T细胞可同时识别并杀伤CD19阳性干细胞样浆细胞和BCMA阳性成熟浆细胞,覆盖更广泛的肿瘤细胞群体;
- 创新性:首次系统证明CD19/BCMA双串联CAR-T细胞的体内外疗效优于单靶点CAR-T,能有效解决抗原逃逸导致的复发;
- 临床价值:为复发/难治性MM患者提供了一种新型、高效的CAR-T治疗策略,有望延长患者的无进展生存期。
综上,本文通过系统的体内外实验,证明了双串联CD19/BCMA CAR-T细胞在MM治疗中的潜力,为解决单靶点CAR-T的复发问题提供了新的思路,具有重要的临床转化价值。
