1. 领域背景与文献引入
文献英文标题:Multicenter phase II clinical trial of nilotinib for patients with imatinib-resistant or -intolerant chronic myeloid leukemia from the East Japan CML study group evaluation of molecular response and the efficacy and safety of nilotinib;发表期刊:Biomarker Research;影响因子:未公开;研究领域:慢性髓系白血病(CML)靶向治疗。
慢性髓系白血病(CML)是由费城染色体(Ph)编码的BCR-ABL1融合基因驱动的造血系统恶性肿瘤,伊马替尼作为第一代酪氨酸激酶抑制剂(TKI)是CML的一线治疗药物,显著改善了患者预后,但约30%的患者会出现原发性或继发性耐药(如BCR-ABL1激酶域突变),或因无法耐受伊马替尼的不良反应(如水肿、恶心)而中断治疗。尼洛替尼是第二代TKI,对BCR-ABL1的抑制活性是伊马替尼的20-50倍,现有研究显示其对伊马替尼耐药或不耐受的CML患者具有较好的疗效,但针对日本人群的分子反应特征、BCR-ABL1突变谱及安全性(尤其是高胆红素血症)的数据仍有限。此外,既往研究多关注UGT1A1多态性与尼洛替尼诱导的高胆红素血症的关系,而UGT1A9多态性的作用尚未在日本CML患者中探讨。因此,本研究旨在评估尼洛替尼对日本伊马替尼耐药/不耐受CML患者的疗效与安全性,分析BCR-ABL1突变及UGT1A9多态性的影响,为日本患者的个体化治疗提供依据。
2. 文献综述解析
作者对现有研究的分类维度主要包括:(1)尼洛替尼的疗效研究:既往多中心临床试验(如Kantarjian等的研究)显示,尼洛替尼对伊马替尼耐药/不耐受的CML慢性期(CP)患者12个月主要分子反应(MMR)率约32%,但日本患者的分子反应数据不足;(2)BCR-ABL1突变对疗效的影响:现有研究表明,某些BCR-ABL1突变(如T315I)导致尼洛替尼耐药,但日本患者的突变谱及动态变化未被系统分析;(3)安全性研究:尼洛替尼常见的不良反应包括高胆红素血症,既往研究发现UGT1A1*28多态性与高胆红素血症相关,但UGT1A9多态性的作用尚未明确。
现有研究的优势是确立了尼洛替尼作为伊马替尼耐药/不耐受CML患者的二线治疗地位,局限性是缺乏日本人群的特异性数据,尤其是BCR-ABL1突变与疗效的关系、UGT1A9多态性与高胆红素血症的关联未被探讨。本研究的创新点在于:(1)聚焦日本CML患者,系统评估尼洛替尼的分子反应及安全性;(2)分析BCR-ABL1突变的动态变化及其对疗效的影响;(3)首次探讨UGT1A9 I399C>T多态性与尼洛替尼诱导的高胆红素血症的关系,为日本患者的个体化治疗提供生物标志物支持。
3. 研究思路总结与详细解析
本研究为多中心、单臂、开放标签II期临床试验,核心目标是评估尼洛替尼对日本伊马替尼耐药/不耐受CML患者的疗效与安全性,核心科学问题包括:(1)尼洛替尼在日本患者中的分子反应率;(2)BCR-ABL1突变对疗效的影响;(3)UGT多态性与高胆红素血症的关系。技术路线为:患者入组→基线特征收集→尼洛替尼治疗→定期评估分子反应(IS-PCR)、BCR-ABL1突变(直接测序)、血药浓度(HPLC)→安全性监测→UGT基因型分析→统计分析。
3.1 患者入组与基线特征
实验目的:筛选符合条件的伊马替尼耐药或不耐受的CML患者,明确基线疾病特征。
方法:多中心招募18岁以上、PS<2、肝肾功能正常的Ph+CML-CP/AP患者,入组标准为伊马替尼耐药(按欧洲白血病网标准定义)或不耐受(因3/4级不良反应或持续2级不良反应无法继续治疗),排除blast phase、QTc>450ms、T315I突变患者。收集患者基线特征(年龄、性别、疾病分期、既往治疗史、细胞遗传学反应、BCR-ABL1突变状态)。
结果:共51例患者筛查,49例入组(33例耐药,16例不耐受),其中45例CML-CP、4例CML-AP;中位年龄62岁,男女比27:22;中位CML病程46.0个月,既往伊马替尼治疗中位时间43.4个月;23例有完全细胞遗传学反应(CCyR),14例有MMR,6例有BCR-ABL1突变(M244V、F317L、N358D、F359V、E459K)。
产品关联:文献未提及具体入组筛选产品,领域常规使用染色体核型分析试剂盒(如Cytocell Ph染色体探针)、BCR-ABL1荧光原位杂交(FISH)试剂盒。
3.2 分子反应评估
实验目的:评估尼洛替尼对伊马替尼耐药/不耐受患者的疗效。
方法:采用国际标准化定量实时PCR(IS-PCR)检测外周血BCR-ABL1转录本水平(MolecularMD One-Step qRT-PCR BCR-ABL kit),每3个月检测一次;MMR定义为BCR-ABL1转录本水平(BCR-ABLIS)0.0032%-0.1%,MR4.5定义为≤0.0032%;排除基线有MMR的患者(14例),分析35例患者的分子反应。
结果:35例患者中,6个月MMR率38.5%,12个月MMR率47.8%;12个月MR4.5率13.0%;BCR-ABLIS<1%和<10%的患者比例分别为74%和87%。基线BCR-ABLIS>0.1-1%的患者12个月MMR率62.5%,显著高于>10%的患者(24.8%,log-rank检验P=0.0372);BCR-ABLIS中位值从基线10.71%降至12个月时的0.14%(图2)。
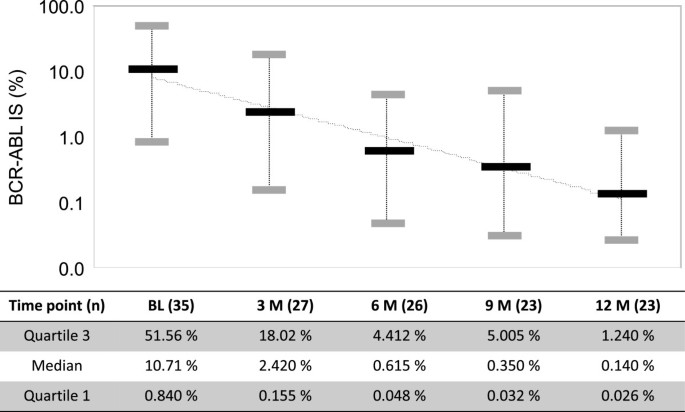
产品关联:实验所用关键产品:MolecularMD One-Step qRT-PCR BCR-ABL kit。
3.3 BCR-ABL1突变分析
实验目的:探讨BCR-ABL1突变对尼洛替尼疗效的影响及动态变化。
方法:基线和治疗12个月时,采用直接测序法分析BCR-ABL1激酶域突变;突变类型包括点突变、插入/缺失。
结果:基线检测到5种突变(M244V、F317L、N358D、F359V、E459K),涉及6例患者;治疗12个月时,3例患者出现新突变(Y253H、I418V、exon8/9 35-bp插入(35INS)),均未达MMR。基线有F317L或F359V+E459K突变的患者疗效差:1例F317L患者疾病进展,1例F359V+E459K患者因3级血小板减少停药;M244V、N358D、E459K突变患者治疗后突变消失,且达MMR。未检测到T315I突变。
产品关联:文献未提及具体突变检测产品,领域常规使用Sanger测序试剂盒(如ABI BigDye Terminator v3.1)。
3.4 尼洛替尼血药浓度检测
实验目的:分析尼洛替尼血药浓度与疗效、安全性的关系。
方法:治疗3个月时,采集空腹静脉血,用高效液相色谱(HPLC)检测尼洛替尼trough浓度(C0);分析浓度与MMR、不良反应(AE)的相关性。
结果:20例持续治疗12个月且无BCR-ABL1突变的患者中,MMR患者的浓度中位数(774.4 ng/mL,25%-75%分位数584.0-1364.0 ng/mL)高于无MMR患者(489.7 ng/mL,317.6-922.5 ng/mL),但无统计学意义(P=0.261)。血药浓度与瘙痒(P=0.0440)、低血钾(P=0.0221)显著相关,与其他AE(如高胆红素血症、QTc延长)无关联。
产品关联:实验所用关键产品:HPLC系统(如Agilent 1260)、尼洛替尼标准品(如Sigma-Aldrich)。
3.5 安全性与UGT基因型分析
实验目的:评估尼洛替尼的安全性,探讨UGT1A1/1A9多态性与高胆红素血症的关系。
方法:记录AE(按NCI-CTCAE v3.0分级),包括 hematologic AE(贫血、中性粒细胞减少、血小板减少)、non-hematologic AE(高胆红素血症、QTc延长、瘙痒);采用PCR-限制性片段长度多态性(PCR-RFLP)分析UGT1A16、27、*28多态性,用直接测序分析UGT1A9 I399C>T多态性;检验基因型与高胆红素血症的相关性。
结果:尼洛替尼耐受性良好,3-4级hematologic AE包括贫血(14.3%)、中性粒细胞减少(28.6%)、血小板减少(18.4%),均通过减量或停药控制;non-hematologic AE中,高胆红素血症最常见(所有等级51.0%,2-4级29%,3-4级4.1%),2例因反复高胆红素血症停药。UGT1A1多态性与高胆红素血症无关联,但UGT1A9 I399C/C基因型患者高胆红素血症风险显著升高(OR=21.2,95%CI 2.2-208.0,P=0.0086);33%的2-4级高胆红素血症患者携带该基因型。
产品关联:实验所用关键产品:PCR-RFLP试剂盒(如ARKRAY i-densy™)、测序试剂盒(如ABI BigDye Terminator v3.1)。
4. Biomarker 研究及发现成果解析
本研究涉及的Biomarker包括BCR-ABL1突变(疗效预测)和UGT1A9 I399C/C基因型(安全性预测),具体分析如下:
4.1 BCR-ABL1突变
Biomarker定位:疗效预测Biomarker,筛选逻辑为“基线突变检测→治疗后突变动态监测→关联疗效”。
研究过程:基线用直接测序检测6例患者的5种突变(M244V、F317L、N358D、F359V、E459K),治疗12个月时用同样方法检测到3种新突变(Y253H、I418V、35INS);验证方法为直接测序,样本量n=49。
核心成果:(1)基线BCR-ABL1突变(如F317L、F359V)与尼洛替尼疗效差相关(F317L患者疾病进展,F359V+E459K患者未达MMR);(2)治疗后新突变(如Y253H、I418V)与无MMR相关(n=3,均未达MMR);(3)M244V、N358D、、 d、MM、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、D、
