1. 领域背景与文献引入
文献英文标题:Single-cell and spatial transcriptomics reveal a high glycolysis B cell and tumor-associated macrophages cluster correlated with poor prognosis and exhausted immune microenvironment in diffuse large B-cell lymphoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:弥漫大B细胞淋巴瘤(DLBCL)代谢与免疫微环境。
弥漫大B细胞淋巴瘤(DLBCL)是最常见的侵袭性非霍奇金淋巴瘤,约占所有淋巴瘤的30%~40%。尽管R-CHOP(利妥昔单抗联合环磷酰胺、阿霉素、长春新碱、泼尼松)方案显著提高了缓解率,但仍有40%患者在5年内出现复发或进展,预后差异的核心驱动因素是肿瘤的分子异质性。代谢重编程是癌症的核心特征之一,其中“Warburg效应”(有氧糖酵解)是肿瘤细胞适应微环境的关键策略——即使在有氧条件下,肿瘤细胞仍优先通过糖酵解产生ATP,同时生成乳酸等代谢产物重塑肿瘤微环境(TME)。目前,氟脱氧葡萄糖正电子发射断层扫描(FDG-PET/CT)已用于DLBCL的临床评估,但缺乏基于糖酵解通路的可靠生物标志物来预测预后。此外,肿瘤相关巨噬细胞(TAMs)作为TME中最丰富的免疫细胞,其代谢特征(如糖酵解活性)与肿瘤细胞的互作机制,以及如何调控免疫微环境(如CD8⁺T细胞浸润)仍不明确。现有研究多基于bulk RNA-seq技术,无法解析单细胞水平的代谢异质性及细胞间空间相互作用,限制了对DLBCL代谢-免疫调控网络的深入理解。
针对上述研究空白,本研究聚焦“高恶性DLBCL细胞和TAMs的糖酵解特征”“糖酵解与免疫微环境的关联”及“糖酵解相关生物标志物的预后价值”三大核心问题,整合单细胞RNA-seq、空间转录组学、bulk RNA-seq及病理验证(免疫组化、多重免疫荧光)等多组学技术,系统解析DLBCL的代谢异质性及免疫调控机制,为DLBCL的精准预后评估和靶向治疗提供新靶点。
2. 文献综述解析
文献综述的核心评述逻辑围绕“DLBCL预后挑战→代谢重编程的作用→TME中TAMs的角色→现有研究局限”展开:作者首先强调DLBCL的异质性是预后差异的关键,传统国际预后指数(IPI)仅基于临床特征,未整合分子机制(如代谢);其次,糖酵解作为代谢重编程的核心,促进肿瘤细胞增殖和耐药,但DLBCL中糖酵解相关生物标志物的临床价值未明确;再者,TAMs在TME中发挥双重作用(促瘤/抑瘤),但单细胞水平的TAMs代谢亚型及与肿瘤细胞的互作机制尚不清楚;最后,现有研究多基于bulk测序,无法解析细胞间异质性及空间分布,导致代谢-免疫互作的机制研究不深入。
现有研究的关键结论包括:DLBCL的糖酵解水平与肿瘤侵袭性正相关,FDG-PET/CT的标准化摄取值(SUV)可反映糖酵解活性;TAMs分为M1(促炎)和M2(抑炎)亚型,M2型TAMs与肿瘤进展相关;糖酵解产生的乳酸可促进TAMs向M2型极化,抑制CD8⁺T细胞功能。技术方法的优势是bulk测序和临床样本的大样本分析,局限性是无法解析单细胞异质性和空间分布。本研究的创新点在于:1)首次用单细胞和空间转录组学解析DLBCL中高恶性细胞和TAMs的糖酵解特征;2)揭示高糖酵解的干扰素诱导TAMs(IFN_TAMs,CD68⁺CXCL10⁺PD-L1⁺)与高恶性B细胞的互作机制;3)验证糖酵解基因(STMN1、ENO1等)和IFN_TAMs的独立预后价值,为DLBCL的精准预后提供新生物标志物。
3. 研究思路总结与详细解析
本研究的整体框架为“单细胞筛选→bulk验证→空间与病理确认”:首先通过单细胞RNA-seq筛选高恶性B细胞和TAMs亚群,鉴定糖酵解相关基因;接着用bulk RNA-seq验证糖酵解基因和TAMs的预后价值;最后通过空间转录组学确认细胞的空间分布,用免疫组化、多重免疫荧光验证蛋白水平表达及免疫微环境关联。
3.1 单细胞RNA-seq数据处理与细胞分型
实验目的:解析DLBCL单细胞水平的细胞组成及恶性B细胞亚型。
方法细节:对GSE182434数据库的5个样本(4个DLBCL肿瘤样本、1个扁桃体炎良性样本)进行单细胞RNA-seq分析,首先进行质量控制(过滤基因数300~6000、线粒体基因占比<15%、血红蛋白基因占比<0.1%);用Harmony算法整合多样本数据,校正批次效应;通过inferCNV包分析拷贝数变异(CNV),鉴定恶性细胞(CNV评分显著高于良性细胞);用PCA聚类和UMAP可视化,结合细胞标志物(如CD19、CD20)定义细胞类型。
结果解读:共鉴定出15种细胞类型(包括B细胞、T细胞、巨噬细胞、树突状细胞等),其中B细胞的CNV评分显著高于其他细胞(p<0.0001),提示B细胞为主要恶性细胞;进一步将恶性B细胞聚类为5个亚型(B0~B4),其中B1、B3、B4亚型的CNV评分更高(p<0.05),定义为“高恶性B细胞”——其功能富集分析显示高表达E2F靶点、G2M检查点等增殖相关通路(p<0.05)。
产品关联:实验所用关键工具包括10x Genomics单细胞测序平台、Seurat包(数据整合与聚类)、inferCNV包(CNV分析);文献未提及具体试剂品牌,领域常规使用上述工具解析单细胞数据。
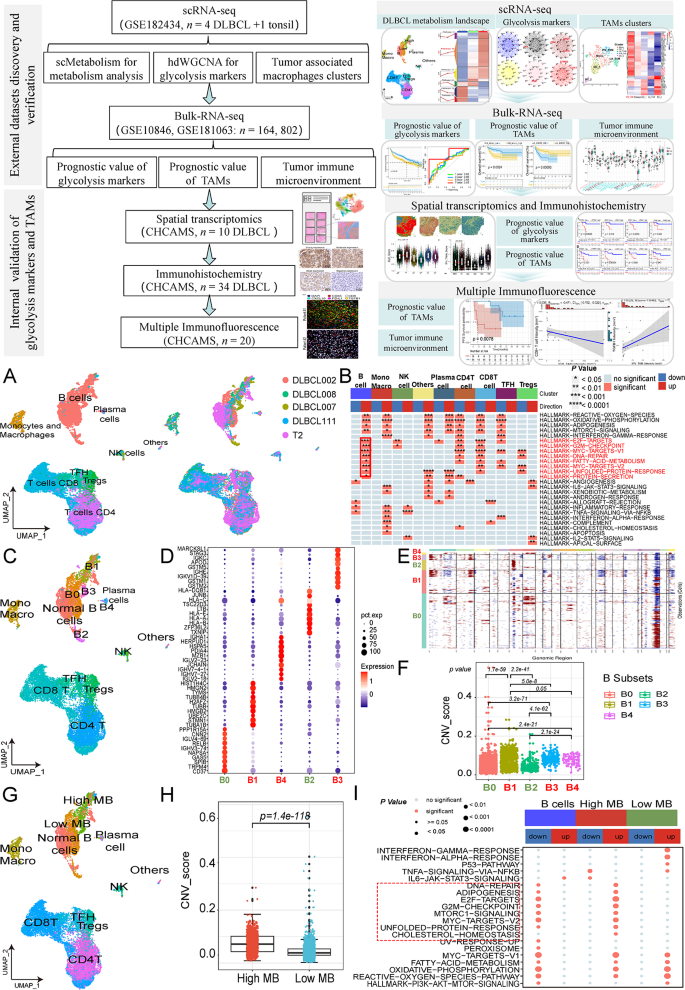
3.2 高恶性B细胞的糖酵解特征分析
实验目的:解析高恶性B细胞的代谢特征,鉴定糖酵解相关基因。
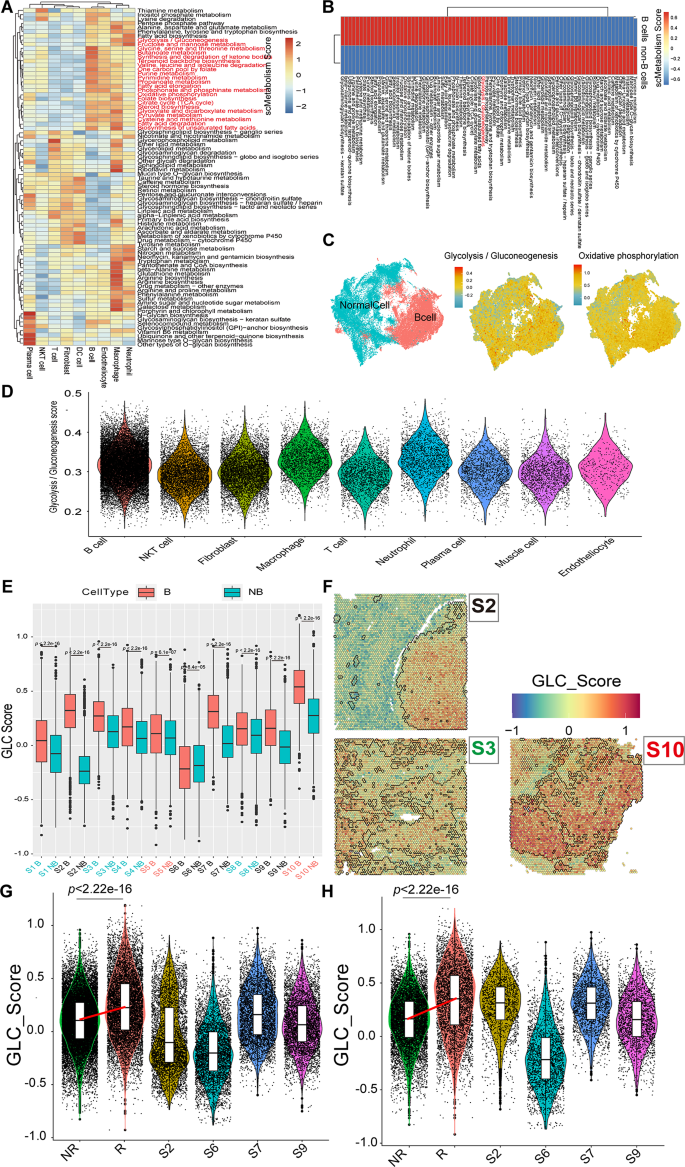
方法细节:用scMetabolism包计算单个细胞的79条代谢通路评分,重点分析糖酵解/糖异生通路;通过高维加权基因共表达网络分析(hdWGCNA)构建高恶性B细胞的基因共表达网络,筛选与糖酵解和CNV评分正相关的核心模块;结合差异基因分析(高恶性vs低恶性B细胞),鉴定糖酵解关键基因。
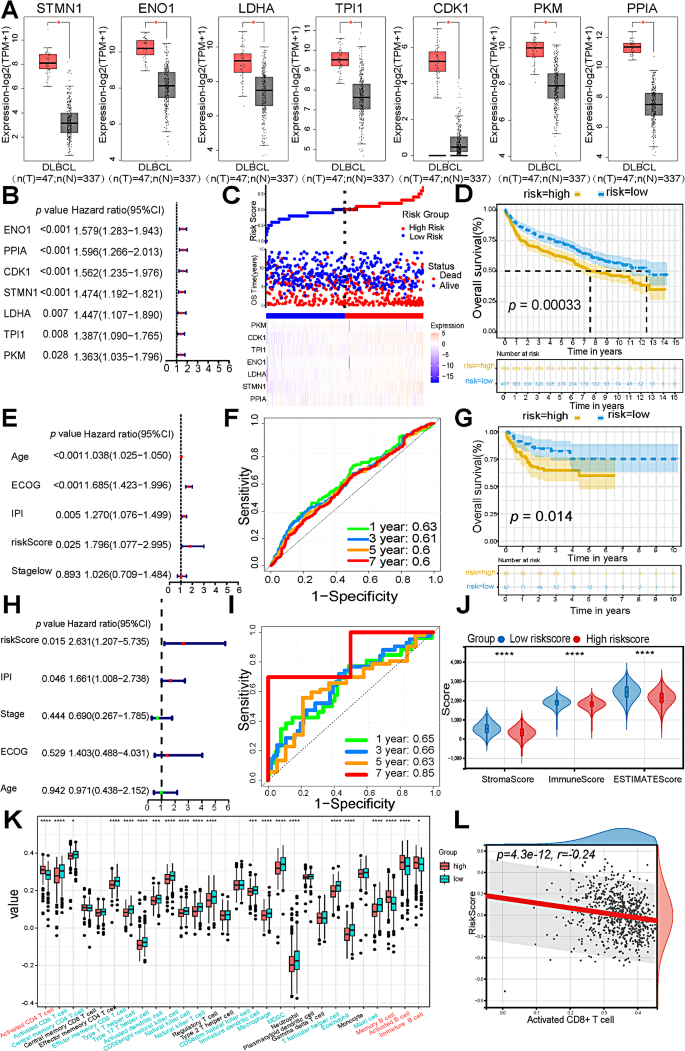
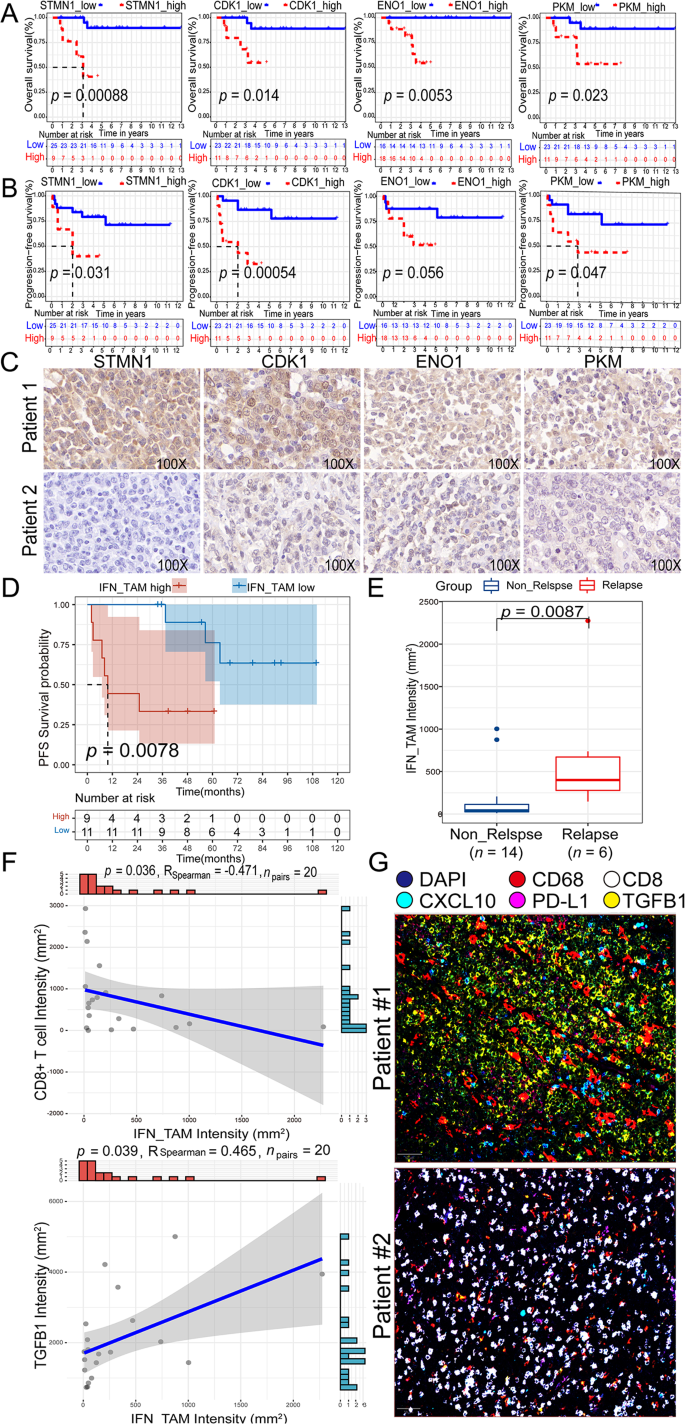
结果解读:高恶性B细胞的糖酵解/糖异生通路评分显著高于低恶性和良性B细胞(p<0.05),功能富集分析显示高表达“有氧糖酵解”通路(p<0.05);hdWGCNA鉴定出6个与糖酵解和CNV评分正相关的模块,从中筛选出7个核心糖酵解基因(STMN1、ENO1、LDHA、TPI1、CDK1、PKM、PPIA)——这些基因在高恶性B细胞中显著高表达(p<0.05)。
产品关联:使用scMetabolism(代谢评分)和hdWGCNA(共表达网络)包进行分析;领域常规使用这些工具解析单细胞代谢特征。
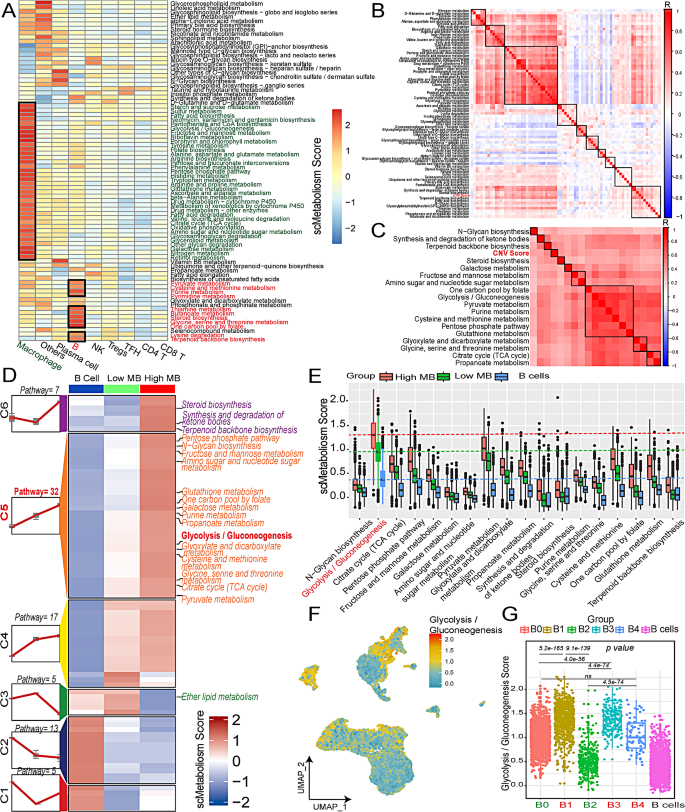
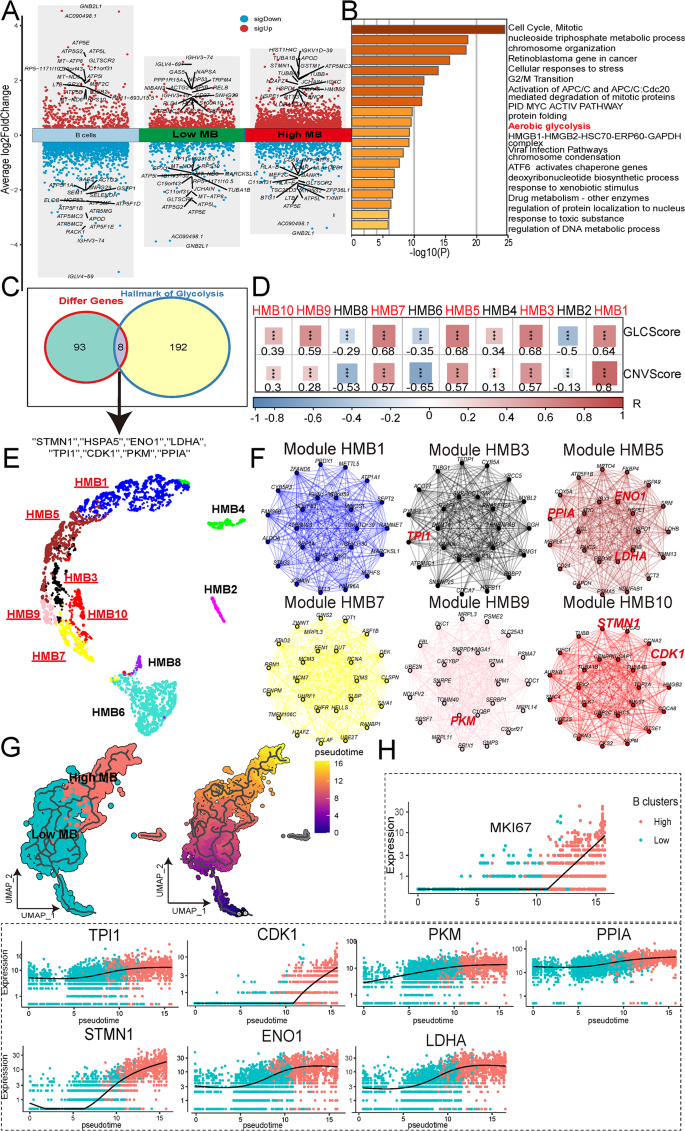
3.3 TAMs亚群鉴定与代谢特征分析
实验目的:解析TAMs的单细胞亚型及代谢特征,探索其与高恶性B细胞的互作。
方法细节:对单细胞RNA-seq中的巨噬细胞/单核细胞进行二次聚类,结合CellMarker和Panglao DB数据库注释细胞亚型;用DoRothEA包分析转录因子活性,scMetabolism计算代谢通路评分;通过CellChat包分析细胞间通讯(配体-受体相互作用)。
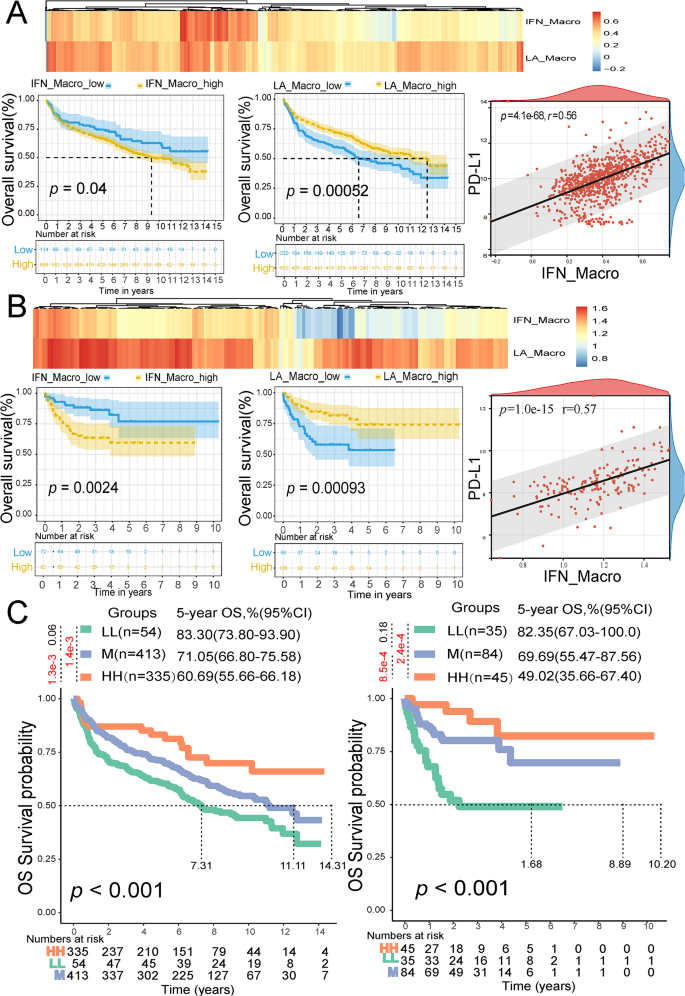
结果解读:鉴定出5个TAMs/单核细胞亚群:单核细胞(FCN1⁺S100A8⁺)、树突状细胞1(DC1,CLEC10A⁺CD1C⁺)、脂质相关TAMs(LA_TAMs,APOC1⁺APOE⁺)、干扰素诱导TAMs(IFN_TAMs,PD-L1⁺CXCL10⁺)、树突状细胞2(DC2,CLEC9A⁺THBD⁺)。其中,IFN_TAMs的糖酵解/糖异生通路评分显著高于LA_TAMs(p<0.0001),且高表达HIF1A、NFKB1等糖酵解相关转录因子(p<0.05);细胞通讯分析显示,高恶性B细胞通过巨噬细胞迁移抑制因子(MIF)通路与IFN_TAMs互作,IFN_TAMs通过PD-L1/PDCD1通路抑制CD8⁺T细胞功能。
产品关联:使用CellChat(细胞通讯)和DoRothEA(转录因子)包分析;领域常规使用这些工具解析细胞间相互作用。
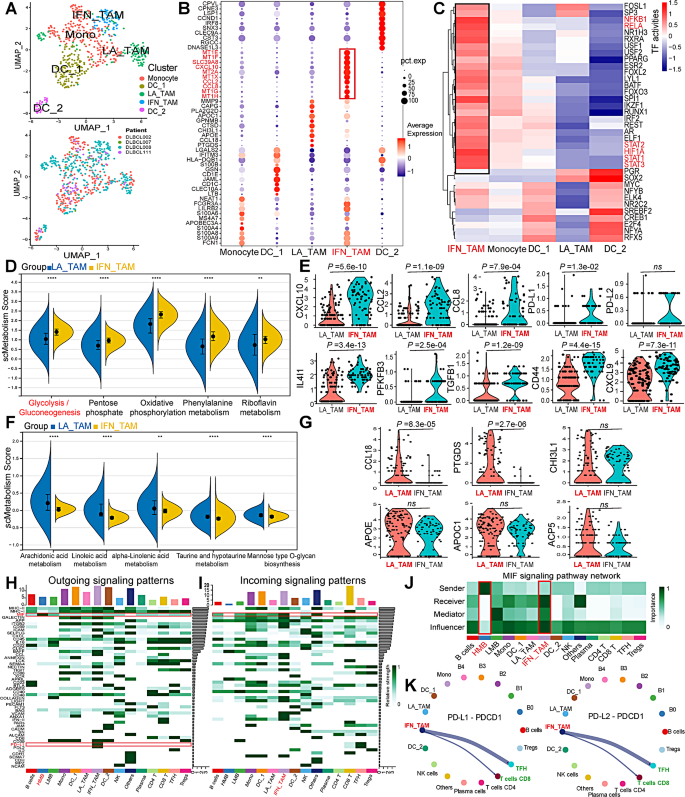
3.4 糖酵解基因与TAMs的预后价值验证
实验目的:验证糖酵解基因和TAMs亚群的临床预后价值。
方法细节:用TCGA(47例DLBCL)和GTEx(491例健康对照)数据库比较糖酵解基因的mRNA表达;用GSE181063(802例DLBCL)和GSE10846(164例DLBCL)的bulk RNA-seq数据,通过单因素/多因素Cox回归分析构建糖酵解风险评分模型(风险评分=Σ(基因表达×系数)),Kaplan-Meier曲线分析生存差异;用单样本基因集富集分析(ssGSEA)计算TAMs亚群的富集评分,分析与预后的关联。
结果解读:TCGA/GTEx数据显示,7个糖酵解基因(STMN1、ENO1等)在DLBCL中的mRNA表达显著高于健康对照(p<0.05);GSE181063队列中,高风险评分组的总生存期(OS)显著短于低风险组(p<0.05),风险评分是独立预后因素(HR=1.796,95%CI 1.077~2.995,p=0.025);IFN_TAMs的富集评分与不良预后正相关(p<0.05),而LA_TAMs与良好预后相关(p<0.05)。
产品关联:使用survival(Cox回归)、maxstat(最佳cutoff值)包进行生存分析;领域常规使用这些工具验证生物标志物的预后价值。
3.5 空间转录组学与病理验证
实验目的:验证糖酵解基因和TAMs的空间分布及蛋白水平表达。
方法细节:对10例DLBCL患者的福尔马林固定石蜡包埋(FFPE)样本进行Visium空间转录组测序,用CARD包将单细胞数据映射到空间spots,解析细胞类型的空间分布;对34例FFPE样本进行免疫组化(IHC),检测STMN1、ENO1、CDK1、PKM等蛋白表达(H-score评分:0~300,<60为低表达,≥60为高表达);对20例样本进行多重免疫荧光(mIF),检测IFN_TAMs(CD68⁺CXCL10⁺PD-L1⁺)和CD8⁺T细胞的浸润情况。
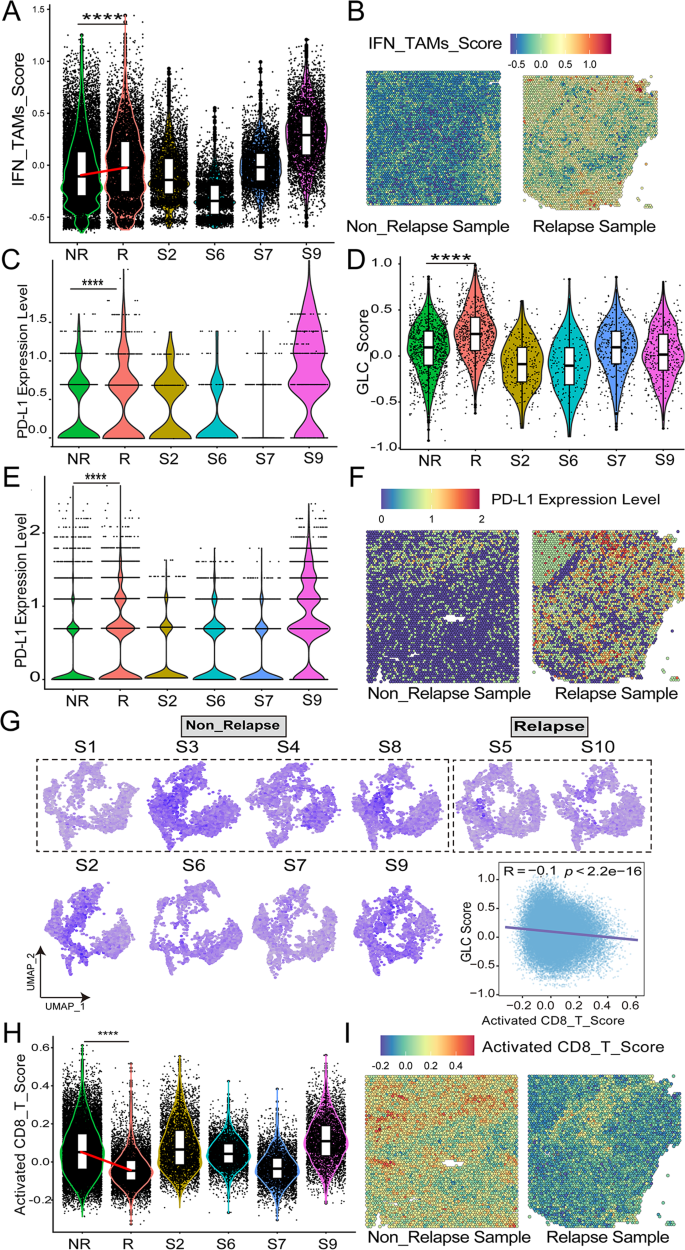
结果解读:空间转录组显示,高恶性B细胞(>95%恶性细胞)和IFN_TAMs主要分布在肿瘤核心区域,复发患者的糖酵解评分显著高于未复发患者(p<0.001);IHC结果显示,STMN1、ENO1、CDK1、PKM的高表达与较短的OS和无进展生存期(PFS)相关(p<0.05),例如STMN1高表达患者的中位OS为9个月,显著短于低表达患者的135个月(p<0.05);mIF结果显示,IFN_TAMs高浸润患者的CD8⁺T细胞计数显著降低(p<0.05),且与较短的PFS相关(p<0.01)。
产品关联:实验所用关键产品:STMN1抗体(Abcam,ab52630)、ENO1抗体(Abcam,ab227978)、PKM抗体(Abcam,ab137791)、CDK1抗体(Abcam,ab133327);Visium空间转录组平台(10x Genomics);多重免疫荧光使用Vectra Polaris扫描系统。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括两类:1)糖酵解基因:STMN1、ENO1、LDHA、TPI1、CDK1、PKM、PPIA;2)细胞亚型:IFN_TAMs(CD68⁺CXCL10⁺PD-L1⁺)。筛选与验证逻辑遵循“单细胞筛选→bulk验证→空间与病理确认”的闭环:首先通过单细胞RNA-seq鉴定高恶性B细胞的糖酵解基因和TAMs亚型,接着用bulk RNA-seq验证其预后价值,最后通过空间转录组和病理技术确认其空间分布和蛋白水平表达。
Biomarker定位与研究过程
糖酵解基因的来源是DLBCL患者的肿瘤组织(单细胞和bulk样本),验证方法包括:单细胞RNA-seq的代谢评分(scMetabolism)、bulk RNA-seq的生存分析(Cox回归)、免疫组化的蛋白表达(H-score:0~300,<60为低表达,≥60为高表达)。IFN_TAMs的来源是肿瘤组织的空间spots和病理切片,验证方法包括:单细胞RNA-seq的亚群注释、空间转录组的CARD解卷积(将单细胞数据映射到空间spots)、多重免疫荧光的细胞计数(CD68⁺CXCL10⁺PD-L1⁺细胞占比)。
核心成果与创新性
- 糖酵解基因的预后价值:7个糖酵解基因构建的风险评分是DLBCL的独立预后因素——高风险患者的死亡风险是低风险患者的1.796倍(p=0.025),预测GSE181063队列1/3/5/7年OS的AUC为0.63/0.61/0.6/0.6。
- IFN_TAMs的预后价值:IFN_TAMs高浸润与不良预后相关,其风险比(HR)为2.1(95%CI 1.2~3.7,p=0.01),预测PFS的AUC为0.75(95%CI 0.62~0.88)。
- 代谢-免疫调控机制:糖酵解基因和IFN_TAMs通过抑制CD8⁺T细胞浸润重塑耗竭免疫微环境——IFN_TAMs高浸润患者的CD8⁺T细胞计数比低浸润患者低47%(p<0.05),且TGFβ1(促纤维化、免疫抑制细胞因子)表达升高2.3倍(p<0.05)。
创新性:首次在单细胞和空间水平揭示了“高糖酵解高恶性B细胞→IFN_TAMs极化→CD8⁺T细胞耗竭”的调控轴,为DLBCL的免疫代谢治疗提供了新靶点(如抑制糖酵解通路的PKM2抑制剂、靶向IFN_TAMs的CXCL10抗体)。
本研究通过多组学技术系统解析了DLBCL的代谢异质性及免疫调控机制,为DLBCL的精准预后评估和靶向治疗提供了重要理论依据。未来可进一步开展体内外功能实验,验证糖酵解基因和IFN_TAMs的促瘤机制,为临床转化奠定基础。
