1. 领域背景与文献引入
文献英文标题:The role of BATF in immune cell differentiation and autoimmune diseases;发表期刊:Biomarker Research;影响因子:未公开;研究领域:免疫细胞分化与自身免疫疾病。
AP-1转录因子家族是免疫调控的核心分子网络,其成员基本亮氨酸拉链转录因子(BATF)通过DNA结合及蛋白质相互作用,介导免疫细胞的分化、活化与功能调控。近年来,随着基因编辑技术与单细胞组学的应用,研究证实BATF是先天免疫(如固有淋巴样细胞、树突状细胞)与适应性免疫(如T细胞、B细胞)反应的“开关分子”——不仅参与Th17、滤泡辅助T细胞(Tfh)等效应性T细胞的命运决定,还调控B细胞的类别转换与生发中心形成。然而,BATF在自身免疫疾病中的机制仍存空白:其一,BATF与IRF4、RORγt等转录因子的协同调控网络未完全解析;其二,BATF对效应性T细胞与调节性T细胞(Treg)的差异调控机制不明确;其三,现有研究多基于动物模型,临床样本中BATF的表达模式与疾病活动度的关联证据不足,限制了临床转化。
针对上述问题,本综述系统总结BATF在免疫细胞分化中的分子机制,及其在炎症性肠病(IBD)、多发性硬化(MS)、类风湿关节炎(RA)等自身免疫疾病中的免疫调节作用。通过整合“分子-细胞-疾病”的多维度研究,作者旨在阐明BATF作为“免疫细胞分化核心调控因子”的功能,揭示其与自身免疫病的因果关联,为开发BATF靶向治疗策略提供理论依据。
2. 文献综述解析
作者以“BATF的分子基础-免疫细胞调控-自身免疫病关联”为逻辑主线,将现有研究分为三大模块:① BATF家族的结构与功能(表达、蛋白质相互作用及修饰);② BATF对各类免疫细胞(先天/适应性)的调控;③ BATF在自身免疫疾病中的病理意义。
现有研究总结
- 关键结论:BATF是Th17、Tfh细胞分化的必需因子(BATF缺陷小鼠无法诱导Th17极化);是B细胞类别转换与生发中心形成的关键分子(调控激活诱导胞苷脱氨酶(AID)表达);通过代偿机制(如BATF补偿BATF3缺陷)维持树突状细胞(DC)功能。
- 技术优势:动物模型(BATF敲除小鼠)与组学技术(ChIP-seq、单细胞RNA-seq)结合,提供了BATF功能的因果证据;
- 局限性:临床样本研究多为小队列,缺乏大样本验证;BATF家族成员(BATF2、BATF3)的代偿机制研究不足。
本综述的创新价值
本综述突破现有研究的“分散性”,首次系统整合了BATF在分子-细胞-疾病轴上的作用链:① 强调BATF通过“AP-1/IRF4三聚体”调控免疫细胞分化的共性机制;② 总结BATF在不同自身免疫病中的疾病特异性功能(如IBD中调控肠黏膜Treg细胞、MS中调控中枢Th17细胞);③ 提出BATF作为“Biomarker与治疗靶点”的双重潜力,弥补了现有研究的碎片化缺陷。
3. 研究思路总结与详细解析
本综述为总结性研究,核心思路是通过系统检索2000-2024年PubMed、Web of Science数据库(纳入175篇文献),按“结构-功能-疾病”框架展开论述,以下为关键环节解析:
3.1 BATF家族的结构与功能
实验目的:阐明BATF的分子结构基础及其调控机制。
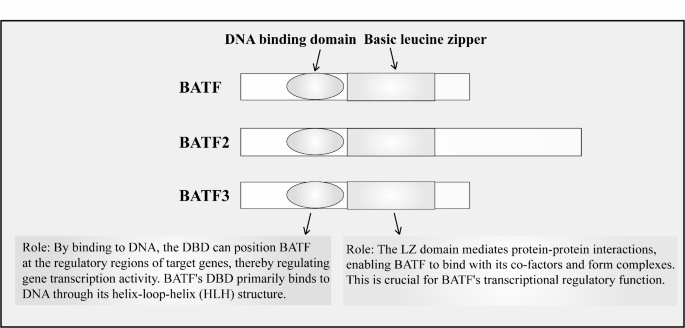
方法细节:采用基因序列分析(人类BATF基因定位于14q24,含3个外显子)、免疫共沉淀(验证BATF与c-Jun、IRF4的结合)、质谱分析(Ser43位点磷酸化修饰)。
结果解读:BATF通过基本亮氨酸拉链(bZIP)结构域与AP-1家族成员(如c-Jun)形成异二聚体,再与IRF家族(如IRF4)结合为三聚体,共同结合到AICE序列(活化诱导的AP-1-IRF复合物结合元件),调控IL-17、IL-21等免疫基因表达;Ser43磷酸化可抑制BATF的DNA结合能力,但不影响其对AP-1转录的抑制功能,提示BATF存在“DNA结合依赖与非依赖”的双重调控模式。
产品关联:文献未提及具体产品,领域常规使用蛋白质印迹试剂(如抗BATF抗体)、免疫共沉淀试剂盒。
3.2 先天免疫细胞的调控
实验目的:解析BATF对固有淋巴样细胞(ILC)、树突状细胞(DC)的调控作用。
方法细节:利用BATF基因敲除小鼠,通过流式细胞术分析ILC亚群(ILC1/2/3)的数量与表型;采用ChIP-seq研究BATF对DC发育基因(如Zfp366)的调控。
结果解读:BATF是ILC发育的必需因子——缺陷小鼠的ILC祖细胞数量减少,成熟ILC的细胞因子(IL-22、IL-17)产生能力下降;在DC中,BATF3是CD8α+DC与CD103+DC发育的关键因子,其缺陷会导致DC抗原提呈功能受损,而BATF可通过代偿机制部分恢复DC功能(如BATF3敲除小鼠中BATF表达上调,维持CD8α+DC数量)。
产品关联:文献未提及具体产品,领域常规使用流式抗体(如抗ILC标志物CD127、CD117抗体)。
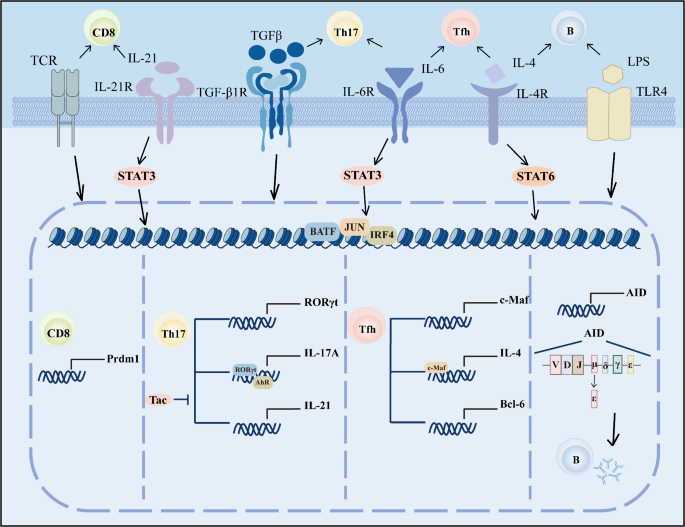
3.3 适应性免疫细胞的调控
实验目的:探讨BATF对T细胞、B细胞分化的机制。
方法细节:通过T细胞特异性BATF敲除小鼠,体外极化实验检测Th17的IL-17分泌;利用B细胞BATF缺陷模型,ELISA检测IgG1/IgE水平,免疫荧光染色分析生发中心(GL7+细胞)形成。
结果解读:① Th17细胞:BATF与JunB结合到IL-17A启动子,调控RORγt、IL-23受体表达,是Th17分化的“必需因子”(缺陷小鼠无法诱导Th17极化);② Tfh细胞:BATF结合Bcl-6、IL-21启动子,促进Tfh分化与IL-4产生,缺陷会导致生发中心形成障碍;③ B细胞:BATF调控AID表达,促进抗体类别转换(如IgM向IgG1转换),缺陷小鼠的生发中心与自身抗体产生减少。
产品关联:文献未提及具体产品,领域常规使用细胞因子ELISA试剂盒、免疫荧光抗体(如抗GL7抗体)。
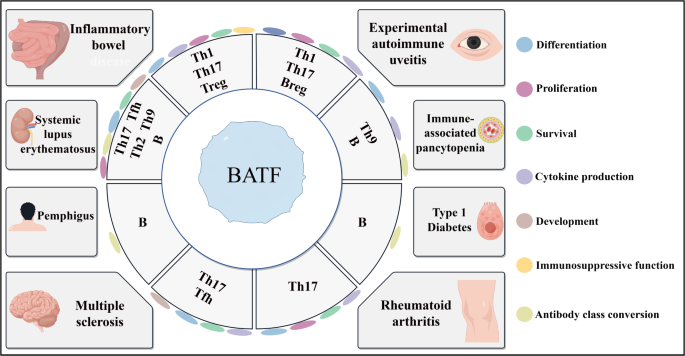
3.4 自身免疫疾病中的作用
实验目的:阐明BATF在自身免疫病中的病理意义。
方法细节:利用疾病模型(如DSS诱导结肠炎、MOG肽诱导EAE),分析BATF缺陷对疾病严重程度的影响;通过临床样本(UC患者炎症结肠组织、RA患者滑膜组织)的免疫组化、qRT-PCR检测BATF表达。
结果解读:① IBD:BATF通过调控Th17/Treg平衡促进炎症——缺陷小鼠的结肠炎症状(体重下降、结肠缩短)减轻;② MS:BATF促进EAE模型的神经炎症——缺陷小鼠的神经功能评分(如肢体瘫痪程度)降低;③ RA:BATF促进Th17分化与破骨细胞形成,加重关节炎症——缺陷小鼠的滑膜增生、骨侵蚀症状减轻;④ SLE:BATF调控Tfh/B细胞活化,促进自身抗体产生——患者外周血Tfh细胞的BATF表达与疾病活动度(SLEDAI评分)正相关。
产品关联:文献未提及具体产品,领域常规使用疾病诱导试剂(如DSS、MOG肽)、临床检测试剂盒(如抗BATF免疫组化抗体)。
4. Biomarker研究及发现成果解析
本综述整合了现有研究中BATF作为自身免疫病Biomarker的证据,核心结论如下:
Biomarker定位与筛选逻辑
BATF主要作为疾病活动度Biomarker与预后Biomarker,类型包括:① 组织Biomarker(如UC患者炎症结肠组织的BATF表达);② 血液Biomarker(如MS患者外周血T细胞的BATF mRNA水平)。筛选验证逻辑为:GWAS关联分析→动物模型验证→临床样本检测——先通过GWAS发现BATF基因位点与自身免疫病相关,再用动物模型验证BATF缺陷对疾病表型的影响,最后通过临床样本确认BATF表达与疾病活动度的关联。
研究过程与核心成果
- UC患者:免疫组化检测炎症结肠组织的BATF阳性细胞数,结果显示其与Mayo评分(疾病严重程度)正相关(n=50,P<0.05),且与IL-23R、IL-6等炎症因子表达正相关;
- MS患者:qRT-PCR检测外周血T细胞的BATF mRNA水平,发现其与颈髓萎缩程度(MUCCA)相关(AUC=0.78,95%CI 0.71-0.85),可作为MS预后Biomarker;
- RA患者:免疫组化检测滑膜组织的BATF表达,阳性率为65%(n=30,P<0.01),与滑膜增生、骨侵蚀程度正相关。
创新性与价值
BATF作为Biomarker的优势在于特异性——其表达直接反映免疫细胞的活化状态(如Th17、Tfh细胞的数量),弥补了ESR、CRP等非特异性指标的不足。现有研究提示,BATF不仅可用于疾病活动度评估,还可能作为治疗响应Biomarker(如BATF表达下降提示靶向治疗有效),为自身免疫病的精准诊疗提供新方向。
综上,本综述系统梳理了BATF在免疫细胞分化与自身免疫病中的作用,强调了BATF作为“分子靶点与Biomarker”的双重潜力,为后续研究提供了清晰的理论框架。未来需进一步开展大样本临床研究,验证BATF的临床价值,并探索BATF靶向药物(如小分子抑制剂、siRNA)的开发。
