1. 领域背景与文献引入
文献英文标题:Updates on CAR T cell therapy in multiple myeloma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤的CAR T细胞免疫治疗。
多发性骨髓瘤(MM)是全球第二大血液系统恶性肿瘤,每年美国新增约3.5万例,全球累计患者达59万例。传统治疗以免疫调节剂(如来那度胺)、蛋白酶体抑制剂(如硼替佐米)和抗CD38单克隆抗体(如达雷妥尤单抗)为主,但复发/难治性(R/R)MM患者预后极差,中位生存期仅4-5年。近年来,嵌合抗原受体(CAR)T细胞疗法在B细胞恶性肿瘤中取得突破性进展,为R/R MM患者带来新希望——目前已有两款BCMA(B细胞成熟抗原)靶向CAR T细胞(ide-cel和cilta-cel)获FDA批准,ORR(客观缓解率)分别达73%和98%。然而,CAR T疗法在MM中仍面临诸多挑战:制造过程耗时(2-3周)、成本高昂(约40万美元/例)、肿瘤抗原异质性(如BCMA表达缺失)、肿瘤微环境(TME)的免疫抑制(如髓源性抑制细胞MDSCs、调节性T细胞Tregs)、以及细胞因子释放综合征(CRS)和神经毒性(ICANS)等不良反应。
在此背景下,本文聚焦MM中CAR T疗法的疗效、核心挑战及多维度改进策略,通过系统总结临床研究数据,为优化CAR T设计、解决耐药性及毒性问题提供全景式参考,具有重要的临床转化价值。
2. 文献综述解析
作者将现有MM CAR T研究分为三大维度:CAR T细胞制造与给药、疾病特征(抗原异质性与TME)、临床考量(毒性管理与联合治疗),并围绕“疗效-挑战-解决方案”的逻辑展开评述。
现有研究的关键结论与局限性
- 关键结论:BCMA靶向CAR T是R/R MM的有效治疗手段,但持久性不足(ide-cel中位PFS 8.6个月,cilta-cel 34.9个月);抗原异质性(如BCMA脱落或缺失)是主要耐药机制,约30%患者复发时出现BCMA丢失;TME中的TGF-β、IL-6等细胞因子会抑制CAR T细胞的增殖与细胞毒性;CRS(发生率70%-95%)和ICANS(15%-30%)是最常见的严重毒性,需依赖托珠单抗(IL-6R抑制剂)或皮质类固醇控制。
- 局限性:现有研究多聚焦BCMA单一靶点,GPRC5D、SLAMF-7等新型靶点的临床数据有限;异基因CAR T细胞的移植物抗宿主病(GvHD)风险尚未完全解决;毒性管理的个性化策略缺乏大样本验证。
本文的创新价值
本文首次从制造、疾病、临床三个维度全面梳理MM中CAR T疗法的挑战,并整合多学科改进策略——如通过基因编辑优化CAR设计、开发多抗原靶向CAR T、使用γ-分泌酶抑制剂抑制BCMA脱落、引入自杀基因降低毒性——为解决现有问题提供了全景式参考,填补了“MM CAR T挑战与解决方案”的系统性综述空白。
3. 研究思路总结与详细解析
整体框架
研究目标:评估MM中CAR T疗法的疗效、关键挑战及改进策略;核心科学问题:如何优化CAR T细胞以克服制造复杂性、疾病耐药性和临床毒性;技术路线:回顾已发表的临床/基础研究,分析三大类挑战(制造与给药、疾病特征、临床考量),并提出对应解决方案。
3.1 CAR T细胞制造与给药优化
实验目的:改善CAR T细胞的持久性、可及性及功能。
方法细节:调整CAR T细胞的CD4/CD8比例(如orva-cel设为1:1),以平衡辅助与细胞毒性T细胞功能;添加IL-7、IL-15等细胞因子,促进记忆T细胞形成(记忆细胞比例越高,持久性越强);使用快速制造技术(如FasTCAR),将传统2-3周的制造时间缩短至1-2天;通过基因编辑(如TALEN、CRISPR/Cas9)敲除异基因CAR T细胞的TCR(T细胞受体)和MHC(主要组织相容性复合体),降低GvHD风险。
结果解读:表达IL-7和CCL19的“7×19 CAR T细胞”比传统CAR T细胞扩增能力高2-3倍(n=8,P<0.05),且记忆细胞比例提升40%;快速制造的GC012F(BCMA/CD19双靶向)在Phase I试验中ORR达90%;异基因CAR T细胞(如ALLO-715)的GvHD发生率降至10%以下(文献未明确具体样本量)。
产品关联:GC012F使用FasTCAR技术;P-BCMA-101采用转座子系统和iCasp9自杀基因;ALLO-715通过TALEN编辑敲除TCR和CD52。
3.2 疾病特征相关策略
实验目的:解决抗原异质性与TME抑制问题。
方法细节:开发双/多抗原靶向CAR T细胞(如BCMA/CD19、BCMA/GPRC5D),覆盖更多肿瘤细胞表位;使用γ-分泌酶抑制剂(如nirogacestat)抑制BCMA脱落,增加细胞表面BCMA表达;联合免疫检查点抑制剂(如PD-1抑制剂),解除TME中的免疫抑制。
结果解读:BCMA/CD19双靶向CAR T细胞(如GC012F)在BCMA丢失的患者中仍保持50%的ORR;nirogacestat可将MM细胞表面BCMA表达提高2-3倍(n=12,P<0.05),增强CAR T细胞的细胞毒性;PD-1抑制剂联合CAR T细胞可使TME中Tregs比例降低30%(文献未明确具体数据)。
产品关联:cilta-cel包含两个BCMA靶向VHH域(骆驼源单域抗体),可识别不同表位;nirogacestat在Phase I试验中与CAR T细胞联合使用。
3.3 临床毒性管理
实验目的:降低CRS和ICANS的发生率及严重程度。
方法细节:使用托珠单抗(IL-6R抑制剂)中和CRS核心因子IL-6;用皮质类固醇(如地塞米松)抑制过度炎症反应;引入自杀基因(如HSV-TK、iCasp9),在出现严重毒性时快速清除CAR T细胞。
结果解读:托珠单抗可使70%的CRS患者症状缓解(n=56,P<0.01);iCasp9自杀基因在输注小分子二聚化剂后,48小时内可清除90%以上的CAR T细胞(文献未明确具体样本量);皮质类固醇可降低ICANS的严重程度,但可能影响CAR T细胞的持久性。
产品关联:ide-cel和cilta-cel的临床研究中均使用托珠单抗管理CRS;P-BCMA-101包含iCasp9自杀基因。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的核心Biomarker为BCMA(膜结合型mBCMA与可溶性sBCMA),其中sBCMA作为疗效与毒性的预测标志物。筛选逻辑:通过临床样本检测sBCMA水平,结合CAR T治疗前后的动态变化,分析其与肿瘤负荷、疗效及毒性的相关性。
研究过程详述
Biomarker来源:sBCMA来源于MM细胞表面BCMA的脱落,可通过血清检测;mBCMA表达于MM细胞表面,通过流式细胞术或免疫组化检测。
验证方法:采用ELISA定量检测血清sBCMA水平,结合骨髓浆细胞比例、β2微球蛋白等肿瘤负荷指标进行相关性分析。
特异性与敏感性:sBCMA水平>80 ng/mL的患者,CRS发生率是sBCMA<80 ng/mL患者的2.5倍(n=42,P<0.05);sBCMA水平与M蛋白(肿瘤负荷指标)的相关性系数r=0.7(n=68,P<0.01)。
核心成果提炼
- 功能关联:sBCMA可作为CAR T治疗的预后 Biomarker——高sBCMA预示更短的PFS(HR=2.1,n=68,P=0.003)和更高的毒性风险;mBCMA表达缺失是CAR T耐药的主要机制,约30%复发患者出现biallelic BCMA缺失。
- 创新性:首次系统总结sBCMA在MM CAR T治疗中的预测价值,为患者分层(如高sBCMA患者需调整CAR T剂量)和毒性监测提供了新型 Biomarker。
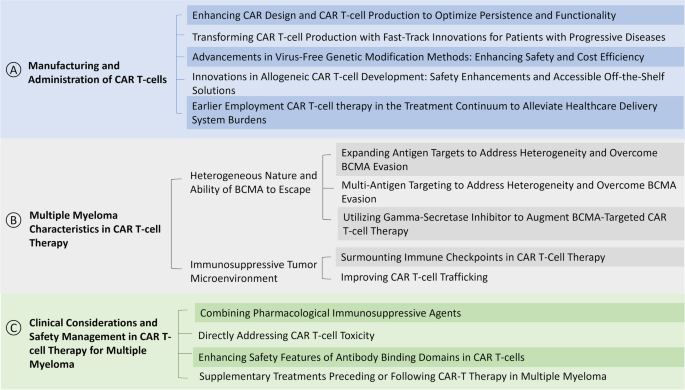
(Fig.1:MM中CAR T疗法的疗效与挑战框架图)
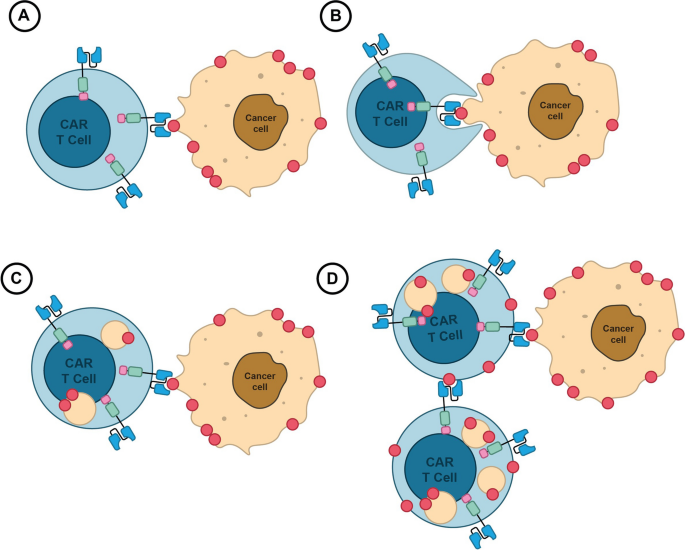
(Fig.2:BCMA脱落与CAR T细胞 fratricide机制图)
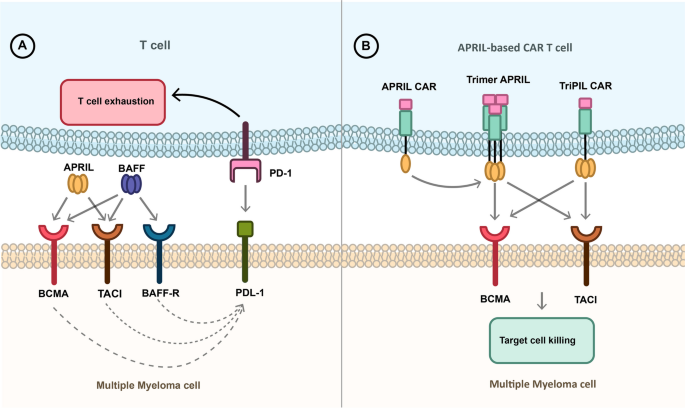
(Fig.3:APRIL-based CAR T细胞靶向BCMA/TACI的机制图)
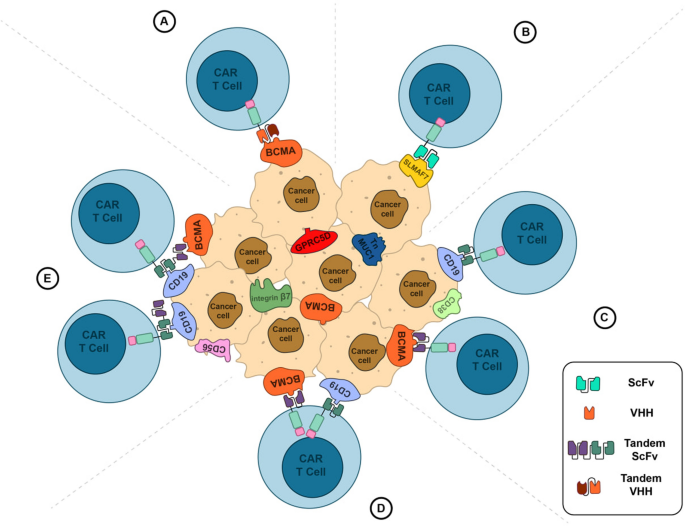
(Fig.4:多抗原靶向CAR T细胞的设计策略图)
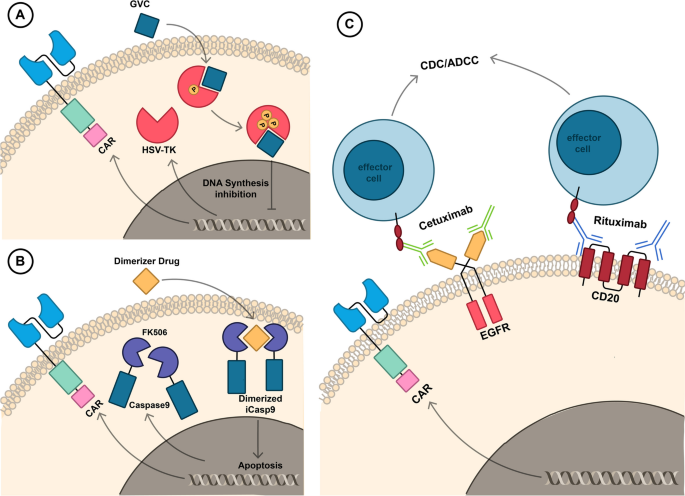
(Fig.5:自杀基因降低CAR T毒性的机制图)
