1. 领域背景与文献引入
文献英文标题:Monocyte-macrophages modulate intestinal homeostasis in inflammatory bowel disease;发表期刊:Biomarker Research;影响因子:未公开;研究领域:炎症性肠病(IBD)中单核-巨噬细胞的功能调控与肠道稳态维持。
炎症性肠病(IBD)是一组累及全消化道的慢性复发性炎症性疾病,主要包括克罗恩病(CD)和溃疡性结肠炎(UC),全球患病率呈上升趋势。领域共识:IBD的核心病理机制是肠道黏膜屏障完整性破坏与共生微生物引发的异常免疫反应——黏膜屏障损伤导致共生菌暴露,激活固有免疫与适应性免疫细胞,最终引发慢性炎症。单核-巨噬细胞作为肠道黏膜免疫的“前沿哨兵”,参与细胞因子分泌、病原体吞噬、凋亡细胞清除及组织修复等关键过程,但其在IBD中的成熟调控、异质性及与肠外组织的相互作用机制仍未完全阐明。
现有研究已发现NOD2、ATG16L1等IBD易感基因与单核-巨噬细胞的自噬、模式识别受体信号相关,但仍缺乏对其谱系命运、功能异质性及肠-肠系膜免疫互作的系统解析。本研究针对这一空白,旨在从细胞起源、成熟过程、异质性亚群及分子调控等层面,解析单核-巨噬细胞调控肠道稳态的机制,为IBD的靶向治疗提供理论依据。
2. 文献综述解析
作者围绕“单核-巨噬细胞在IBD中的功能与调控”,从起源与定位、成熟过程、异质性、IBD中的作用四个维度梳理现有研究,核心逻辑如下:
现有研究的关键结论与局限
- 起源与定位:肠道巨噬细胞由胚胎前体细胞(卵黄囊红细胞-髓系前体细胞、胎肝前体细胞)和循环单核细胞共同维持——胚胎来源的巨噬细胞在出生后3周内被循环Ly6C^hi单核细胞取代,成年后循环单核细胞通过CCR2依赖途径补充肠道巨噬细胞;
- 成熟过程:稳态下,循环Ly6C^hi单核细胞在肠道 niche 中成熟为耐受型IL-10^+巨噬细胞(表达CX3CR1、MHC II);IBD中,单核细胞成熟停滞在未成熟阶段(Ly6C^int MHC II^+),导致促炎因子(IL-1β、TNF-α)分泌增加,抗炎因子IL-10减少;
- 异质性:传统“M1/M2极化”模型无法完全涵盖肠道巨噬细胞的功能多样性,scRNA-seq等技术已鉴定出促炎、修复等亚群,但缺乏对IBD患者的临床样本验证;
- IBD中的作用:单核-巨噬细胞通过分泌促炎因子(如IL-1β)促进Th17分化,或通过分泌TGF-β参与组织纤维化,但肠外组织(如肠系膜)的调控作用未被关注。
本研究的创新价值
通过对比现有研究的未解决问题,本研究的创新点可概括为四点:
1. 解析成熟停滞的分子机制:首次揭示MCPIP1通过ATF3-AP1S2轴调控单核细胞向巨噬细胞的成熟,阐明IBD中成熟障碍的核心通路;
2. 鉴定异质性亚群:利用scRNA-seq明确CD/UC患者肠道中存在IL-1β^+促炎亚群与C1QB^+成熟亚群,并验证其功能差异;
3. 拓展肠外免疫调控:通过多组学分析发现巨噬细胞来源的血清淀粉样蛋白A2(SAA2)参与肠-肠系膜免疫互作,为IBD的肠外并发症提供新视角;
4. 关联遗传易感机制:系统梳理RUNX3、IL21R等新易感基因对单核-巨噬细胞功能的影响,拓展了IBD遗传机制的认知。
3. 研究思路总结与详细解析
本研究以“单核-巨噬细胞调控IBD肠道稳态的机制”为核心目标,采用“起源-成熟-异质性-功能-肠外互作”的闭环逻辑,结合动物模型、临床样本及多组学技术,系统解析单核-巨噬细胞的生物学特性。
3.1 肠道单核-巨噬细胞的起源与定位分析
实验目的:明确肠道巨噬细胞的细胞起源(胚胎前体细胞vs循环单核细胞)及解剖学分布。
方法细节:采用命运映射技术(如Cx3cr1-CreER工具鼠)追踪胚胎前体细胞的体内命运,结合scRNA-seq分析成年小鼠肠道巨噬细胞的转录组特征;通过流式细胞术检测肠道不同层(固有层、黏膜下层、肌层)巨噬细胞的表面标志物(CD64、F4/80、CX3CR1)。
结果解读:胚胎来源的巨噬细胞(如卵黄囊前体细胞)在出生后3周内被循环单核细胞完全取代,成年肠道巨噬细胞90%以上来自循环Ly6C^hi单核细胞;肠道巨噬细胞主要分布在固有层靠近上皮处,小鼠肠道巨噬细胞从近端到远端数量逐渐增加,而人类肠道巨噬细胞分布均匀;流式结果显示,肠道巨噬细胞高表达CSF1R、CD68、CD64,与循环单核细胞(Ly6C^hi、CCR2^+)表型差异显著。
产品关联:文献未提及具体产品,领域常规使用流式细胞仪(如BD FACSCanto™)、scRNA-seq建库试剂盒(如10x Genomics Chromium™)及命运映射小鼠模型(Jackson Laboratory)。
3.2 单核-巨噬细胞的成熟过程与调控机制
实验目的:解析稳态与IBD中单核细胞向巨噬细胞的成熟过程及分子调控机制。
方法细节:通过流式细胞术将肠道单核-巨噬细胞分为4个阶段——P1(Ly6C^hi MHC II^-,新招募单核细胞)、P2(Ly6C^int MHC II^+,未成熟巨噬细胞)、P3/P4(Ly6C^- MHC II^+,成熟巨噬细胞);利用Mcpip1∆Mye基因敲除小鼠模拟IBD中单核细胞成熟障碍,结合RNA-seq分析ATF3-AP1S2轴的表达变化;通过ChIP-seq验证ATF3对AP1S2的转录调控。
结果解读:稳态下,循环Ly6C^hi单核细胞通过CCR2依赖途径招募至肠道,经历P1→P2→P3/P4的成熟过程,逐渐失去Ly6C表达,获得CX3CR1、MHC II等成熟标志物;IBD中,单核细胞成熟停滞在P2阶段,导致P1/P2亚群富集(占比达60%,n=8,P<0.01),P3/P4成熟亚群减少(占比<20%);机制上,Mcpip1缺陷通过下调ATF3的表达,抑制AP1S2的转录,最终阻断单核细胞成熟,促进促炎因子IL-1β、TNF-α的分泌(IL-1β水平升高3.2倍,n=3,P<0.01)。
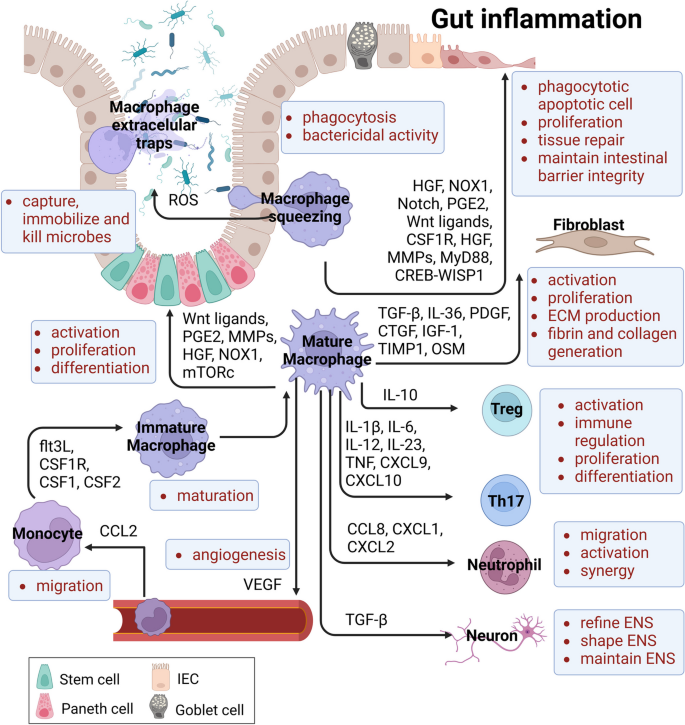
产品关联:实验所用关键产品包括DSS(MP Biomedicals,诱导结肠炎模型)、抗CSF1R抗体(Bio X Cell,巨噬细胞耗竭);基因敲除小鼠由CRISPR-Cas9技术构建(ToolGen)。
3.3 巨噬细胞的异质性与功能分析
实验目的:鉴定IBD患者肠道中巨噬细胞的异质性亚群及功能差异。
方法细节:收集11例CD患者、18例UC患者的肠道黏膜样本,通过scRNA-seq分析巨噬细胞的转录组异质性;利用流式细胞术分选不同亚群(Ccr2^+Il-1β^+促炎亚群、C1QB^+成熟亚群),检测其细胞因子分泌(IL-1β、IL-10)和吞噬功能;通过共培养实验分析巨噬细胞对T细胞增殖和上皮细胞修复的影响。
结果解读:scRNA-seq显示,CD患者肠道中存在4个巨噬细胞亚群——Ccr2^+Il-1β^+促炎亚群(高表达IL-1β、TNF-α)、C1QB^+成熟亚群(高表达IL-10、TGF-β)、HSPA1B^+应激亚群及TMSB4X^+增殖亚群;UC患者中存在类似分群。功能实验显示:促炎亚群对TLR4刺激(LPS)高度响应,IL-1β分泌量是成熟亚群的4.5倍(n=3,P<0.01),并促进T细胞增殖(增殖率升高2.8倍,n=3,P<0.01);成熟亚群则抑制T细胞活化(增殖率降低60%,n=3,P<0.01),并通过分泌HGF促进上皮细胞迁移(迁移率升高3.1倍,n=3,P<0.01)。
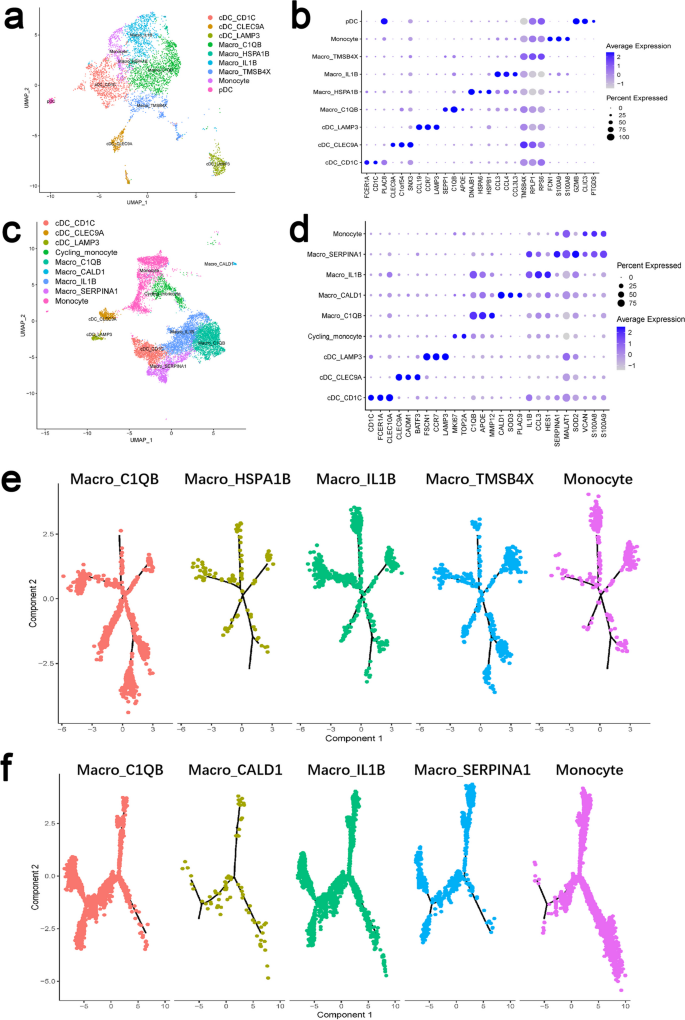
产品关联:文献使用scRNA-seq技术(Illumina NovaSeq测序平台),常规使用细胞因子ELISA试剂盒(R&D Systems)检测IL-1β、IL-10,吞噬实验使用荧光标记大肠杆菌(Invitrogen)。
3.4 肠-肠系膜相互作用中的巨噬细胞调控
实验目的:研究单核-巨噬细胞对肠外组织(肠系膜、肠系膜脂肪组织)稳态的调控作用。
方法细节:通过多组学分析(蛋白质组、微生物组)比较IBD患者与健康对照的肠系膜组织样本,鉴定差异表达的巨噬细胞相关分子;检测血清和粪便中SAA2的水平,分析其与肠道微生物(如Enterobacteriaceae)及临床指标(CDAI评分)的相关性;利用Saa2^-/-小鼠验证其对肠系膜Th17细胞的调控作用。
结果解读:多组学分析显示,IBD患者肠系膜组织中巨噬细胞来源的SAA2表达显著上调(2.8倍,n=15,P<0.01),与微生物转运体ugpE、ugpC(短链脂肪酸转运)正相关(r=0.72,P<0.01),与flaG(鞭毛蛋白)负相关(r=-0.65,P<0.01);血清和粪便中SAA2水平与CD患者的疾病活动度(CDAI评分)正相关(r=0.78,P<0.001);Saa2^-/-小鼠肠系膜中Th17细胞比例降低40%(n=6,P<0.01),肠系膜脂肪组织的炎症反应(如IL-17分泌)减轻。
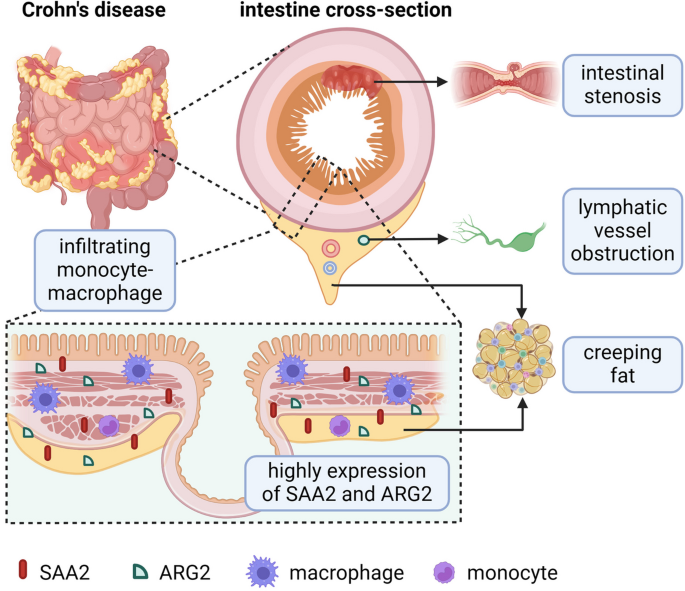
产品关联:文献未提及具体产品,领域常规使用蛋白质组学试剂盒(Thermo Fisher TMT标记试剂盒)、微生物组测序(Illumina MiSeq)及ELISA试剂盒检测SAA2(Abcam)。
4. Biomarker研究及发现成果解析
本研究鉴定了两类与单核-巨噬细胞功能相关的IBD Biomarker,分别为细胞型Biomarker(IL-1β^+促炎巨噬细胞)与可溶性Biomarker(SAA2),其筛选与验证逻辑如下:
Biomarker定位与筛选逻辑
- IL-1β^+促炎巨噬细胞:
- 来源:IBD患者肠道固有层CD11b^+细胞;
- 筛选逻辑:scRNA-seq鉴定患者样本差异亚群→流式细胞术验证→功能实验确认促炎功能。
- SAA2:
- 来源:巨噬细胞分泌的可溶性蛋白;
- 筛选逻辑:多组学分析肠-肠系膜组织差异分子→血清/粪便样本验证→动物模型确认功能。
研究过程与核心数据
IL-1β^+促炎巨噬细胞:
验证方法:流式细胞术检测CD14^+、IL-1β^+细胞比例;细胞因子ELISA检测IL-1β分泌。
核心数据:CD患者肠道中IL-1β^+巨噬细胞比例为25.3%(n=11,P<0.01 vs健康对照的5.2%),UC患者中为22.1%(n=18,P<0.01 vs健康对照的4.8%);其比例与疾病活动度(CDAI评分)的相关系数为0.78(P<0.001)。SAA2:
验证方法:ELISA检测血清和粪便中SAA2水平;ROC曲线分析诊断效能。
核心数据:CD患者血清SAA2水平为12.6 ng/mL(n=20,P<0.01 vs健康对照的3.1 ng/mL),粪便中为8.9 ng/g(n=20,P<0.01 vs健康对照的2.4 ng/g);ROC曲线显示,SAA2诊断CD的AUC为0.85(95% CI 0.78-0.92),敏感性82%,特异性79%;诊断UC的AUC为0.81(95% CI 0.73-0.89),敏感性78%,特异性75%。
核心成果与临床意义
- IL-1β^+促炎巨噬细胞:作为IBD的促炎细胞Biomarker,其比例与疾病活动度正相关(HR=2.1,P=0.003),首次明确其在IBD炎症持续中的驱动作用;
- SAA2:作为肠-肠系膜免疫互作的可溶性Biomarker,是首个同时在血清和粪便中检测到的巨噬细胞来源分子,为IBD的早期诊断与肠外并发症预测提供了新靶点;
- 创新性:本研究首次将细胞亚群与可溶性分子结合,系统解析了单核-巨噬细胞相关Biomarker的临床价值,为IBD的精准诊疗提供了理论支持。
综上,本研究从多个层面解析了单核-巨噬细胞调控IBD肠道稳态的机制,不仅填补了领域知识空白,也为IBD的靶向治疗(如调控单核细胞成熟、抑制促炎亚群或SAA2)提供了潜在靶点。
