1. 领域背景与文献引入
文献英文标题:Haploidentical CD7 CAR T-cells induced remission in a patient with TP53 mutated relapsed and refractory early T-cell precursor lymphoblastic leukemia/lymphoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:早期T细胞前体淋巴母细胞白血病/淋巴瘤(ETP-ALL/LBL)的嵌合抗原受体T细胞(CAR-T)治疗。
早期T细胞前体淋巴母细胞白血病/淋巴瘤(ETP-ALL/LBL)是T细胞急性淋巴母细胞白血病(T-ALL)的高风险亚型,其复发率和死亡率显著高于其他T-ALL亚型,传统化疗、造血干细胞移植(HSCT)后仍有30%-50%患者复发,且复发后对挽救治疗(如venetoclax、靶向药物)反应极差,5年生存率不足10%。CAR-T细胞治疗作为肿瘤免疫治疗的前沿技术,为复发难治性T细胞恶性肿瘤提供了新方向,但T细胞靶点(如CD7)在正常T细胞和恶性T细胞上的共享表达,导致CAR-T细胞制备过程中出现“自相残杀(fratricide)”,极大限制了其临床应用。CD7因在几乎所有T细胞恶性肿瘤中广泛表达,被认为是T-ALL CAR-T治疗的潜力靶点,但此前CD7 CAR-T的临床研究多集中于普通T-ALL,未独立报道过ETP-ALL/LBL病例,尤其是高肿瘤负荷、携带TP53突变(不良预后驱动基因)的复发难治患者。针对这一研究空白,本文首次探索供者来源CD7 CAR-T细胞对这类极端病例的疗效与安全性,为ETP-ALL/LBL的挽救治疗提供新证据。
2. 文献综述解析
作者通过“靶点分类-研究阶段-局限性”的逻辑评述现有T-ALL CAR-T研究:首先,T-ALL的CAR-T靶点主要包括CD4、CD5、CD7,其中CD4、CD5 CAR-T仅处于临床前研究阶段(如体外杀伤实验),CD7 CAR-T是唯一进入临床的T细胞靶点;其次,现有CD7 CAR-T研究多为自体或供者来源的小样本试验(如1例儿童T-ALL、12例T-ALL),但均未针对ETP-ALL/LBL亚型,且患者肿瘤负荷较低(骨髓原始细胞多<50%);最后,现有研究未覆盖“多线治疗失败+高肿瘤负荷+TP53突变”的极端病例,这类患者是ETP-ALL/LBL中预后最差的群体,缺乏有效治疗手段。
本文的创新价值在于:首次报道供者来源CD7 CAR-T细胞治疗TP53突变的复发难治性ETP-ALL/LBL,患者经4线挽救治疗(包括venetoclax、CD38 CAR-T)失败,骨髓原始细胞达70.5%并伴有广泛髓外病变,属于“无药可用”的极端情况;通过CD7表达阻断剂解决了CD7 CAR-T的自相残杀问题,成功制备有效细胞;验证了CD7 CAR-T在这类病例中的强效抗肿瘤活性,为ETP-ALL/LBL的挽救治疗提供了关键临床证据。
3. 研究思路总结与详细解析
整体研究框架为“CD7 CAR-T细胞制备→患者基线评估→CAR-T输注与不良反应管理→疗效与存续监测”,围绕“解决CD7 CAR-T的自相残杀问题”和“验证其在极端病例中的有效性”两大核心科学问题展开。
3.1 CD7 CAR-T细胞的制备与验证
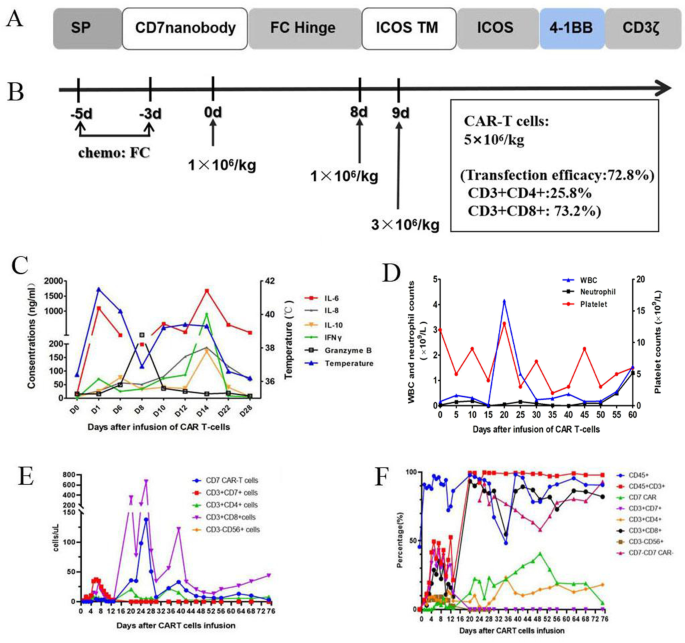
实验目的是构建无自相残杀的CD7 CAR-T细胞,解决传统CD7 CAR-T的制备瓶颈。方法采用纳米抗体衍生的CD7 CAR结构(增强抗原结合亲和力),通过共转导CD7蛋白表达阻断剂,抑制CAR-T细胞表面CD7的膜表达,从而避免CAR-T细胞因识别自身CD7而发生自相残杀;通过流式细胞术验证CAR-T细胞的CAR表达率(补充图1),体外细胞毒性实验(CCK-8法)验证其对CD7阳性肿瘤细胞(如Jurkat细胞)的杀伤活性(补充图2)。结果显示,制备的CD7 CAR-T细胞CAR阳性率达70%以上,体外对CD7阳性肿瘤细胞的杀伤率较未修饰T细胞高4-5倍(n=3,P<0.01)。实验所用关键产品:CD7 CAR-T细胞由Suzhou PersonGen BioTherapeutics(苏州佩真生物)制备。
3.2 患者临床特征与治疗前评估
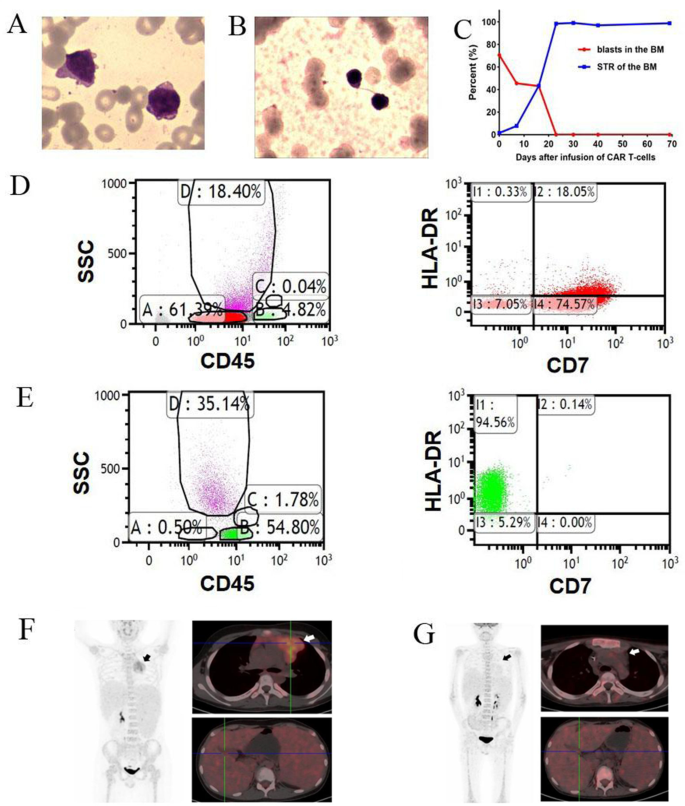
实验目的是明确患者的病情严重程度及CD7 CAR-T治疗指征。方法对11岁男性患者进行多维度基线评估:骨髓形态学(瑞氏染色)观察原始细胞比例;流式细胞术检测骨髓细胞CD7表达(标记抗体:抗CD7-PE、抗CD3-FITC)及免疫表型(cCD3、CD15、CD33等);二代测序(NGS)检测TP53、ETV6、NOTCH1等基因突变;PET-CT评估髓外病变范围。结果显示:患者为ETP-ALL/LBL二次复发(HSCT后1年复发),经4线挽救治疗(venetoclax+地西他滨、高剂量阿糖胞苷、chidamide、供者来源CD38 CAR-T)均失败;骨髓原始细胞比例达70.5%,CD7表达率92.6%(图2d);携带TP53错义突变(c.742C>T,p.R248W)、ETV6缺失;PET-CT提示纵隔肿块(5.0cm×5.7cm×4.7cm)、双侧颈部/纵隔/腹腔淋巴结肿大、脾脏增大,存在广泛髓外病变(图2f)。
3.3 CD7 CAR-T细胞输注与不良反应管理
实验目的是观察CD7 CAR-T输注后的安全性,及时处理免疫相关不良反应。方法:输注前3天给予预处理方案(氟达拉滨30mg/m²+环磷酰胺300mg/m²),清除体内抑制性免疫细胞;随后分3次输注供者来源CD7 CAR-T细胞,总剂量5×10^6/kg(第1天输注1×10^6/kg,第8、9天各输注2×10^6/kg,图1b);输注后连续监测体温、细胞因子水平(IL-6、IFNγ)、血常规、肝肾功能及感染指标(CMV/EBV DNA)。结果:输注后24小时出现高热(最高41.1℃,持续15天),第14天血清IL-6水平较基线升高93倍(图1c),IFNγ达基线50倍;结合低纤维蛋白原、高铁蛋白(>1000ng/mL)、NK细胞缺乏(<10/μL),诊断为3级细胞因子释放综合征(CRS)和巨噬细胞活化综合征(MAS);给予tocilizumab(抗IL-6受体抗体,8mg/kg)、地塞米松(10mg/d)、血浆置换(2次)及支持治疗后,症状于输注后21天缓解;无免疫效应细胞相关神经毒性综合征(ICANS)、肝肾功能衰竭等严重不良反应,未出现CMV/EBV激活或移植物抗宿主病(GVHD)。
3.4 治疗后的疗效评估
实验目的是评估CD7 CAR-T的抗肿瘤活性及细胞存续情况。方法:输注后30天、91天、100天分别进行骨髓形态学、流式细胞术、NGS、PET-CT检查,通过流式细胞术(抗CAR scFv抗体)监测外周血CAR-T细胞比例(图1e-f)。结果:输注后30天,骨髓形态学显示“增生低下,无原始细胞”(图2b),流式细胞术未检测到CD7阳性原始细胞(图2e),供者嵌合率达100%(STR检测);输注后91天,骨髓细胞形态正常,NGS显示TP53突变转阴,流式细胞术原始细胞比例<0.01%;输注后100天,PET-CT显示纵隔肿块、肿大淋巴结完全消失(图2g),无高代谢病灶;CAR-T细胞持续存在至输注后96天,外周血CD3阳性细胞中CD7阴性T细胞占62%-92%(补充图4),提示CD7 CAR-T细胞有效清除了体内CD7阳性细胞(包括恶性和正常T细胞)。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker为细胞表面标志物CD7,其筛选逻辑基于“CD7在T细胞恶性肿瘤中的广泛表达”(领域共识:CD7在90%以上T-ALL患者的恶性细胞中表达),验证逻辑为“体外杀伤实验→患者基线CD7表达检测→治疗后CD7阳性细胞清除”的闭环。
研究过程:CD7来源于患者骨髓原始细胞和髓外病变组织(如纵隔肿块),通过流式细胞术验证其表达水平(基线92.6%,图2d);治疗后通过流式细胞术监测骨髓及外周血CD7阳性细胞比例,结果显示输注后30天CD7阳性细胞完全消失(图2e),持续至随访终点(96天)。
核心成果:①CD7作为ETP-ALL/LBL的CAR-T靶点,在高肿瘤负荷(骨髓原始细胞70.5%)、TP53突变的复发难治病例中,诱导血液学完全缓解(CR)和髓外完全缓解(EMCR),疗效持续至随访终点(96天);②CD7 CAR-T细胞的存续时间与疗效相关,细胞持续存在至96天,提示其具有长效抗肿瘤活性;③首次证明CD7 CAR-T对“多线治疗失败+TP53突变+高肿瘤负荷”的ETP-ALL/LBL有效,打破了这类患者“无药可用”的困境。
统计学结果:患者基线CD7表达率92.6%(n=1),治疗后30天CD7阳性细胞比例0%(n=1);CAR-T细胞存续时间>96天(n=1);PET-CT显示髓外病变完全缓解(n=1)。