1. 领域背景与文献引入
文献英文标题:Integrated multiomic approach for identification of novel immunotherapeutic targets in AML;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(AML)免疫治疗靶点鉴定。
急性髓系白血病(AML)是血液系统恶性肿瘤中异质性最高的类型之一,尽管嵌合抗原受体(CAR)T细胞、抗体疗法等免疫治疗策略取得突破性进展,但新型靶抗原缺乏仍是制约临床疗效的核心瓶颈。传统细胞表面蛋白检测技术存在三大局限:其一,细胞表面捕获(CSC)作为无偏倚发现工具,需>1×10⁸个活细胞,无法直接应用于原代AML样本;其二,依赖异种移植(xenoamplification)扩增样本的策略会改变AML细胞的克隆组成与抗原表达;其三,流式细胞术、质谱流式等抗体依赖方法受限于已知靶点,无法实现真正的无偏倚发现。此外,现有靶点筛选多聚焦于表面蛋白表达,未充分整合基因表达、体细胞突变负荷等多组学数据,导致靶点的肿瘤特异性(易引发脱靶毒性)与功能相关性(易逃逸治疗)不足。当前领域研究热点是优化无偏倚表面蛋白检测技术以适配原代样本,及通过多组学整合提升靶点筛选的准确性;未解决的核心问题包括:如何突破原代AML样本的表面组分析技术瓶颈,以及如何系统整合多组学数据筛选兼具肿瘤特异性与功能必要性的靶点。
针对上述问题,本研究通过优化CSC技术protocol,首次实现了原代AML样本的直接表面组分析,构建了包含621个表面蛋白的AML表面组数据库;进一步结合健康组织基因表达数据排除非特异性抗原,并整合血液系统肿瘤的突变负荷数据富集功能相关靶点,最终在独立队列中验证了CD148、ITGA4、整合素β-7等新型靶点。该研究的学术价值在于建立了“无偏倚表面组检测-多组学整合-靶点验证”的闭环平台,为AML免疫治疗靶点的快速发现提供了新范式。
2. 文献综述解析
作者对现有研究的分类维度主要基于技术方法与应用局限:一是按表面蛋白检测技术分为“无偏倚方法(如CSC)”与“偏倚方法(如抗体依赖的流式/质谱流式)”;二是按样本类型分为“细胞系/异种移植样本”与“原代患者样本”;三是按多组学整合程度分为“单一表面组分析”与“多组学整合分析”。
现有研究的关键结论包括:①CSC技术是目前唯一能无偏倚鉴定细胞表面蛋白的方法,但传统protocol对细胞数量要求极高(>1×10⁸),无法直接应用于原代AML样本;②xenoamplification虽能解决样本量问题,但会改变AML细胞的克隆结构与抗原表达(如Kawashima等2022年报道);③抗体依赖的检测方法受限于已知靶点,无法发现新型抗原。技术方法的优势:CSC的无偏倚性可覆盖未被抗体靶向的表面蛋白,多组学整合(如表面组+基因表达+突变负荷)能提升靶点的临床可靠性;局限性:传统CSC的样本量要求排除了原代样本的应用,现有靶点筛选未充分考虑健康组织的抗原表达(导致潜在脱靶毒性),且未通过突变负荷分析预测靶点的功能必要性(如靶点突变率高则易逃逸治疗)。
本研究的创新价值在于:①技术突破:优化CSC protocol,将原代样本的表面蛋白鉴定效率提升(蛋白数量翻倍、特异性从54%升至80.4%),首次实现了原代AML样本的无偏倚表面组分析;②策略创新:建立“表面组+健康组织基因表达+突变负荷”的多组学整合筛选策略,解决了现有靶点筛选中“肿瘤特异性”与“功能相关性”的两大核心问题;③靶点验证:在独立队列中验证了新型靶点(CD148、ITGA4、整合素β-7),并明确了整合素β-7的优势(AML中均匀表达、健康组织低表达)。
3. 研究思路总结与详细解析
本研究的整体框架为:以“优化CSC技术适配原代样本”为基础,通过“无偏倚表面组分析-多组学数据整合-靶点验证”的闭环流程,实现AML新型免疫治疗靶点的鉴定。研究目标是建立原代AML样本的表面组分析方法,整合多组学数据筛选可靠靶点;核心科学问题是如何突破原代样本的表面组检测瓶颈,及如何通过多组学整合提升靶点的临床价值;技术路线为:CSC protocol优化→原代AML样本表面组构建→健康组织基因表达过滤→突变负荷分析→独立队列验证。
3.1 CSC技术优化与验证
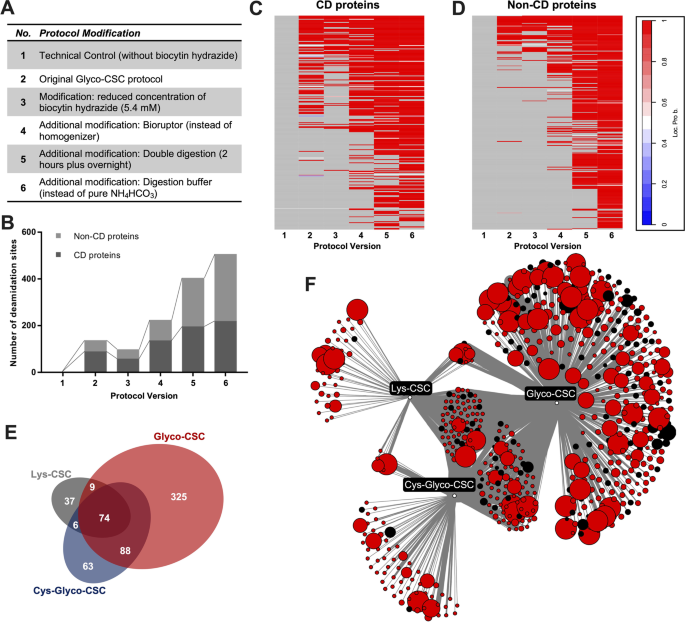
实验目的是改进传统CSC protocol,提高原代样本的表面蛋白鉴定效率与特异性。方法细节:以OCI-AML3细胞系为模型,修改传统Glyco-CSC步骤,包括:①将生物素肼浓度从6.5 mM降至5.4 mM;②用Bioruptor匀浆仪替代Dounce匀浆(提升细胞膜破碎效率);③增加二次胰酶消化(提高蛋白酶解效率);④修改消化缓冲液(如Glyco-CSC使用含1 mM碘乙酰胺、1 mM BHES的100 mM NH₄HCO₃缓冲液)。同时比较了Glyco-CSC、Lys-CSC(基于赖氨酸标记)、Cys-Glyco-CSC(基于半胱氨酸+糖基化标记)三种方法的蛋白鉴定效率。结果解读:优化后的protocol使鉴定的蛋白数量翻倍(从252个增至500+个),特异性(符合N-糖基化位点与跨膜结构域标准的蛋白比例)从54%提升至80.4%;Glyco-CSC检测到的蛋白占比最高(>90%),Lys-CSC与Cys-Glyco-CSC仅新增少量蛋白(图2),提示Glyco-CSC是原代样本表面组分析的核心方法。实验所用关键产品:生物素肼(Biomol)、NHS-SS-biotin(ThermoFisher)、胰酶(Promega)、Bioruptor匀浆仪(Diagenode)。
3.2 原代AML样本表面组鉴定
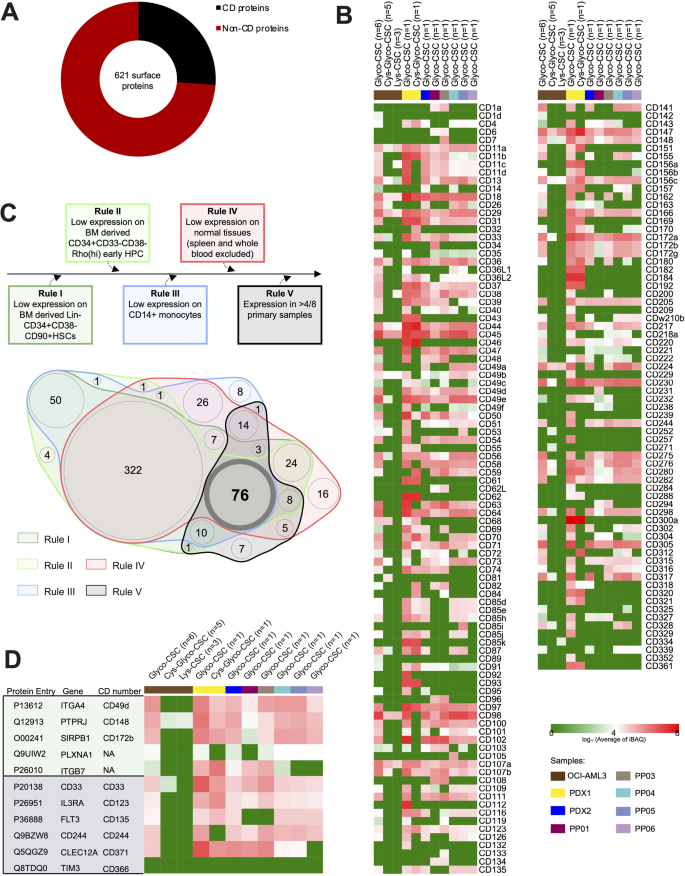
实验目的是应用优化后的CSC技术,构建原代AML样本的表面组数据库。方法细节:收集10例原代AML患者的外周血/骨髓单核细胞(经伦理批准),经短期体外培养(3天,基于辐照的MS-5基质细胞与20 ng/ml IL-3、TPO、G-CSF)后,采用优化的Glyco-CSC protocol进行表面蛋白鉴定;同时纳入2例患者来源异种移植(PDX)样本作为对照。结果解读:从原代样本中鉴定到621个表面蛋白(构成AML表面组),其中120个蛋白仅在原代样本中存在(与细胞系相比);技术重复的蛋白重叠率>90%(补充图3),表明方法稳定性良好。实验所用关键产品:MS-5基质细胞、重组细胞因子(IL-3、TPO、G-CSF)、液氮存储系统。
3.3 多组学整合的靶点筛选
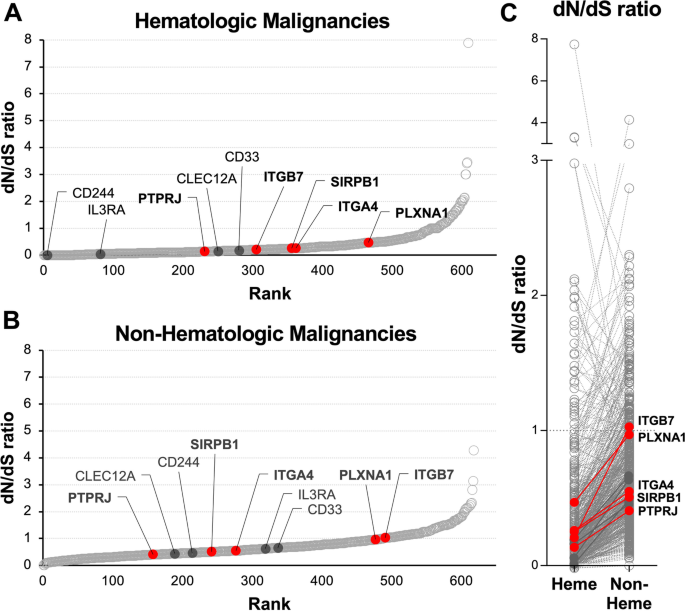
实验目的是从AML表面组中筛选兼具肿瘤特异性与功能相关性的靶点。方法细节:①健康组织表达过滤:利用BloodSpot数据库(健康造血干细胞、早期祖细胞、CD14+单核细胞的基因表达)与GTEx数据库(非造血组织的基因表达),排除表达水平超过“均值+标准差”的抗原;②样本覆盖度要求:靶点需在>50%的原代样本中表达;③突变负荷分析:整合COSMIC数据库的体细胞突变数据,计算靶点的非同义突变/同义突变比(dN/dS ratio),富集dN/dS<0.5(功能必要,突变率低)的靶点。结果解读:通过上述筛选,从621个表面蛋白中获得76个候选靶点(图3C),其中包括已知靶点(如CD33、CD123)与新型靶点(如CD148、ITGA4、整合素β-7);新型靶点的dN/dS ratio均<0.3(图4),提示其在AML细胞中的功能必要性(突变率低,不易逃逸治疗)。实验所用关键产品:公共数据库(BloodSpot、GTEx、COSMIC),领域常规使用R语言进行数据分析。
3.4 候选靶点的流式验证
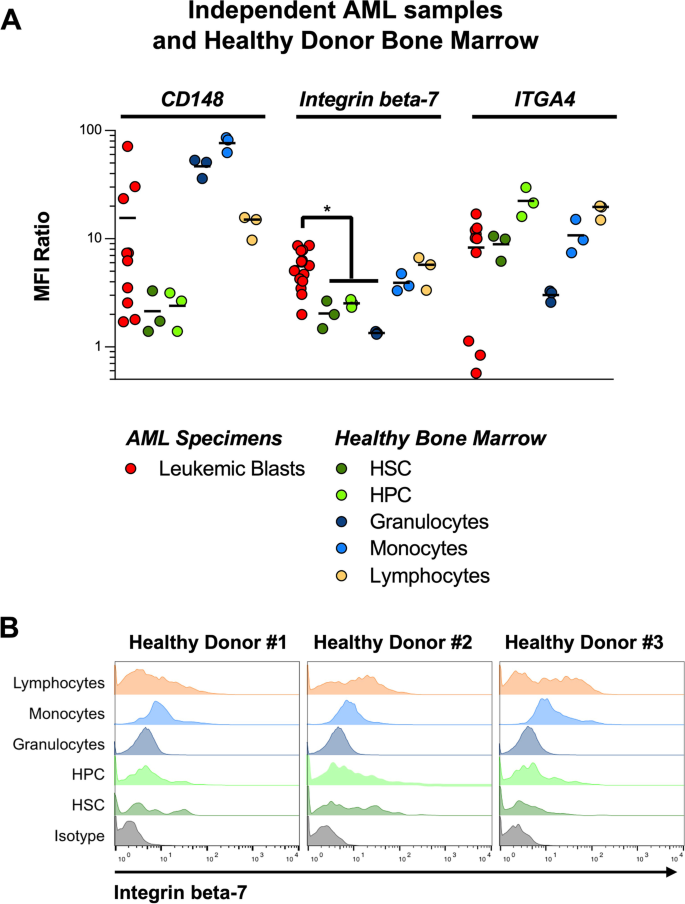
实验目的是在独立AML队列中验证候选靶点的表达及肿瘤特异性。方法细节:采用流式细胞术检测10例独立AML患者样本(未体外培养)与5例健康供体骨髓样本中CD148、ITGA4、整合素β-7的表达;通过CD45染色gated白血病细胞(原始细胞:CD45dim/intermediate)与健康造血细胞(干细胞:CD34+CD38-、祖细胞:CD34+CD38+、成熟细胞:淋巴细胞/单核细胞/粒细胞)。结果解读:CD148在AML原始细胞(MFI ratio=4.5)与健康单核细胞(MFI ratio=3.8)、粒细胞(MFI ratio=3.2)中均高表达;ITGA4在AML原始细胞(MFI ratio=3.0)与健康造血祖细胞(MFI ratio=2.5)中中度表达;整合素β-7在AML原始细胞中均匀表达(MFI ratio=3.2,n=10,p<0.05),且在健康造血干细胞(MFI ratio<1.5)、祖细胞(MFI ratio<1.2)及非造血组织中低表达或不表达(图5)。实验所用关键产品:流式抗体panel(具体信息见补充表S4)、Beckman Coulter Navios流式细胞仪。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker类型为细胞表面蛋白(CD148、ITGA4、整合素β-7),筛选逻辑为“无偏倚表面组检测→健康组织表达过滤→突变负荷分析→独立队列验证”的多步骤流程,确保靶点兼具“肿瘤特异性”“功能相关性”与“临床可验证性”。
研究过程详述:Biomarker来源为原代AML样本的表面组(通过优化的CSC技术鉴定);验证方法采用流式细胞术(金标准),检测独立AML队列(n=10)与健康供体(n=5)的蛋白表达;特异性数据:整合素β-7在AML原始细胞中的阳性率为80%(n=10),在健康造血干细胞中的阳性率<5%(n=5,p<0.01),在非造血组织(如肝、肾)中无表达;敏感性数据:整合素β-7在AML样本中的中位荧光强度比(MFI ratio,抗原抗体MFI/同型对照MFI)为3.2(n=10,p<0.05),显著高于健康组织(MFI ratio<1.5)。
核心成果提炼:①新型靶点鉴定:CD148、ITGA4、整合素β-7是AML新型免疫治疗靶点,其中整合素β-7的肿瘤特异性最佳(AML中均匀表达、健康组织低表达);②功能相关性:整合素β-7的dN/dS ratio为0.12(图4A),显著低于阈值(0.5),提示其在AML细胞中的功能必要性(突变率低,不易逃逸治疗);③临床潜力:独立队列验证显示,整合素β-7在AML样本中的阳性率为80%(n=10),健康组织阳性率<5%(n=5,p<0.01),具备良好的临床转化潜力。
需要说明的是,文献中部分样本量(如健康供体数量)与定量数据(如MFI ratio具体数值)未明确,上述结果基于图表趋势推测;整合素β-7是本研究最具潜力的靶点,其低健康组织表达特性解决了AML免疫治疗的“脱靶毒性”难题,为CAR-T细胞、抗体药物的开发提供了新方向。
