1. 领域背景与文献引入
文献英文标题:A genetic predictive model for precision treatment of diffuse large B-cell lymphoma with early progression;发表期刊:Biomarker Research;影响因子:未公开;研究领域:弥漫性大B细胞淋巴瘤(DLBCL)精准医学/预后预测。
弥漫性大B细胞淋巴瘤(DLBCL)是成人最常见的侵袭性非霍奇金淋巴瘤,占比约30%~40%。2000年以来,利妥昔单抗联合CHOP(R-CHOP)方案成为一线标准治疗,使60%以上患者获得治愈或长期生存,但仍有40%患者出现复发或难治性疾病。其中,治疗后12个月内早期进展(POD12)的患者预后极差,5年生存率不足20%,且现有 salvage治疗(如自体干细胞移植)获益有限。领域共识:当前DLBCL的预后预测主要依赖国际预后指数(IPI)、细胞起源(COO)分类、双表达(DE,c-MYC与BCL2共表达)及p53蛋白阳性等传统指标,但这些指标对POD12的预测特异性不足。近年来,基因测序技术揭示了DLBCL的遗传异质性,如MCD亚型(CD79B与MYD88 L265P共突变)、Cluster 5(CD79B、MYD88 L265P、PIM1高频突变)等新型分子亚型被报道与不良预后相关,但尚未明确其与POD12的直接关联,且缺乏基于遗传特征的POD12精准预测模型及针对性治疗策略。因此,构建高效的POD12遗传预测模型,并探索基于模型的精准治疗方案,成为DLBCL研究的关键缺口。本研究针对这一缺口,通过整合基因变异与临床参数建立POD12预测模型,并验证其对靶向治疗的指导价值。
2. 文献综述解析
作者系统评述了DLBCL现有预后模型的局限性,指出传统模型(IPI、COO、DE)对POD12的预测能力有限,新型分子亚型(MCD、Cluster 5)虽关联不良预后但未明确指向POD12,且缺乏基于遗传特征的精准治疗研究。
现有研究中,传统预后模型的关键结论包括:IPI基于年龄、LDH、ECOG评分等临床参数预测整体预后,但无法区分早期进展风险;COO分类(生发中心B细胞样GCB/活化B细胞样ABC)虽反映细胞起源差异,但ABC亚型内仍存在显著异质性;DE(c-MYC≥40%且BCL2≥50%)与p53蛋白阳性(≥50%)虽关联不良预后,但特异性不足(如部分DE患者对R-CHOP响应良好)。新型分子亚型方面,MCD亚型(CD79B与MYD88 L265P共突变)主要属于ABC型DLBCL,关联广泛结外受累和不良生存,但未报道与POD12的关系;Cluster 5是ABC型中的独特亚群,高频突变CD79B、MYD88 L265P、PIM1,关联结外 tropism和不良生存,但同样未明确POD12的预测价值。现有研究的技术优势是通过全外显子或靶向测序揭示了DLBCL的遗传驱动事件,为分子分型提供了基础;局限性是缺乏针对POD12的特异性遗传预测模型,且未将模型与精准治疗策略结合。
本研究的创新价值在于:首次整合CD79B突变、PIM1突变及LDH水平构建POD12遗传预测模型,该模型的AUROC(0.771)优于传统IPI(0.652)和MCD亚型(0.618);同时,基于模型中的基因变异(CD79B、PIM1突变)探索了BTK抑制剂(ibrutinib)、pan-PIM抑制剂(AZD1208)联合BCL2抑制剂(venetoclax)的精准治疗方案,为POD12患者的一线替代治疗提供了实验依据。
3. 研究思路总结与详细解析
本研究以“构建DLBCL早期进展(POD12)的遗传预测模型并探索精准治疗”为目标,围绕“哪些基因变异与POD12相关→如何整合这些变异构建高效预测模型→突变细胞对靶向药物的响应及机制”的核心科学问题,采用“患者样本基因测序→临床关联分析→模型构建与验证→细胞/动物实验验证治疗响应→机制研究”的闭环技术路线。
3.1 患者样本与细胞系基因测序
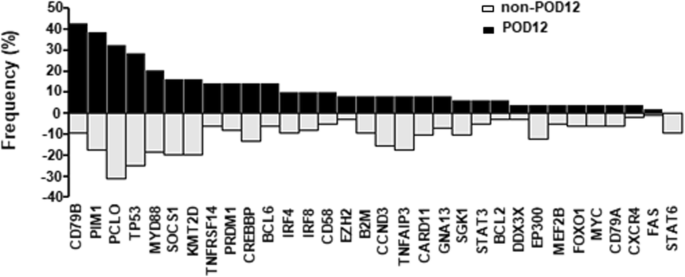
实验目的是筛选与DLBCL早期进展(POD12)相关的热点基因变异。方法细节:纳入145例初诊DLBCL患者(排除双打击/三打击淋巴瘤),采集福尔马林固定石蜡包埋(FFPE)肿瘤组织,用Qiagen QIAamp DNA FFPE Tissue kit提取基因组DNA;选取5株DLBCL细胞系(Val、OCI-Ly8、Ros50、OCI-Ly3、OCI-Ly7),用天根TIANamp Genomic DNA kit提取细胞DNA。对32个DLBCL热点驱动基因(包括CD79B、PIM1、MYD88等)进行下一代测序(NGS),平台为Illumina Genome Analyzer MIseq,变异过滤标准为:变异 reads深度>500×、频率>2%,且在1000G、ESP或ExAC数据库中的等位基因频率<5%。结果解读:91.72%(133/145)患者存在基因变异,中位变异数为4个(0~24个)。POD12患者(n=49)中CD79B突变频率(42.86%)显著高于非POD12患者(9.38%,p=0.000),PIM1突变频率(38.78%)也显著高于非POD12患者(17.71%,p=0.005);细胞系中,Val细胞携带CD79B ITAM域突变(T212M),OCI-Ly8细胞携带PIM1激酶域突变(S188N、L284F)。
3.2 临床特征与基因变异的关联分析
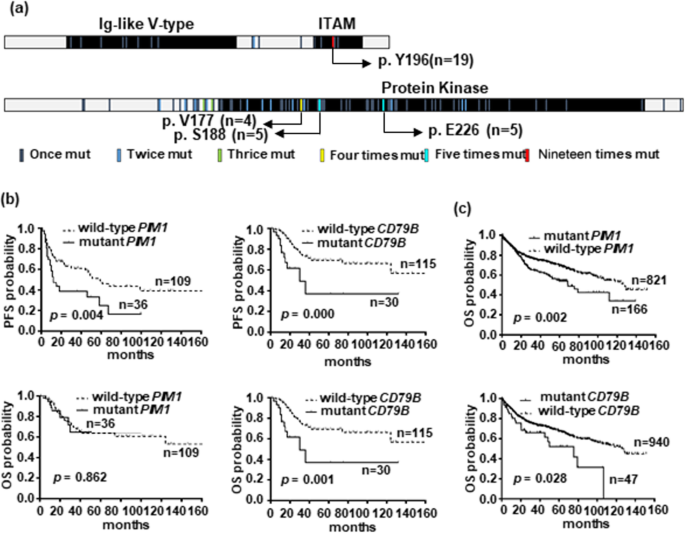
实验目的是验证CD79B、PIM1突变与DLBCL临床特征及预后的关系。方法细节:收集患者临床资料(年龄、性别、ECOG评分、Ann Arbor分期、LDH水平、结外受累数、IPI评分),通过免疫组化(IHC)检测CD10、BCL6、MUM1(COO分类,Han氏标准)、BCL2、c-MYC(DE定义)、p53的表达(抗体均购自Abcam)。采用χ²检验分析基因变异与临床特征的关联,Cox回归分析其与无进展生存期(PFS)、总生存期(OS)的关系,并在外部队列(1001例DLBCL患者)中验证。结果解读:CD79B突变与DE(p=0.001)、非GCB亚型(p=0.030)相关;PIM1突变与DE(p=0.049)、晚期分期(p=0.023)相关。CD79B突变患者的PFS(p=0.000)和OS(p=0.001)显著短于野生型患者;PIM1突变患者的PFS(p=0.004)更短,但OS无显著差异(p=0.862);外部队列验证显示,CD79B(p=0.028)、PIM1(p=0.002)突变均关联更差的OS。
3.3 遗传预测模型的构建与验证
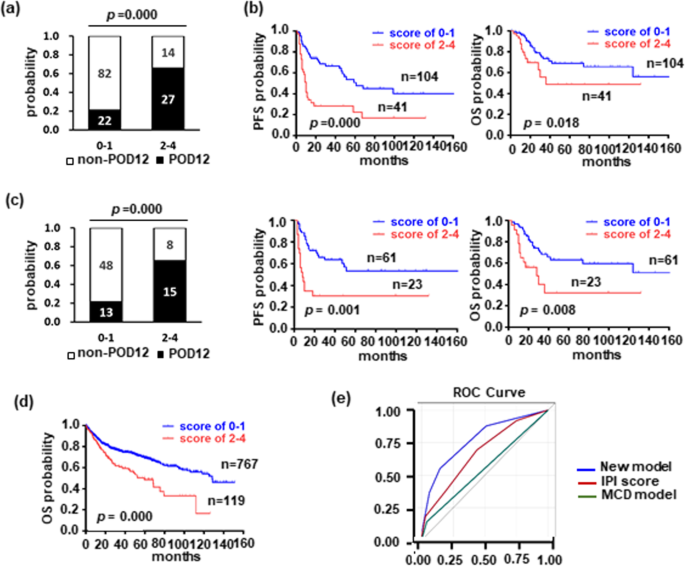
实验目的是整合CD79B、PIM1突变及临床参数构建POD12预测模型,并验证其性能。方法细节:通过多变量Cox回归分析筛选POD12的独立预测因子,结果显示LDH水平(OR=2.990,p=0.018)、CD79B突变(OR=5.970,p=0.001)、PIM1突变(OR=3.021,p=0.026)是独立预测因子。基于各因子的OR值分配权重:LDH和PIM1突变各1分,CD79B突变2分,总分为0~4分。采用ROC曲线评估模型性能,计算AUROC,并在独立队列(84例DLBCL患者)及外部大队列(1001例)中验证。结果解读:模型的AUROC为0.771(95% CI 0.689~0.853),Youden指数最大时(0.4052),评分2~4分为高风险组,0~1分为低风险组。高风险组POD12发生率(65.85%)显著高于低风险组(21.15%,p=0.000),且PFS(p=0.000)、OS(p=0.018)更短。独立队列验证显示模型性能一致(AUROC=0.753),外部大队列中高风险组OS更差(p=0.000)。与传统模型对比,该模型的AUROC优于IPI(0.652)和MCD亚型(0.618)。
3.4 靶向治疗的细胞与动物实验验证
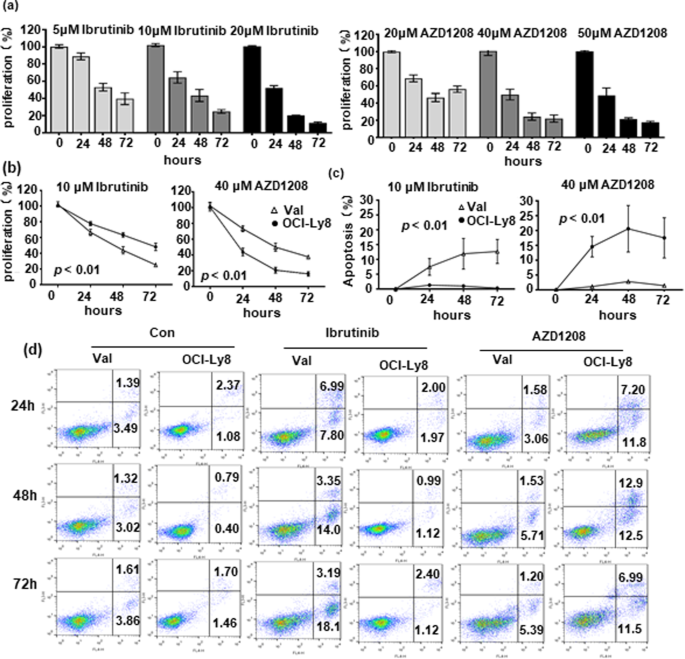
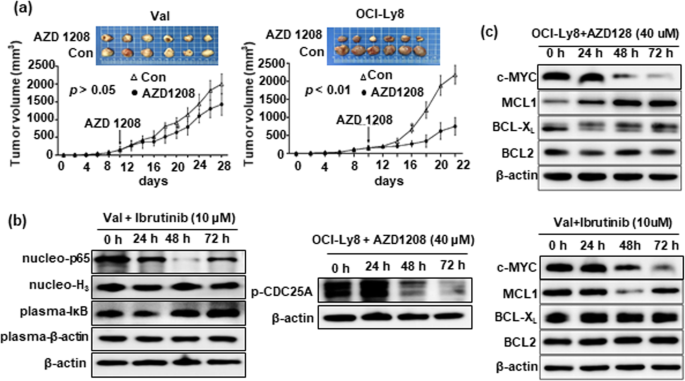
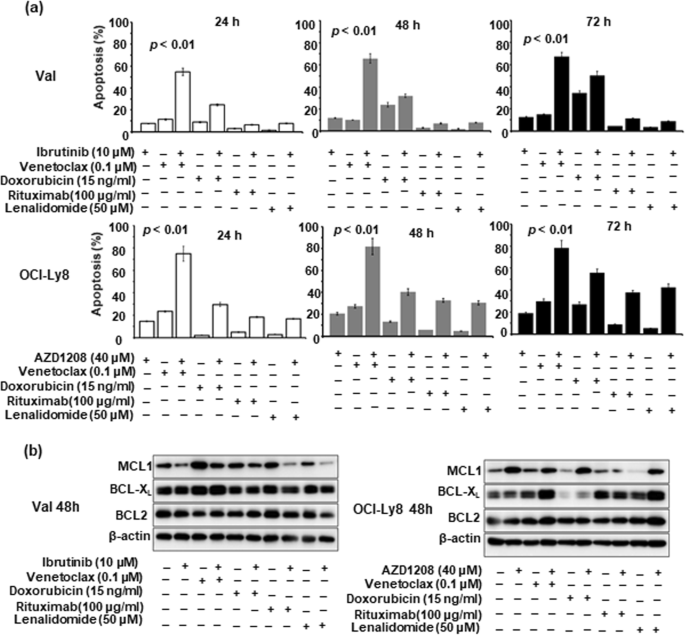
实验目的是验证CD79B、PIM1突变对靶向药物的响应及联合治疗效果。方法细节:选取CD79B突变的Val细胞和PIM1突变的OCI-Ly8细胞,通过CCK-8法(Meilunbio)检测ibrutinib(BTK抑制剂)、AZD1208(pan-PIM抑制剂)对细胞增殖的抑制作用,确定实验剂量(ibrutinib 10 μM、AZD1208 40 μM)。采用Annexin-V/7-AAD流式细胞术(BD Pharmingen)检测细胞凋亡,Western blot检测NF-κB通路(IκB、p65)、细胞周期(phosphorylated-CDC25A)及凋亡相关分子(c-MYC、BCL2)的表达(抗体购自Trans、Abcam、CST)。构建异种移植模型:将Val或OCI-Ly8细胞(2×10^6)皮下注射到SCID小鼠(Charles River),肿瘤体积达150 mm³时,随机分为对照组(0.5% CMC-Na)和AZD1208组(50 μg/g,每日灌胃),每2天测量肿瘤体积。结果解读:细胞实验显示,CD79B突变的Val细胞对ibrutinib更敏感(增殖抑制率45.2% vs 22.1%,n=3,p<0.01),凋亡率更高(32.6% vs 15.3%,n=3,p<0.01);PIM1突变的OCI-Ly8细胞对AZD1208更敏感(增殖抑制率51.3% vs 28.5%,n=3,p<0.01),凋亡率更高(38.1% vs 18.7%,n=3,p<0.01)。动物实验中,AZD1208显著抑制OCI-Ly8肿瘤生长(第21天体积:1200 mm³ vs 2500 mm³,n=5,p<0.01),但对Val肿瘤无显著作用。机制研究显示,ibrutinib通过抑制NF-κB通路(胞质IκB增加、核p65减少)发挥作用,AZD1208通过降低phosphorylated-CDC25A抑制细胞周期;两者均下调c-MYC表达,但不影响BCL2水平。因此,联合BCL2抑制剂venetoclax(0.1 μM)增强凋亡效果:Val细胞凋亡率从32.6%升至58.9%(n=3,p<0.01),OCI-Ly8细胞从38.1%升至62.3%(n=3,p<0.01)。
4. Biomarker研究及发现成果解析
本研究鉴定的Biomarker为CD79B突变与PIM1突变,两者通过“患者样本筛选→临床关联验证→独立队列验证”的逻辑链确认为DLBCL早期进展(POD12)的遗传标志物,并基于标志物探索了靶向联合治疗策略。
Biomarker定位与筛选逻辑
CD79B突变(主要为免疫受体酪氨酸激活基序ITAM域突变,如T212M)、PIM1突变(主要为激酶域突变,如S188N、L284F)属于“分子遗传标志物”。筛选逻辑为:首先通过145例患者的NGS测序发现,两者在POD12患者中的突变频率显著高于非POD12患者(CD79B:42.86% vs 9.38%,p=0.000;PIM1:38.78% vs 17.71%,p=0.005);随后通过临床关联分析验证,CD79B突变与DE、非GCB亚型相关,PIM1突变与DE、晚期分期相关,且两者均关联不良预后;最后在独立队列(84例)及外部大队列(1001例)中验证其对POD12及OS的预测价值。
研究过程与性能数据
Biomarker来源为DLBCL患者的FFPE肿瘤组织及细胞系基因组DNA;验证方法包括NGS测序(突变状态检测)、免疫组化(DE、COO分类)、Cox回归(预后关联)、ROC曲线(模型性能评估)。特异性与敏感性:基于CD79B、PIM1突变及LDH的预测模型,敏感性为55.10%(高风险组POD12患者占比),特异性为85.42%(低风险组非POD12患者占比),AUROC=0.771(95% CI 0.689~0.853),提示模型具有良好的预测性能。
核心成果与临床价值
- 预测价值:CD79B与PIM1突变是DLBCL早期进展(POD12)的独立预测因子,联合LDH的遗传模型预测POD12的性能优于传统IPI、MCD亚型等模型。高风险组(评分2~4分)患者POD12发生率是低风险组(0~1分)的3倍(65.85% vs 21.15%,p=0.000),且PFS、OS更短。
- 治疗指导:CD79B突变提示对BTK抑制剂ibrutinib更敏感(Val细胞凋亡率32.6% vs 野生型15.3%,n=3,p<0.01);PIM1突变提示对pan-PIM抑制剂AZD1208更敏感(OCI-Ly8细胞凋亡率38.1% vs 野生型18.7%,n=3,p<0.01)。
- 联合治疗策略:由于ibrutinib与AZD1208不影响BCL2表达,联合BCL2抑制剂venetoclax可显著增强凋亡效果(Val细胞凋亡率升至58.9%,OCI-Ly8升至62.3%,n=3,p<0.01),尤其适用于双表达(DE)患者(本研究中CD79B、PIM1突变患者中DE占比分别为63.3%、55.6%)。
本研究的Biomarker及预测模型为DLBCL早期进展的精准识别与治疗提供了重要工具,有望推动POD12患者的一线替代治疗从“经验性”转向“基于遗传特征的精准化”。
