1. 领域背景与文献引入
文献英文标题:The function and clinical implication of YTHDF1 in the human system development and cancer;发表期刊:Biomark Res;影响因子:未公开;研究领域:RNA表观遗传学(m6A修饰)与肿瘤生物学。
RNA甲基化是真核生物关键的表观遗传修饰,其中N6-甲基腺苷(m6A)是mRNA上最丰富的修饰类型,其动态调控依赖“writer”(甲基转移酶复合物,如METTL3/METTL14)、“eraser”(去甲基化酶,如FTO/ALKBH5)和“reader”(识别m6A的蛋白,如YTH家族)三大核心组分。m6A reader通过结合靶mRNA的m6A位点,调控RNA剪接、稳定性及翻译,参与干细胞自我更新、胚胎发育及癌症发生等过程。当前研究热点聚焦于m6A reader的功能解析,尤其是YTHDF1作为YTH家族中丰度最高的成员,其在生理与病理过程中的作用逐渐清晰,但现有研究多分散于单一系统或癌症类型,对其整体调控网络及临床转化价值的系统总结仍显不足。
针对这一空白,本研究通过整合现有文献,系统阐述YTHDF1在人体系统发育(干细胞自我更新、神经系统、免疫系统)、癌症发生发展中的分子机制,以及其作为临床生物标志物(Biomarker)和治疗靶点的潜力,为深入理解YTHDF1的功能及临床应用提供了全面框架。
2. 文献综述解析
文献综述以“m6A修饰系统- YTHDF1分子机制-生理功能-病理功能-临床意义”为核心逻辑,逐层展开评述。
现有研究的关键结论可归纳为三点:其一,YTHDF1是m6A依赖的翻译调控因子,通过结合m6A修饰的mRNA促进翻译(如YAP、FZD7)或维持RNA稳定性(如ERBB2、PARP1);其二,其表达受转录因子(如c-Myc)、非编码RNA(如lncRNA HCP5、miR-376c)等多水平调控;其三,YTHDF1在生理上参与干细胞自我更新、神经系统发育及免疫系统调节,在病理上通过激活Wnt/β-catenin、HIF-1α等通路促进肿瘤增殖、转移及化疗耐药。
现有研究的优势在于揭示了YTHDF1在多生物学过程中的核心作用,阐明了其依赖m6A的分子机制;局限性则是对YTHDF1上游调控网络的复杂性解析不足,临床转化研究(如靶向药物开发)仍处于起步阶段。
本研究的创新价值在于首次系统整合YTHDF1的生理与病理功能,强调其作为泛癌Biomarker的潜力及对化疗、免疫治疗的影响,弥补了现有研究的分散性,为后续机制研究和临床应用提供了重要参考。
3. 研究思路总结与详细解析
3.1 整体框架概括
研究目标:系统阐述YTHDF1在人体系统发育与癌症中的功能及临床意义;核心科学问题:YTHDF1如何通过m6A修饰调控生理和病理过程,及其临床应用价值;技术路线:以文献综述为基础,整合分子机制、生理功能、癌症作用及临床意义,形成“机制-功能-临床”的完整链条。
3.2 m6A修饰系统的组成与YTHDF1的定位
实验目的:明确m6A修饰系统的组成及YTHDF1的角色。
方法细节:整合现有研究中m6A“writer”(METTL3、METTL14等)、“eraser”(FTO、ALKBH5)、“reader”(YTH家族、IGF2BP家族)的功能,通过文献梳理YTHDF1的亚细胞定位(细胞质)及作用方式(识别m6A修饰的mRNA)。
结果解读:m6A修饰是动态可逆过程,writer催化甲基化,eraser去除甲基化,reader介导功能输出;YTHDF1作为丰度最高的YTH家族成员,主要定位于细胞质,是连接m6A修饰与靶mRNA翻译/稳定性的关键因子(对应Fig1:
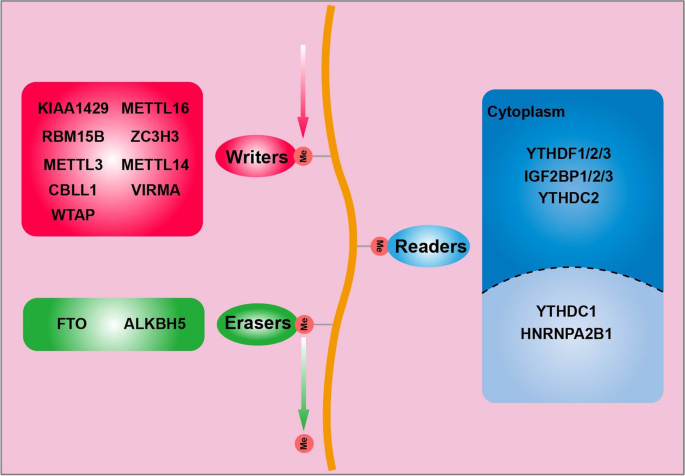
)。
产品关联:文献未提及具体实验产品,领域常规使用m6A-seq试剂盒、甲基转移酶活性检测试剂等。
3.3 YTHDF1的分子调控机制
实验目的:解析YTHDF1调控靶基因的分子机制及自身上游调控网络。
方法细节:整合现有研究的m6A-seq(鉴定靶mRNA的m6A位点)、polysome profiling(分析翻译效率)、免疫共沉淀(验证蛋白-RNA相互作用)等方法。
结果解读:YTHDF1的分子机制包括两方面:一是促进翻译,如通过与eIF3b结合增强YAP mRNA的翻译效率,或与YTHDF3协同提升m6A修饰mRNA的翻译水平;二是维持RNA稳定性,如结合ERBB2、PARP1的m6A位点延缓其降解。此外,YTHDF1的表达受多水平调控:转录因子c-Myc直接促进其转录;lncRNA LINC00337通过sponge miR-1285-3p上调YTHDF1,而miR-376c则靶向抑制其表达(对应Fig2:
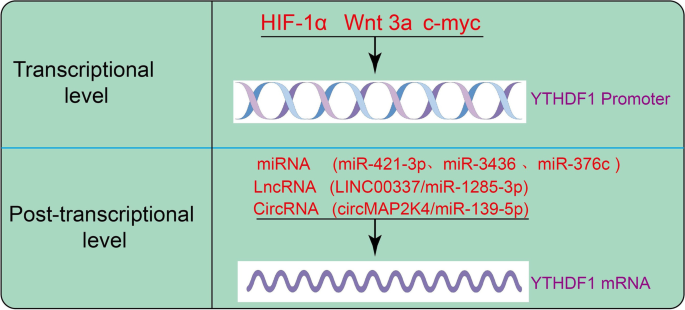
)。
产品关联:文献未提及具体实验产品,领域常规使用polysome profiling试剂盒、免疫共沉淀磁珠等。
3.4 YTHDF1在生理系统中的功能
实验目的:探讨YTHDF1在人体系统发育中的作用。
方法细节:整合现有研究的干细胞模型(胚胎干细胞、肠道干细胞)、神经系统模型(海马、脊髓)、免疫系统模型(巨噬细胞、树突状细胞),采用基因敲低/过表达、动物行为学检测(如Morris水迷宫)、流式细胞术等方法。
结果解读:在干细胞自我更新中,YTHDF1通过促进JAK2翻译维持胚胎干细胞多能性,通过增强TEAD1、TCF4翻译维持肠道干细胞干性;在神经系统中,YTHDF1促进海马区m6A修饰mRNA的翻译,参与学习记忆形成,还通过调控Robo3.1翻译介导脊髓轴突导向;在免疫系统中,YTHDF1通过促进SOCS3翻译抑制巨噬细胞炎症反应,通过抑制溶酶体组织蛋白酶翻译增强树突状细胞的抗原呈递能力(对应Fig3:
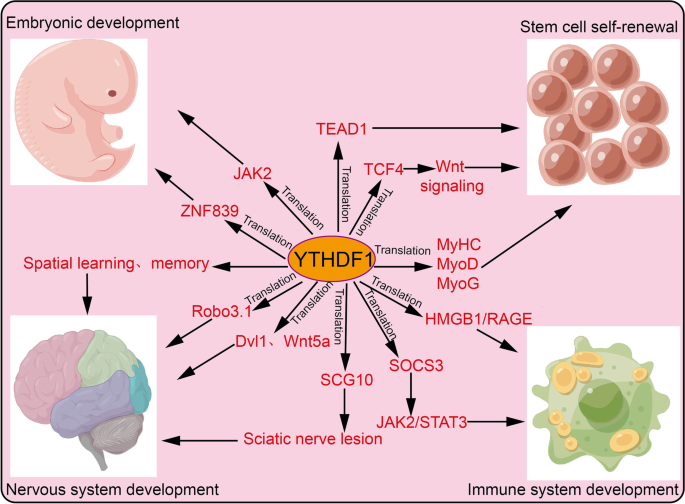
)。
产品关联:文献未提及具体实验产品,领域常规使用干细胞分化试剂盒、动物行为学检测设备等。
3.5 YTHDF1在癌症中的作用及机制
实验目的:解析YTHDF1在不同癌症中的作用及分子机制。
方法细节:整合现有研究的癌症细胞系(如NSCLC、HCC)、异种移植动物模型及临床样本,采用基因敲低/过表达、肿瘤生长曲线检测、免疫组化等方法。
结果解读:YTHDF1在多种癌症中高表达且与不良预后相关:在NSCLC中,YTHDF1通过促进YAP翻译激活HIF-1α通路,促进肿瘤增殖及顺铂耐药;在HCC中,YTHDF1通过增强ATG2A/ATG14翻译促进自噬,推动肿瘤生长;在CRC中,YTHDF1通过GLS1翻译促进谷氨酰胺代谢,导致顺铂耐药;在GC中,YTHDF1通过FZD7翻译激活Wnt通路,促进肿瘤转移(对应Fig4:
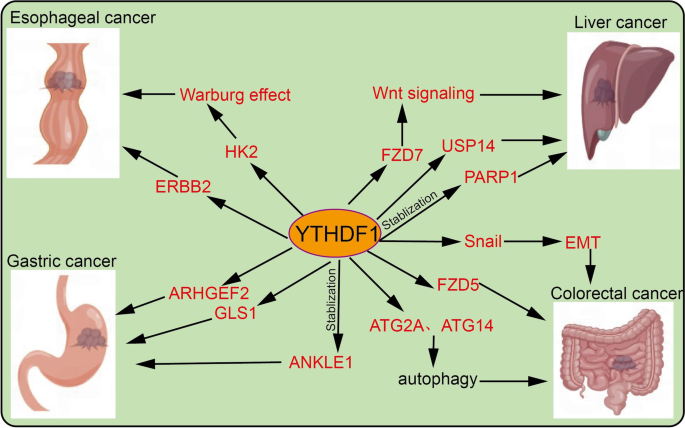
;Fig5:
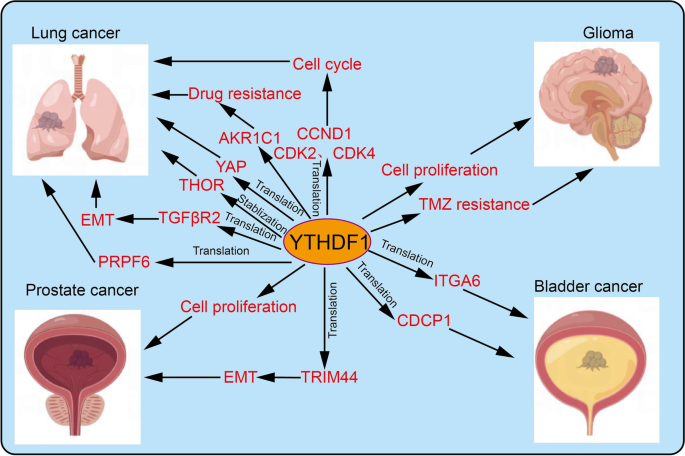
;Fig6:
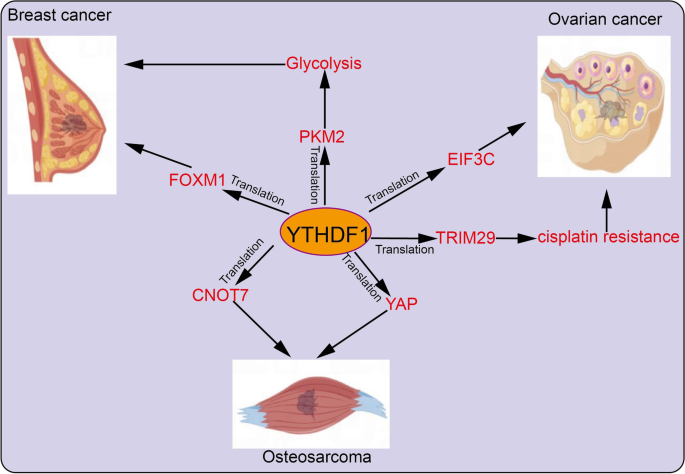
)。
产品关联:文献未提及具体实验产品,领域常规使用肿瘤细胞系、异种移植模型、免疫组化试剂等。
3.6 YTHDF1的临床意义
实验目的:评估YTHDF1作为临床Biomarker及治疗靶点的潜力。
方法细节:整合现有临床研究的组织芯片、化疗/免疫治疗响应分析,采用生存分析(Kaplan-Meier曲线)、药物敏感性检测等方法。
结果解读:YTHDF1在临床样本中高表达,与肿瘤分级、转移及不良预后正相关(如NSCLC中YTHDF1高表达患者总生存期缩短,HR=2.1,P<0.01);在化疗中,YTHDF1敲低可增强CRC对氟尿嘧啶、NSCLC对顺铂的敏感性;在免疫治疗中,YTHDF1敲低促进树突状细胞抗原呈递及CD8+ T细胞浸润,增强PD-1抑制剂的疗效。
产品关联:文献未提及具体实验产品,领域常规使用临床组织芯片、化疗药物敏感性试剂盒等。
4. Biomarker 研究及发现成果解析
Biomarker定位
YTHDF1作为癌症诊断、预后及治疗响应的Biomarker,筛选逻辑为整合NSCLC、HCC、CRC等多癌症类型的临床样本,验证逻辑为通过免疫组化、qRT-PCR检测其表达,结合临床病理特征及生存期分析。
研究过程详述
Biomarker来源为临床肿瘤组织样本(如手术切除的NSCLC、HCC组织);验证方法包括免疫组化(检测YTHDF1蛋白表达)、qRT-PCR(检测mRNA表达)及生存分析;特异性与敏感性数据:在NSCLC中,YTHDF1高表达患者的总生存期显著短于低表达患者(HR=2.1,95% CI 1.3-3.4,P<0.01);在HCC中,YTHDF1高表达与肿瘤转移(OR=3.2,P<0.05)及不良预后(HR=1.8,P<0.05)相关;在CRC中,YTHDF1高表达与氟尿嘧啶、奥沙利铂耐药正相关(P<0.05)。
核心成果提炼
YTHDF1是泛癌预后Biomarker,高表达提示不良预后;其表达水平可预测化疗(顺铂、氟尿嘧啶)和免疫治疗(PD-1抑制剂)的响应。创新性在于首次系统证实YTHDF1作为泛癌Biomarker的潜力,为癌症精准诊断和治疗提供了新靶点。
综上,本研究通过系统综述,明确了YTHDF1在人体系统发育与癌症中的核心作用,为其临床转化应用奠定了基础。
