1. 领域背景与文献引入
文献英文标题:High IL1R1 expression predicts poor survival and benefit from stem cell transplant in intermediate-risk acute myeloid leukemia from the Leucegene cohort;发表期刊:Biomark Res;影响因子:未公开;研究领域:急性髓系白血病(AML)生物标志物与治疗决策。
急性髓系白血病(AML)是一种异质性极强的造血系统恶性肿瘤,欧洲白血病网(ELN)风险分类是当前指导治疗的核心框架:不良风险患者推荐首次完全缓解(CR1)时行异基因造血干细胞移植(HSCT),良好风险患者通常采用巩固化疗;但中间风险细胞遗传学(IRC)患者的HSCT决策存在显著争议——一方面,Meta分析显示HSCT可能改善OS,但唯一的随机对照研究(ETAL-1)发现HSCT仅降低复发率,未显著改善总生存(OS);另一方面,IRC患者中约60%无FLT3-ITD突变(这类患者是HSCT的明确受益人群),尤其是NPM1+/FLT3-ITD-或无关键突变的患者,缺乏生物标志物指导HSCT:NPM1+/FLT3-ITD-患者虽被归为良好风险,但仍有50%复发却未被推荐HSCT;无NPM1、FLT3-ITD、bZIP CEBPA突变的患者(约占IRC的25%),临床决策完全依赖医生经验。
针对这一未满足需求,本研究通过分析Leucegene队列的转录组数据,旨在寻找能精准预测IRC AML患者HSCT受益的基因表达生物标志物,为这类患者的个性化治疗决策提供依据。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“IRC AML患者HSCT决策的不确定性”与“现有生物标志物的局限性”展开:
- HSCT受益的争议:部分Meta分析支持HSCT改善IRC患者OS,但ETAL-1研究显示HSCT仅降低复发率(CIR),未改善OS;
- 现有生物标志物的局限:FLT3-ITD突变仅覆盖40%的IRC患者,NPM1+/FLT3-ITD-患者(约30%)仍有高复发风险却未被推荐HSCT;无关键突变的患者(约25%)缺乏任何生物标志物指导;
- MRD的不足:可测量残留病(MRD)虽能预测复发,但需化疗后检测,且技术标准不统一,无法在诊断时指导治疗决策。
作者指出,现有研究的核心缺口是“缺乏诊断时可检测、能预测HSCT受益的生物标志物”。本研究的创新点在于:首次通过大样本队列的转录组分析,系统筛选能预测IRC AML患者HSCT受益的基因表达标志物,并验证其临床 utility。
3. 研究思路总结与详细解析
3.1 队列选择与数据收集
实验目的:获取IRC AML患者的转录组数据与临床随访数据,为生物标志物筛选提供基础。
方法细节:纳入Leucegene队列中316例IRC AML患者(符合ELN 2022中间风险细胞遗传学标准),收集患者诊断时的骨髓/外周血样本转录组数据(RNA-seq,Illumina HiSeq 2000/NovaSeq 6000)、临床数据(年龄、白细胞计数、治疗方案、HSCT时间、OS/RFS等)、分子数据(FLT3-ITD、NPM1、CEBPA等基因突变状态)。
结果解读:队列患者中位年龄57岁,81%(255/316)达到CR1,21%(66/316)接受CR1期HSCT;常见突变包括NPM1(59%)、FLT3-ITD(41%)、DNMT3A(41%)。
3.2 生物标志物筛选与 cutoff确定
实验目的:筛选与IRC AML患者OS/RFS相关、且能预测HSCT受益的基因表达标志物,并确定最优 cutoff值。
方法细节:① 采用Cox比例风险(CPH)模型,分析27740个基因的连续表达水平与OS、复发-free生存(RFS)的关联(调整年龄、白细胞计数、关键基因突变等协变量);② 通过交互作用分析,评估基因表达与HSCT(时间依赖变量,HSCT-TD)的相互作用;③ 采用Youden指数(ROC曲线)、多 cutoff值(10th-90th百分位数)的预后/预测影响分析,确定IL1R1的最优 cutoff。
结果解读:① IL1R1是与OS/RFS关联最显著的基因(单变量HR for OS=2.27,P<0.01;多变量HR=1.78,P<0.01),且与HSCT-TD存在显著交互作用(连续变量OS P<0.01,二分类变量OS P=0.02);② 最优 cutoff值为2.0 TPM(61st百分位数),对应预测3年OS的特异性82.5%、敏感性49.4%(Youden指数=0.319),且在所有测试的cutoff中保持稳定的预后和预测价值。
3.3 临床特征与分子谱关联分析
实验目的:分析IL1R1high(≥2.0 TPM)患者的临床与分子特征,明确其生物学意义。
方法细节:将患者分为IL1R1high(n=123,39%)与IL1R1low(n=193,61%)两组,比较两组的年龄、AML分化类型(髓单核/单核细胞分化比例)、基因突变频率。
结果解读:① IL1R1high患者年龄更大(中位年龄60岁 vs 55岁,P<0.01),更易出现髓单核/单核细胞分化(43% vs 25%,P<0.01);② 分子谱上,IL1R1high与FLT3-ITD(47% vs 37%,P=0.04)、RUNX1突变(22% vs 12%,P=0.02)正相关,与IDH1/2(13% vs 24%,P=0.01)、bZIP CEBPA突变(3% vs 11%,P=0.01)负相关;NPM1突变频率无差异(59% vs 59%,P=1.00)。
3.4 预后价值验证
实验目的:验证IL1R1表达作为IRC AML患者独立预后因素的价值。
方法细节:① 单变量分析:Kaplan-Meier法比较IL1R1high与IL1R1low的OS、RFS、累积复发率(CIR);② 多变量分析:CPH模型调整年龄、白细胞计数、关键基因突变等协变量;③ 分层分析:按FLT3-ITD有无、NPM1突变状态、年龄分层,验证IL1R1的预后一致性。
结果解读:① 单变量:IL1R1high患者的5年OS(10% vs 38%,P<0.01)、5年RFS(12% vs 31%,P<0.01)显著更低,5年CIR(76% vs 59%,P<0.01)显著更高;② 多变量:IL1R1high仍是OS(HR=1.78,95%CI 1.32-2.40,P<0.01)、RFS(HR=1.77,95%CI 1.31-2.39,P<0.01)的独立预后因素;③ 分层分析:IL1R1high的不良预后在FLT3-ITD+(3年OS 5% vs 35%,P<0.01)、FLT3-ITD-(3年OS 26% vs 49%,P<0.01)、NPM1+(3年OS 28% vs 51%,P<0.01)亚组中均一致。
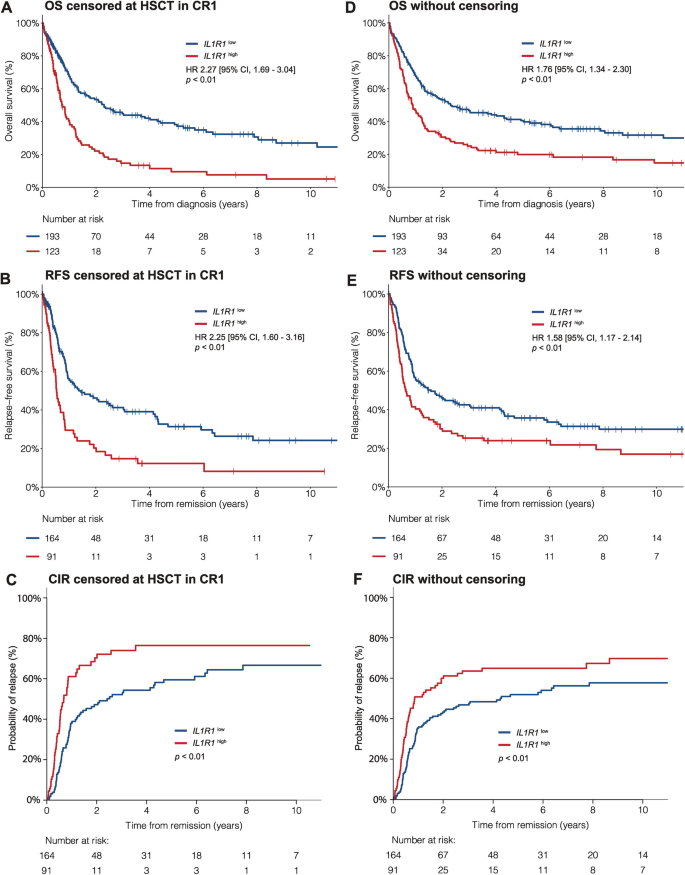
(图1:IL1R1表达与OS、RFS、CIR的关联,红色线为IL1R1high,蓝色为IL1R1low)
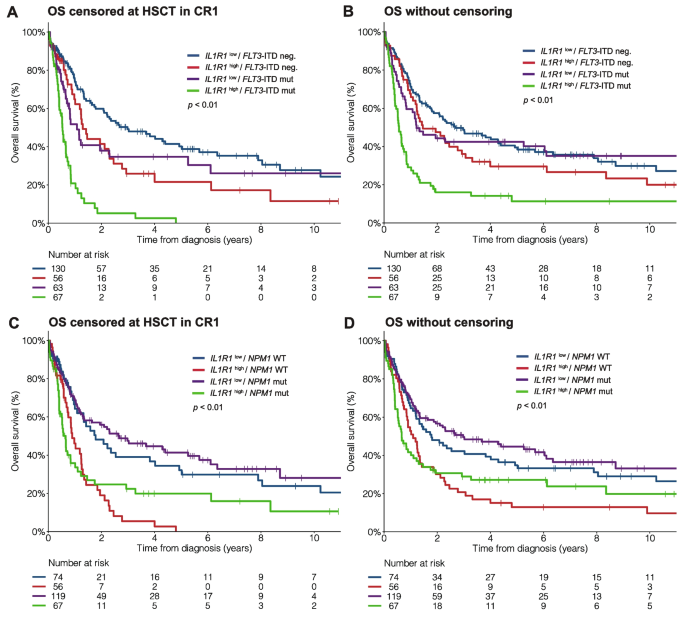
(图2:FLT3-ITD有无亚组中,IL1R1表达与OS的关联)
3.5 HSCT受益预测分析
实验目的:验证IL1R1表达对IRC AML患者CR1期HSCT受益的预测价值。
方法细节:① 交互作用分析:评估IL1R1表达与HSCT-TD的相互作用;② 分层分析:比较IL1R1high与IL1R1low患者中,HSCT对OS/RFS的影响;③ Landmark分析:以诊断后6个月为时间点(排除未达CR1的患者),比较HSCT与非HSCT患者的5年OS;④ 亚组分析:按FLT3-ITD有无、NPM1突变状态分层,验证IL1R1的预测作用。
结果解读:① 交互作用显著:IL1R1连续表达与HSCT-TD的OS交互作用P<0.01,二分类表达P=0.02;② IL1R1high患者中,HSCT显著改善OS(HR=0.26,95%CI 0.14-0.48,P<0.01)、RFS(HR=0.32,95%CI 0.18-0.56,P<0.01);IL1R1low患者中,HSCT无显著受益(OS HR=0.70,P=0.17;RFS HR=0.75,P=0.25);③ Landmark分析:IL1R1high患者中,HSCT组5年OS为67%,显著高于非HSCT组的27%(HR=0.33,P<0.01);IL1R1low患者中,HSCT组与非HSCT组5年OS无差异(62% vs 54%,HR=0.72,P=0.31);④ 亚组分析:FLT3-ITD-患者中,IL1R1high患者HSCT的5年OS为65%,显著高于非HSCT的42%(HR=0.45,P=0.13);其中NPM1-患者的受益更显著(HR=0.26,P=0.04)。
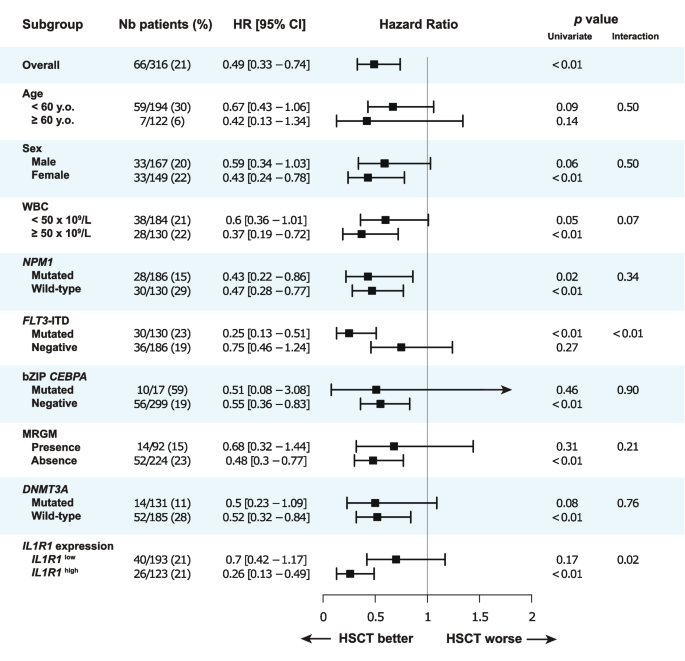
(图3:HSCT受益的森林图,显示IL1R1high患者显著受益)
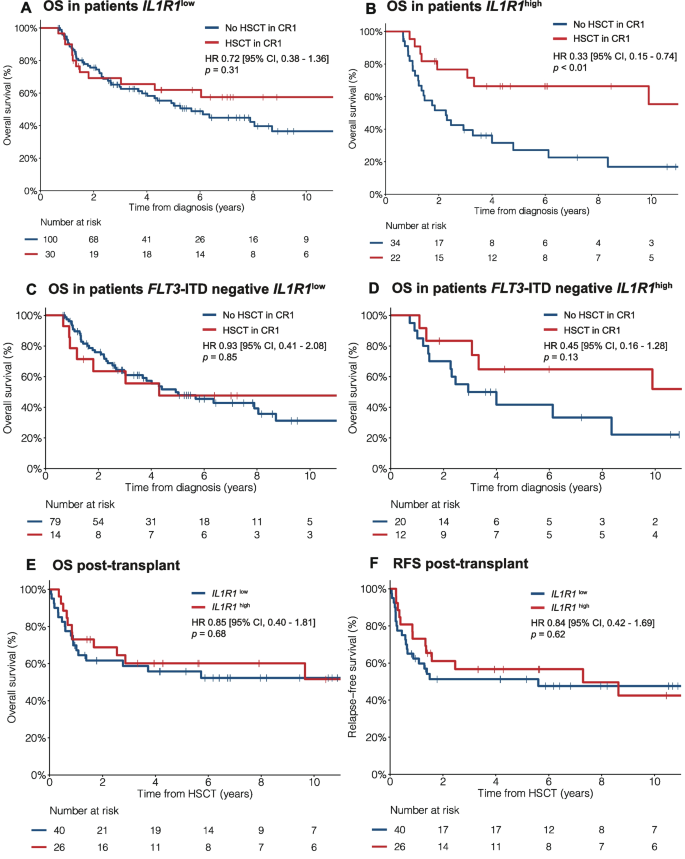
(图4:Landmark分析的OS结果,IL1R1high患者HSCT受益显著)
3.6 机制探索
实验目的:探索IL1R1high患者不良预后与HSCT受益的分子机制。
方法细节:① 差异基因表达分析(DESeq2):比较IL1R1high与IL1R1low患者的基因表达谱;② 基因集富集分析(GSEA):分析IL1R1high患者富集的hallmark基因集;③ 单细胞RNA-seq:分析22例AML患者样本(含2例IL1R1high)与正常骨髓的IL1R1表达细胞类型。
结果解读:① 差异基因:IL1R1high患者显著高表达单核细胞/树突细胞分化相关基因(如MRC1、SIGLEC1、CLEC10A),低表达髓系分化基因;② GSEA:IL1R1high患者富集“炎症反应”“凝血”“上皮间质转化”等hallmark基因集(炎症反应为top5);③ 单细胞分析:正常骨髓中IL1R1主要表达在CD14+单核细胞、常规树突细胞2(cDC2);AML样本中,IL1R1有两种表达模式——在16H148样本中,IL1R1主要表达在未成熟CD34+原始细胞(与DNTT、CD34等干细胞标志物正相关);在11H097样本中,IL1R1主要表达在cDC2(与MRC1、CLEC10A正相关)。
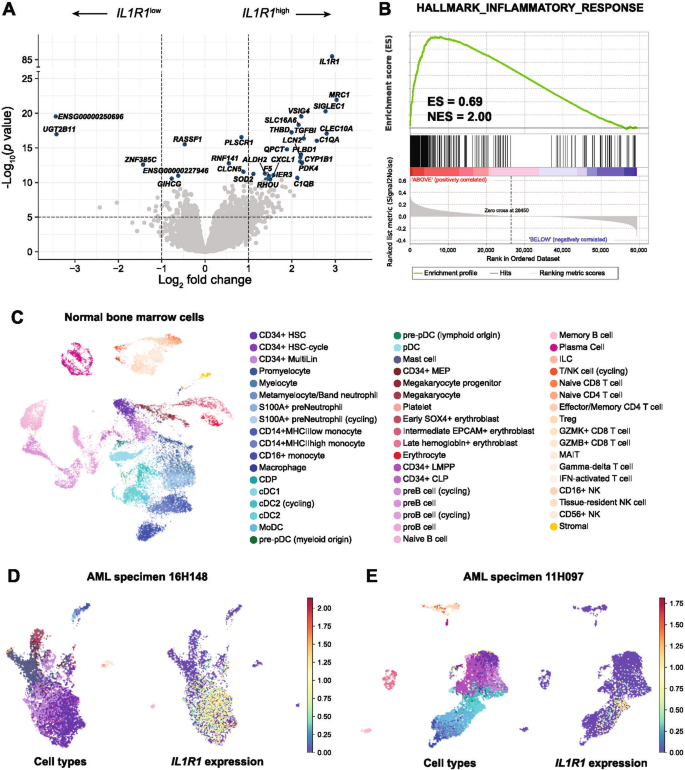
(图6:差异基因火山图、GSEA、单细胞分析结果)
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究的Biomarker是“IL1R1高表达(IL1R1high,≥2.0 TPM)”,类型为基因表达标志物(转录组水平)。筛选与验证逻辑为:
1. 队列筛选:Leucegene队列的316例IRC AML患者,覆盖临床、分子、转录组数据;
2. 初步筛选:CPH模型关联基因表达与OS/RFS,交互作用分析关联基因表达与HSCT受益,筛选出IL1R1;
3. cutoff确定:通过Youden指数、ROC曲线、多 cutoff验证,确定2.0 TPM为最优阈值;
4. 临床验证:单/多变量分析验证独立预后价值,分层分析验证亚组一致性;
5. 机制验证:差异基因、GSEA、单细胞分析揭示生物学意义;
6. 转化验证:开发RT-qPCR检测方法,验证与RNA-seq的相关性及临床 utility。
4.2 研究过程详述
- Biomarker来源:患者诊断时的骨髓/外周血样本的转录组数据(RNA-seq);
- 验证方法:① 预后验证:Kaplan-Meier法、CPH模型(调整协变量);② 预测验证:交互作用分析、Landmark分析、亚组分析;③ 转化验证:RT-qPCR检测(设计特异性引物,检测260例患者样本,与RNA-seq结果比较);
- 特异性与敏感性:IL1R1high预测3年OS的特异性为82.5%,敏感性为49.4%(cutoff=2.0 TPM,n=316);RT-qPCR检测的NCN cutoff为1354(61st百分位数),与RNA-seq的相关性r=0.90(P<2.2e-16)。
4.3 核心成果提炼
- 独立预后价值:IL1R1high是IRC AML患者的独立不良预后因素,调整协变量后的OS HR=1.78(95%CI 1.32-2.40,P<0.01),RFS HR=1.77(95%CI 1.31-2.39,P<0.01);
- HSCT受益预测:IL1R1high能精准预测IRC患者的HSCT受益——IL1R1high患者HSCT后的5年OS为67%,显著高于非HSCT的27%(HR=0.33,P<0.01);尤其是FLT3-ITD-患者,IL1R1high患者HSCT的5年OS为65%(vs 非HSCT的42%,HR=0.45);
- 临床 utility:IL1R1表达可修改23%患者的HSCT决策——7%的NPM1+/FLT3-ITD-患者(通常不推荐HSCT)因IL1R1high应推荐HSCT,16%的无关键突变患者(通常推荐HSCT)因IL1R1low应避免HSCT;
- 转化价值:开发的RT-qPCR检测方法简便、低成本,与RNA-seq高度相关(r=0.90),可用于临床推广。
本研究首次揭示IL1R1高表达是IRC AML患者的预后与HSCT受益预测标志物,为这类患者的个性化治疗决策提供了关键依据,也为AML的生物标志物研究提供了新的思路。
