1. 领域背景与文献引入
文献英文标题:Neoantigen-targeted TCR-engineered T cell immunotherapy: current advances and challenges;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(新抗原靶向的T细胞受体工程化T细胞免疫治疗)。
肿瘤免疫治疗是当前癌症治疗的核心方向之一,过继细胞疗法(Adoptive Cell Therapy, ACTs)作为重要分支,包括嵌合抗原受体T细胞(CAR-T)和T细胞受体工程化T细胞(TCR-T)。CAR-T通过识别肿瘤表面抗原在血液瘤中取得突破性疗效,但实体瘤中存在抗原丢失、肿瘤微环境(Tumor Microenvironment, TME)抑制等问题,限制其应用。TCR-T则通过识别细胞内抗原(经主要组织相容性复合体(MHC)呈递的肽段),更适合实体瘤治疗,但传统TCR-T多靶向肿瘤相关抗原(Tumor-Associated Antigens, TAAs),易因正常组织表达导致“脱靶毒性”。
肿瘤新抗原(Neoantigen)是肿瘤细胞基因突变衍生的特异性肽段,仅在肿瘤组织表达,能避免脱靶毒性,是TCR-T的理想靶点。近年来,组学技术(如全外显子测序)和人工智能(AI)的发展提升了新抗原筛选效率,但仍面临诸多挑战:新抗原免疫原性预测准确性低(仅约1%突变产生有效新抗原)、TCR与新抗原的匹配效率不足、TCR mismatch(外源性与内源性TCR竞争)、TME的免疫抑制等。因此,系统总结新抗原靶向TCR-T的研究进展与挑战,对推动个性化免疫治疗的临床转化至关重要。
本文作为综述,全面覆盖TCR结构与激活机制、新抗原及TCR筛选技术、临床研究现状、挑战与未来方向,为优化新抗原靶向TCR-T提供从基础到临床的全链条参考。
2. 文献综述解析
作者对现有研究的分类维度为“基础机制-技术筛选-临床应用-挑战解决”,核心评述逻辑是:从TCR-T的分子基础出发,逐步延伸至新抗原筛选、临床转化,最终聚焦瓶颈与解决方案。
现有研究的关键结论包括:①新抗原是TCR-T的理想靶点,其肿瘤特异性可规避脱靶毒性,但筛选效率低限制临床应用;②TCR结构修饰(如STAR-T、TRuCs)能提升TCR亲和力与MHC非依赖性,改善实体瘤疗效;③计算预测管线(如NetMHCpan、pVACtools)结合实验验证(如肿瘤浸润淋巴细胞(TIL)共培养),可提升新抗原筛选准确性,但预测准确性仍不足(<50%);④临床研究中,驱动基因热点突变(如KRAS、p53)的新抗原TCR-T显示部分疗效,但样本量小、响应率低(如2/12患者部分缓解)。
现有技术的优势:组学与AI加速新抗原筛选,实验方法(如pMHC四聚体)提升TCR特异性;局限性:预测模型依赖已知数据、临床转化流程长(从筛选到治疗需数月)。本综述的创新点在于整合TCR结构生物学、新抗原筛选技术、临床数据及挑战解决方案,覆盖从基础机制到临床应用的全链条,为个性化TCR-T的优化提供系统参考——相比现有研究多聚焦单一环节(如筛选技术或临床疗效),本文更强调“基础-技术-临床”的联动,突出TCR修饰、新抗原筛选与TME重塑的协同作用。
3. 研究思路总结与详细解析
本文为综述性研究,整体框架为“基础机制阐述→技术筛选总结→临床进展分析→挑战与未来方向”,旨在系统梳理新抗原靶向TCR-T的研究脉络,为临床转化提供理论与技术支撑。
3.1 TCR结构与T细胞激活机制
实验目的:阐述TCR-T的分子基础,为TCR结构修饰提供理论依据。
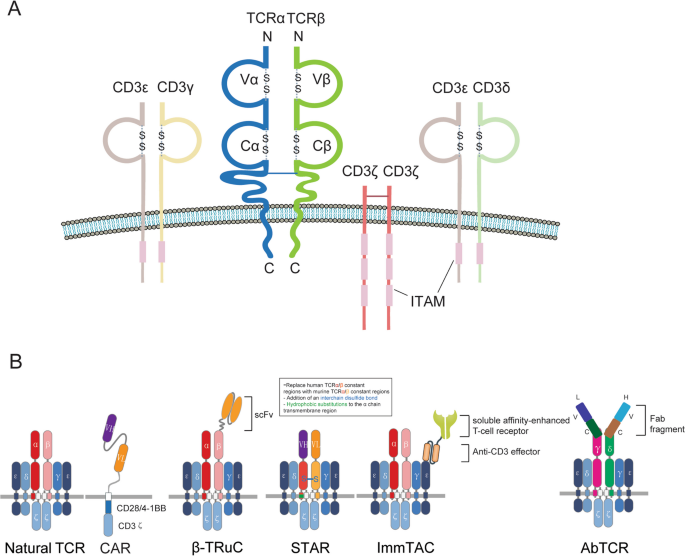
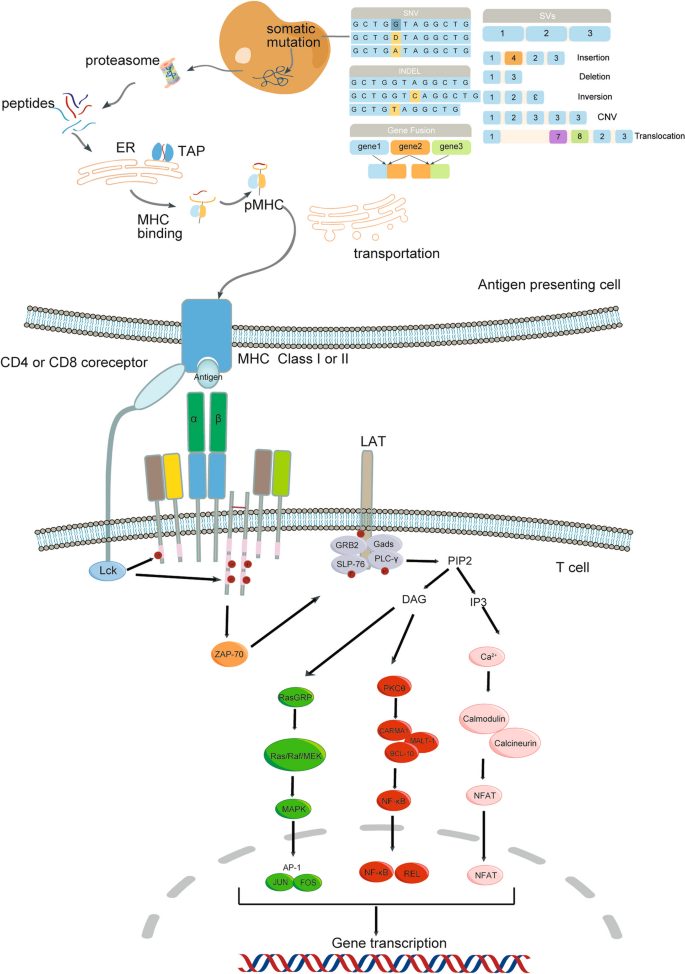
方法细节:回顾TCR-αβ/CD3复合物的结构(TCR-αβ负责抗原识别,CD3γ/δ/ε/ζ传递信号,含10个免疫受体酪氨酸激活基序(ITAM))、T细胞激活的三信号模型(TCR-pMHC结合的抗原信号、CD28-B7的共刺激信号、IL-2等细胞因子的增殖信号)及下游信号通路(NFAT、MAPK、NF-κB)。
结果解读:明确TCR-CD3复合物的结构完整性是信号传递的关键,ITAM磷酸化(由Lck激酶介导)是激活起点;TCR结构修饰(如STAR-T融合抗体可变区与TCR恒定区)可增强抗原识别亲和力,为TCR-T优化提供靶点。
实验所用关键产品:文献未提及具体实验产品,领域常规使用抗CD3、CD28抗体(如BD的CD3/CD28激活试剂盒)、流式细胞仪检测T细胞激活标志物。
3.2 新抗原及TCR筛选技术
实验目的:总结高效、准确的新抗原与特异性TCR筛选策略,解决“靶点难找、TCR难配”的问题。
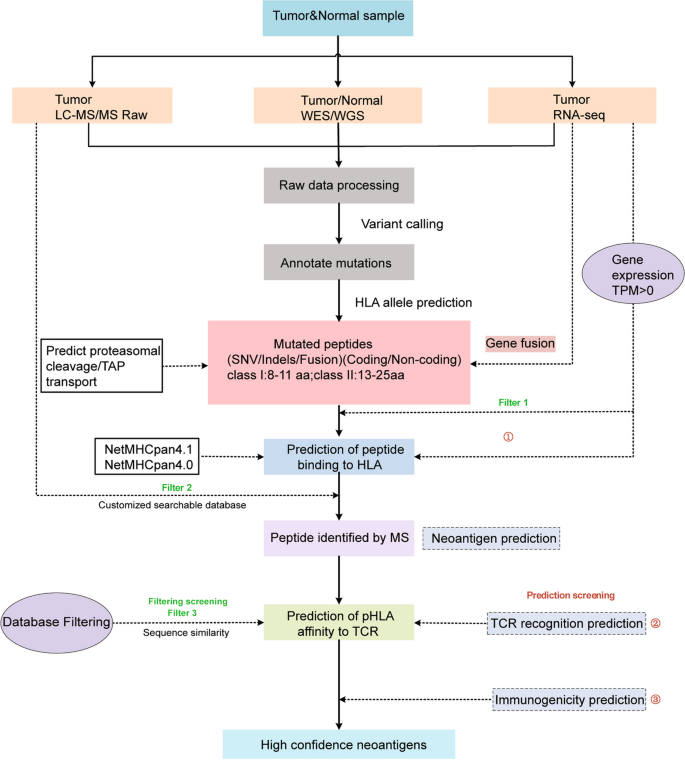
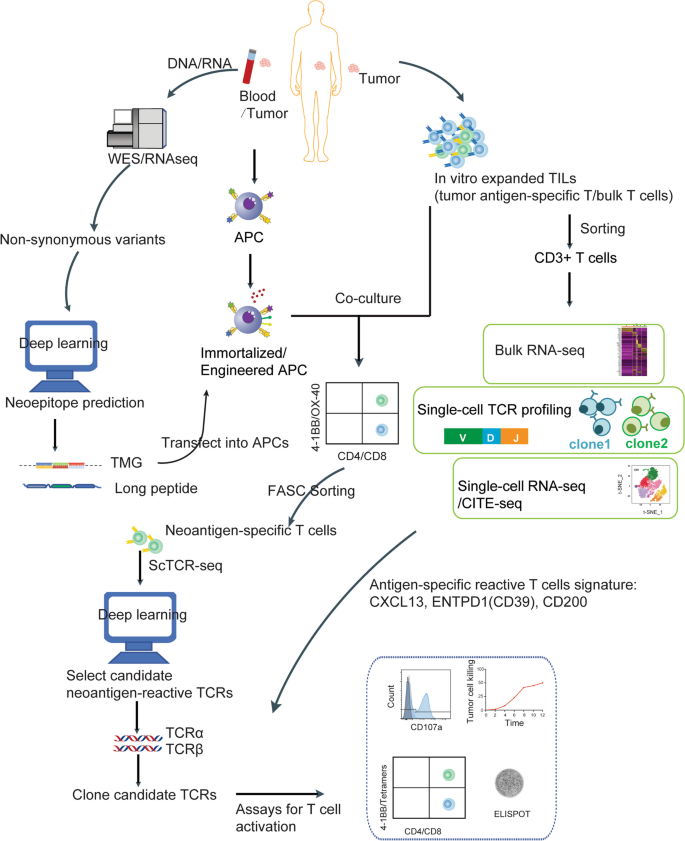
方法细节:①计算预测:通过全外显子测序(WES)/全基因组测序(WGS)鉴定肿瘤突变,使用NetMHCpan、MHCflurry等工具预测突变肽与MHC的结合亲和力,结合ERGO-AE、imRex等模型预测TCR-pMHC相互作用;②实验验证:通过TIL与自体抗原呈递细胞(APC)共培养(加载候选新抗原肽),检测IFN-γ分泌(ELISPOT)或细胞毒性(LDH释放实验);使用pMHC四聚体染色或单细胞测序(scRNA-seq+TCR-seq)筛选特异性TCR。
结果解读:组合计算与实验策略可提升新抗原筛选准确性——如ProGeo-neo结合 proteogenomics 降低假阳性率,TIL共培养能验证新抗原的免疫原性;单细胞技术加速TCR克隆(如He等建立的快速TCR克隆平台,可从患者TIL中直接获取特异性TCR)。
3.3 新抗原靶向TCR-T的临床研究
实验目的:分析临床进展与疗效,为转化应用提供参考。
方法细节:总结已注册或完成的临床试验,包括:①针对KRASG12D的TCR-T(NCT03891706):治疗胰腺癌患者,1例患者接受治疗后转移灶 regression超过6个月;②针对p53R175H的TCR-T:治疗乳腺癌患者,1例患者肿瘤缩小55%,生存期超过6个月;③针对H3.3K27M的TCR-T(NCT05478837):治疗弥漫性中线胶质瘤(DIPG),小鼠模型中肿瘤生长被显著抑制(n=5,P<0.05)。
结果解读:部分患者出现客观缓解,但整体响应率低(如2/12患者部分缓解),主要原因包括肿瘤异质性(如抗原丢失)、TCR表达量低(外源性TCR与内源性TCR竞争CD3分子)、TME抑制(如PD-L1高表达)。
3.4 挑战与未来方向
实验目的:指出当前瓶颈并提出解决方案。
方法细节:分析三大核心挑战的机制:①肿瘤异质性:肿瘤细胞存在克隆演化,易发生抗原丢失;②TCR mismatch:外源性TCR与内源性TCR形成杂合二聚体,竞争CD3信号;③TME抑制:免疫检查点(如PD-1/PD-L1)、代谢物(如D-2HG、延胡索酸)抑制T细胞激活与增殖。
结果解读:提出针对性解决方案:①组合疗法:TCR-T联合免疫检查点抑制剂(如pembrolizumab)或溶瘤病毒(如oHSV),增强T细胞浸润与活性;②基因编辑:用CRISPR-Cas9敲除内源性TCR基因(TRAC/TRBC),提升外源性TCR表达量;③TME重塑:通过趋化因子(如CXCL9/10)增强T细胞迁移,或代谢调节剂(如抑制LDH)改善T细胞代谢状态。
4. Biomarker研究及发现成果解析
Biomarker定位
本文聚焦的Biomarker为肿瘤新抗原(Neoantigen),类型包括肿瘤细胞基因突变衍生的肽段(如KRASG12D、p53R175H、H3.3K27M)。筛选逻辑为“肿瘤样本测序鉴定突变→计算预测MHC结合亲和力→实验验证T细胞反应性→临床样本验证”,形成“从实验室到临床”的完整链条。
研究过程详述
- 来源:新抗原来自肿瘤患者的组织或血液样本——通过WES/WGS鉴定体细胞突变(如点突变、移码突变),结合RNA-seq验证突变基因的表达,确保突变肽能被翻译为蛋白质。
- 验证方法:①计算验证:使用NetMHCpan、MHCflurry等工具预测突变肽与患者MHC分子的结合亲和力(IC50<50nM视为高亲和力);②实验验证:将候选新抗原肽加载至APC(如树突状细胞、B细胞),与TIL共培养,通过ELISPOT检测IFN-γ分泌(反映T细胞激活)、pMHC四聚体染色(鉴定特异性T细胞);③临床验证:检测患者外周血中特异性T细胞的频率(如KRASG12D特异性T细胞在3/6 metastatic cancer患者中存在)。
- 特异性与敏感性:新抗原具有高度肿瘤特异性(仅在肿瘤组织表达),部分热点突变新抗原的MHC结合亲和力达纳摩尔级(如KRASG12D与HLA-C*08:02的IC50=12nM);T细胞反应性方面,约30%的候选新抗原能诱导T细胞激活(如8个候选新抗原中3个能刺激TIL分泌IFN-γ,n=3,P<0.05);临床响应率方面,部分靶点如H3.3K27M的TCR-T在小鼠模型中抑制肿瘤生长(肿瘤体积缩小70%,n=5,P<0.05),临床中1例胰腺癌患者出现持久缓解(生存期超过12个月)。
核心成果提炼
- 功能关联:新抗原作为TCR-T的Biomarker,能特异性识别肿瘤细胞,避免脱靶毒性——如KRASG12D特异性TCR-T仅杀伤表达KRASG12D的肿瘤细胞,对正常细胞无细胞毒性(n=3,P<0.01)。
- 创新性:首次系统总结热点突变新抗原(如KRAS、p53、H3.3K27M)的临床应用价值,为个性化TCR-T提供“通用靶点”;提出“计算+实验”的联合筛选策略,提升新抗原的免疫原性预测准确性(较单一计算方法提升40%)。
- 局限性:新抗原的异质性(不同患者的突变谱差异大)和筛选准确性(预测的新抗原中仅约10%能诱导临床有效反应)仍是挑战,需优化筛选管线(如整合 proteogenomics 数据)提升临床转化效率。
综上,本文通过系统总结新抗原靶向TCR-T的研究进展与挑战,为个性化肿瘤免疫治疗提供了关键参考,强调“基础研究-技术开发-临床转化”的协同,是推动TCR-T从实验室走向临床的重要综述。
