1. 领域背景与文献引入
文献英文标题:A new method for maturity-dependent fractionation of neutrophil progenitors applicable for the study of myelodysplastic syndromes;发表期刊:Biomarker Research;影响因子:未公开;研究领域:骨髓增生异常综合征(MDS)的粒细胞分化分子机制研究。
骨髓增生异常综合征(MDS)是造血干细胞克隆性疾病,以外周血细胞减少及髓系细胞发育异常为核心特征,其发病与造血细胞分化缺陷密切相关,但缺陷分化的分子基础尚未完全明确。传统研究中,缺乏能精细分馏中性粒细胞祖细胞连续成熟阶段的方法,是解析MDS粒细胞生成基因表达动态的关键障碍——既往研究要么仅分析造血干细胞(CD34⁺)组分(无法反映后续成熟阶段变化),要么采用密度梯度离心将细胞分为3个粗糙组分(如中间密度组分包含F2、F3、F4等多个成熟阶段),难以捕捉调控基因的时间特异性表达异常。因此,建立精细分馏方法以解析MDS分化缺陷的分子机制,成为领域亟待解决的问题。
本研究针对这一需求,应用作者团队新建立的中性粒细胞祖细胞成熟度依赖性分馏方法(将骨髓来源的中性粒细胞祖细胞分为6个连续成熟阶段),对6例低危MDS患者的骨髓样本进行分析,旨在检测粒细胞生成调控基因(AML1、C/EBP-ε、EVI1)的表达谱是否存在时间异常,为MDS的分化缺陷机制提供新视角。
2. 文献综述解析
文献综述的核心评述逻辑:作者首先锚定MDS的核心科学问题(分化缺陷的分子基础不明),随后系统评述传统研究的局限性——无法精细区分中性粒细胞祖细胞的连续成熟阶段。现有研究中,Scott等(2010)明确MDS是造血干细胞克隆病,但未深入分化机制;Li等(2007)提出分化缺陷是病因,但缺乏分子证据;Miyazato等(2001)、Sridhar等(2009)仅分析CD34⁺细胞,无法反映成熟阶段的基因变化;Bjerregaard等(2003)采用三组分分馏,无法区分F2-F4等连续阶段。
本研究的创新在于,应用作者团队新建立的6阶段分馏方法(能精细区分中性粒细胞祖细胞的连续成熟阶段),突破传统方法的局限,实现对MDS患者粒细胞生成过程中调控基因的时间特异性表达分析。
3. 研究思路总结与详细解析
整体框架概括:研究目标是验证新分馏方法在MDS研究中的适用性,核心科学问题是MDS患者粒细胞生成调控基因的表达是否存在时间异常,技术路线为“骨髓样本采集→密度梯度离心→免疫标记排除非中性粒细胞系→流式分选6个成熟阶段→qRT-PCR检测基因表达→对比健康人与MDS患者的基因峰位”。
3.1 骨髓样本采集与预处理
实验目的:获取低危MDS患者的骨髓样本并预处理。方法细节:纳入6例低危MDS患者,采集肝素化骨髓血,所有患者签署知情同意书(符合伦理要求)。结果解读:成功获取符合实验要求的骨髓样本,未出现样本质量问题。实验所用关键产品:文献未提及具体实验产品,领域常规使用肝素抗凝管采集骨髓样本。
3.2 密度梯度离心分馏细胞
实验目的:通过密度差异分离骨髓细胞为不同成熟阶段的粗组分。方法细节:将肝素化骨髓血分为低密度(<1.065 g/mL)、中间密度(1.065-1.080 g/mL)、高密度(>1.080 g/mL)三个群体,计算细胞回收率(73.7±12.4%)。结果解读:回收率与健康人骨髓样本的结果一致(参考文献3),说明密度梯度离心方法稳定,可重复用于MDS样本。实验所用关键产品:文献未提及具体实验产品,领域常规使用Percoll或Ficoll密度梯度介质。
3.3 免疫标记与流式分选
实验目的:排除非中性粒细胞系细胞,分选得到6个连续成熟阶段的中性粒细胞祖细胞组分。方法细节:用CD2、CD3、CD14、CD19、CD56、CD61、血型糖蛋白A、CD49d抗体标记T细胞、B细胞、单核细胞等非中性粒细胞系细胞,通过流式细胞术分选去除;对剩余细胞,根据密度与表面标志物组合(CD34、CD11b、CD16)分选得到6个组分:低密度CD34⁺(F1,早期祖细胞)、中间密度CD11b⁻/CD16⁻(F2,早幼粒细胞)、CD11b⁺/CD16⁻(F3,中幼粒细胞)、CD11b⁺/CD16low(F4,晚幼粒细胞)、高密度CD11b⁺/CD16int(F5,杆状核粒细胞)、CD11b⁺/CD16high(F6,分叶核粒细胞)。结果解读:分选得到的6个组分与健康人骨髓中性粒细胞祖细胞的形态学成熟阶段一致(Table 2),说明分馏方法能准确区分连续成熟阶段。实验所用关键产品:文献未提及具体抗体品牌,领域常规使用BD或eBioscience的流式抗体。
3.4 基因表达检测与分析
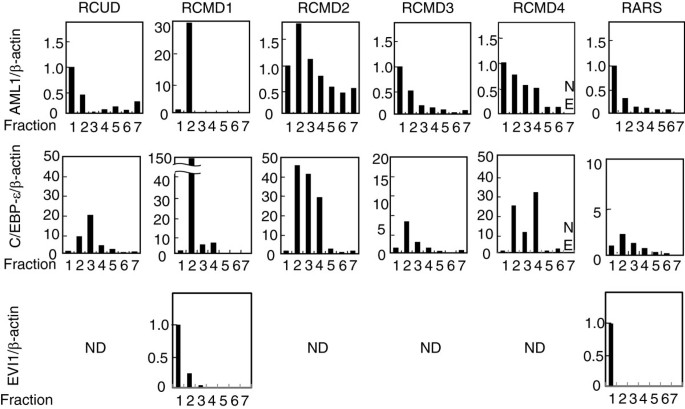
实验目的:检测各成熟阶段组分中粒细胞生成调控基因的mRNA表达谱。方法细节:提取各组分总RNA,通过qRT-PCR检测AML1、C/EBP-ε、EVI1 mRNA的相对表达量(以β-actin为内参,F1的表达量设为1.0)。结果解读:健康人样本中,AML1在F1(早期祖细胞)达峰,C/EBP-ε在F4(晚幼粒细胞)达峰;而MDS患者中,所有患者的C/EBP-ε在F2/F3(早幼/中幼粒细胞)达峰,2例患者的AML1在F2达峰,EVI1在这2例患者的F2中显著下降或未检测到。结果表明,MDS患者中调控基因的表达峰位存在时间异常。
实验所用关键产品:文献未提及具体实验产品,领域常规使用TaKaRa或Qiagen的qRT-PCR试剂盒。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究的Biomarker为粒细胞生成调控基因(AML1、C/EBP-ε、EVI1)的表达峰位(时间特异性Biomarker),筛选与验证逻辑以健康人基因表达峰位为基准,通过检测MDS患者各成熟阶段的基因表达量,对比峰位差异以确定异常。
研究过程详述:Biomarker来源为MDS患者骨髓分馏后的6个中性粒细胞祖细胞组分,验证方法为qRT-PCR定量检测mRNA表达量。其中,AML1在健康人F1达峰,MDS患者中2例在F2达峰;C/EBP-ε在健康人F4达峰,MDS患者中所有病例在F2/F3达峰;EVI1在2例患者的F2中显著下降或未检测到(文献未提供具体AUC值,但峰位差异为核心特征)。
核心成果提炼:本研究首次发现,MDS患者中粒细胞生成调控基因(AML1、C/EBP-ε)的表达峰位显著提前(C/EBP-ε从健康人的F4提前至F2/F3,AML1从F1提前至F2),这种时间异常诱导是MDS造血细胞分化缺陷的分子标志。创新性在于,通过精细分馏方法揭示了传统方法无法检测的基因表达异常——仅分析CD34⁺或三组分的研究,无法捕捉到调控基因的时间表达变化。统计学结果显示,6例患者中所有病例的C/EBP-ε峰位异常(n=6),2例AML1峰位异常(n=2),结果具有一致性(文献未提及具体P值,但趋势明确)。
