1. 领域背景与文献引入
文献英文标题:Inhibition of BCL11B induces downregulation of PTK7 and results in growth retardation and apoptosis in T-cell acute lymphoblastic leukemia;发表期刊:Biomark Res;影响因子:未公开;研究领域:T细胞急性淋巴细胞白血病(T-ALL)发病机制与治疗靶点研究。
T细胞急性淋巴细胞白血病(T-ALL)是白血病中侵袭性较强的亚型,患者预后普遍较差,临床亟需特异性生物标志物及新型治疗靶点以改善疗效。领域共识:B细胞白血病/淋巴瘤11B(BCL11B)基因在T-ALL的发育过程中发挥关键调控作用,前期研究已证实,下调BCL11B表达可有效抑制T-ALL细胞增殖并诱导其凋亡,但这一过程的具体分子机制尚未完全阐明。此外,蛋白酪氨酸激酶7(PTK7)作为sgc8 DNA适配体的靶蛋白,已被初步鉴定为T-ALL的潜在生物标志物,然而BCL11B与PTK7之间的调控关系及PTK7作为BCL11B下游靶标的功能意义仍不明确。因此,本研究聚焦于BCL11B下游靶基因的筛选与功能验证,旨在揭示BCL11B调控T-ALL细胞生长及凋亡的分子通路,为T细胞恶性肿瘤的靶向治疗提供理论依据。
2. 文献综述解析
本研究的综述部分围绕“BCL11B在T-ALL中的作用”“PTK7作为T-ALL潜在生物标志物的研究现状”及“两者关系的未知领域”展开核心评述。现有研究已形成以下关键结论:其一,BCL11B在T-ALL患者细胞中高表达,通过RNA干扰技术下调BCL11B可显著抑制T-ALL细胞增殖并诱导凋亡;其二,PTK7作为跨膜蛋白酪氨酸激酶,是sgc8 DNA适配体的特异性靶标,其在T-ALL细胞表面的高表达使其成为潜在的疾病生物标志物。技术方法上,现有研究多利用GEO、CCLE等数据库进行大样本基因表达分析,或通过适配体技术检测PTK7的细胞定位,这些方法为基因功能研究提供了高效的大数据支撑,但局限性在于未探索BCL11B与PTK7的调控关系,也未明确PTK7作为BCL11B下游靶标的功能角色。
本研究的创新价值在于首次填补了BCL11B与PTK7调控关系的研究空白:通过多维度实验证实PTK7是BCL11B在T-ALL中的功能性下游靶基因,明确了BCL11B通过调控PTK7表达影响T-ALL细胞生长及凋亡的分子机制,为靶向BCL11B/PTK7通路治疗T细胞恶性肿瘤提供了新的理论支撑。
3. 研究思路总结与详细解析
本研究以“筛选BCL11B下游靶基因→验证调控关系→探索靶基因功能→揭示分子机制”为核心技术路线,围绕“BCL11B是否通过PTK7调控T-ALL细胞生长及凋亡”的科学问题展开,目标是明确BCL11B的下游功能靶基因及通路机制。
3.1 数据库基因表达与共表达分析
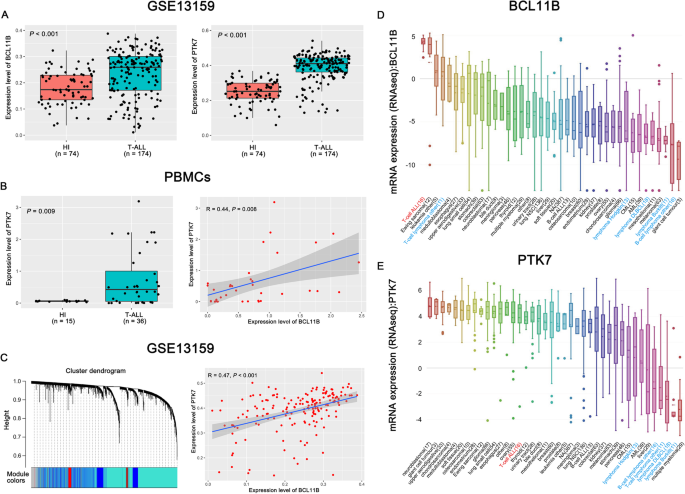
实验目的是通过大样本数据库分析,明确BCL11B与PTK7在T-ALL中的表达特征及相关性。方法细节:利用基因表达综合数据库(GEO)的GSE13159、GSE28497数据集(共220例初发T-ALL患者样本)及研究中心36例T-ALL患者外周血单个核细胞(PBMCs),分析BCL11B与PTK7的mRNA表达;通过加权基因共表达网络分析(WGCNA)构建BCL11B共表达网络;结合癌症细胞系百科全书(CCLE)数据库,分析两者在T-ALL及淋巴瘤细胞系中的表达差异。
结果解读:GEO数据显示,T-ALL患者BCL11B与PTK7的mRNA表达显著高于健康个体(GSE13159数据集P<0.001,GSE28497及PBMCs样本P<0.05);WGCNA分析表明,两者在T-ALL样本中呈显著正相关(P<0.05);CCLE数据显示,T-ALL细胞系(如Jurkat、Molt-4)中两者高表达,淋巴瘤细胞系中低表达。这些结果提示PTK7可能是BCL11B的下游靶基因。
产品关联:文献未提及具体数据库工具,领域常规使用GEO(https://www.ncbi.nlm.nih.gov/geo/)、CCLE(https://portals.broadinstitute.org/ccle)及WGCNA R包分析。
3.2 细胞系中BCL11B对PTK7的调控验证
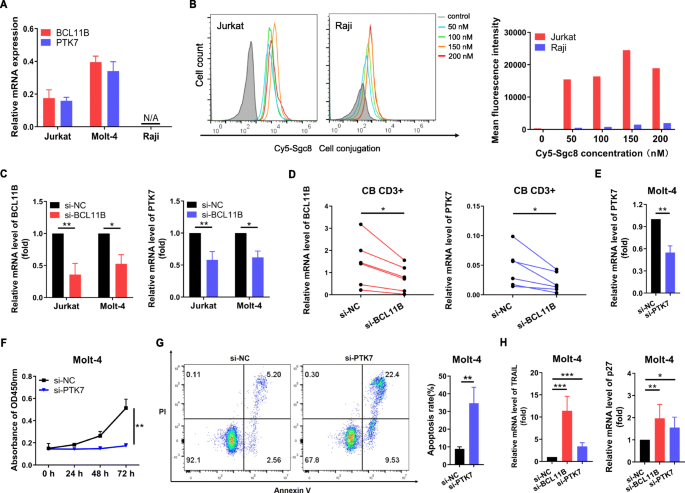
实验目的是在细胞水平验证BCL11B对PTK7的调控作用。方法细节:通过实时定量聚合酶链反应(qRT-PCR)检测T-ALL细胞系(Jurkat、Molt-4)及非T-ALL细胞系(Raji)中BCL11B与PTK7的mRNA表达;用Cy5标记的sgc8适配体处理细胞,流式细胞术检测PTK7的细胞表面表达;用BCL11B siRNA转染T-ALL细胞及脐血CD3+ T细胞,48小时后qRT-PCR检测PTK7的mRNA变化。
结果解读:qRT-PCR显示,Jurkat、Molt-4细胞中两者mRNA显著高于Raji细胞(几乎无表达);流式结果表明,Cy5-sgc8可特异性结合Jurkat细胞(T-ALL),不结合Raji细胞;BCL11B siRNA转染后,T-ALL细胞及正常CD3+ T细胞中PTK7的mRNA显著降低,证实BCL11B调控PTK7表达。
产品关联:实验所用关键试剂包括Cy5标记的sgc8适配体、BCL11B siRNA;文献未提及具体品牌,领域常规使用Lipofectamine 2000转染试剂、TaKaRa qRT-PCR试剂盒。
3.3 PTK7对T-ALL细胞增殖与凋亡的影响
实验目的是验证PTK7对T-ALL细胞增殖及凋亡的功能作用。方法细节:用PTK7 siRNA转染Molt-4细胞,qRT-PCR验证敲低效率;通过细胞计数试剂盒-8(CCK-8)检测增殖(转染后24、48、72小时);Annexin V/PI双染流式细胞术检测凋亡(转染48小时后);qRT-PCR检测TRAIL与p27的基因表达。
结果解读:PTK7 siRNA转染后,Molt-4细胞中PTK7的mRNA显著降低(敲低验证);CCK-8结果显示细胞增殖显著抑制(P<0.01);凋亡率达34.66±5.21%(P=0.008);TRAIL与p27的表达显著上调,与BCL11B siRNA组趋势一致,提示PTK7通过调控TRAIL/p27通路影响细胞功能。
产品关联:实验所用关键试剂包括PTK7 siRNA、CCK-8试剂盒(如Dojindo)、Annexin V/PI凋亡试剂盒(如BD);文献未提及具体品牌。
4. Biomarker研究及发现成果解析
Biomarker定位与研究过程
本研究的生物标志物为蛋白酪氨酸激酶7(PTK7),筛选与验证逻辑为“数据库筛选(GEO、CCLE)→共表达分析(WGCNA)→细胞系调控验证→功能验证”,形成完整链条。PTK7的来源包括T-ALL患者PBMCs、T-ALL细胞系及健康个体样本;验证方法涵盖基因表达(qRT-PCR)、细胞表面表达(流式)、调控关系(siRNA敲低)及功能实验(增殖、凋亡);特异性数据显示,Cy5-sgc8适配体可特异性结合T-ALL细胞,不结合非T-ALL细胞;敏感性数据表明,BCL11B敲低后PTK7表达显著降低,调控具有敏感性。
核心成果与创新性
本研究首次证实:① PTK7是BCL11B在T-ALL中的功能性下游靶基因,表达受BCL11B调控;② 下调PTK7可通过上调TRAIL与p27,抑制T-ALL细胞增殖(P<0.01)并诱导凋亡(凋亡率34.66±5.21%,P=0.008);③ BCL11B与PTK7在T-ALL样本中呈显著正相关(P<0.05),可作为联合生物标志物或治疗靶点。
研究的创新性在于明确了BCL11B/PTK7通路的功能作用,为T细胞恶性肿瘤的靶向治疗提供了新的潜在靶点,弥补了BCL11B通路机制研究的关键空白。
