1. 领域背景与文献引入
文献英文标题:Genetic methylation and lymphoid malignancies: biomarkers of tumor progression and targeted therapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:淋巴恶性肿瘤(淋巴细胞白血病、淋巴瘤)的表观遗传学机制与靶向治疗。
淋巴恶性肿瘤是一类起源于淋巴细胞恶性转化的异质性疾病,主要包括急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)、弥漫大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)及霍奇金淋巴瘤(HL)等亚型。其临床特征、分子机制及预后差异显著,尽管免疫化疗显著改善了患者疗效,但仍缺乏反映肿瘤恶性行为的 definitive生物标志物,且靶向治疗策略的优化仍是临床难题。DNA甲基化作为转录调控的关键表观遗传机制,异常启动子高甲基化可导致抑癌基因沉默,已被证实参与肿瘤进展。例如,抑癌基因p15(CDKN2B)、p16(CDKN2A)的高甲基化在淋巴恶性肿瘤中频繁发生,与肿瘤增殖、凋亡逃逸密切相关。然而,不同淋巴恶性肿瘤亚型的甲基化谱差异及甲基化调控的信号通路仍需系统整合,基于甲基化的靶向治疗策略也需进一步关联临床应用。本文旨在总结异常基因甲基化在淋巴恶性肿瘤中的致病作用,重点探讨靶向关键信号网络的治疗策略,为疾病机制研究及靶向疗法开发提供依据。
2. 文献综述解析
作者对现有研究的分类维度基于淋巴恶性肿瘤的不同亚型(ALL、CLL、DLBCL、MCL、HL),分别总结各亚型的甲基化特征、临床关联及涉及的信号通路。
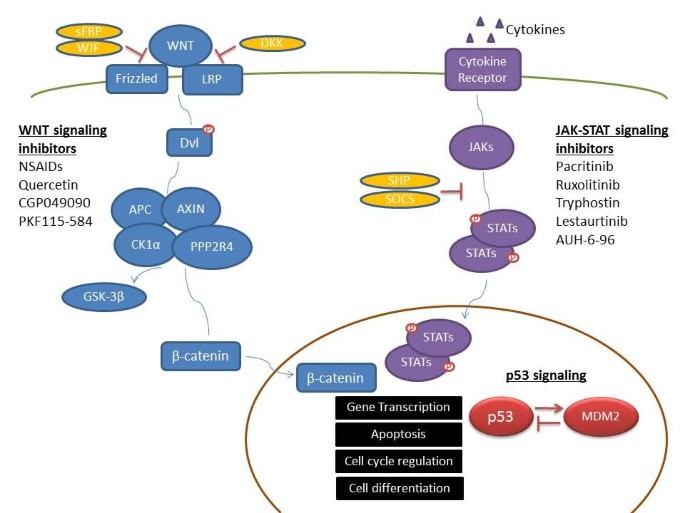
现有研究的关键结论包括:(1)亚型特异的甲基化谱:T-ALL患者中,CpG岛甲基化表型(CIMP)阳性(≥3个基因甲基化)与更短的无病生存期(DFS)和总生存期(OS)相关;CLL中,IGHV未突变亚型的抑癌基因(如ABI3、SCGB2A1)高甲基化频率显著高于突变亚型;MCL中,SOX9、HOXA9等基因高甲基化与高Ki-67增殖指数相关。(2)甲基化与临床预后的关联:ALL中,p53通路13个基因甲基化的患者完全缓解(CR)率(84%)显著低于非甲基化患者(91%);CLL中,19个甲基化基因(如SOX11、DLX1)与更短OS相关。(3)信号通路的甲基化调控:WNT通路抑制剂(WIF-1、sFRP家族)高甲基化导致通路异常激活;JAK-STAT通路抑制剂(SHP1、SOCS1)高甲基化导致通路持续激活;p53通路基因(如TP53、CDKN1C)高甲基化抑制通路功能。
现有研究的技术优势在于基因组甲基化分析(如甲基化阵列、Bisulfite pyrosequencing)能精准分类肿瘤亚型并筛选差异甲基化基因;局限性则包括部分研究样本量较小(如部分ALL研究仅纳入19例患者)、临床验证不足(部分甲基化标志物未在大样本队列中确认)。
本文的创新价值在于:(1)系统整合多亚型的甲基化研究,首次梳理不同淋巴恶性肿瘤的甲基化谱差异;(2)关联甲基化与信号通路,明确异常甲基化对WNT、JAK-STAT、p53等关键通路的调控机制;(3)聚焦靶向治疗,总结DNMT抑制剂、HDAC抑制剂及通路靶向药物的研究进展,填补了甲基化表观遗传学与临床治疗之间的研究 gap。
3. 研究思路总结与详细解析
本文作为综述性研究,整体框架遵循“亚型甲基化谱总结→信号通路解析→靶向治疗策略”的逻辑闭环,核心目标是阐明异常甲基化在淋巴恶性肿瘤中的作用及靶向治疗潜力,核心科学问题是“异常甲基化如何调控肿瘤进展”及“如何靶向甲基化相关通路”。
3.1 不同淋巴恶性肿瘤亚型的甲基化谱总结
实验目的:明确各淋巴恶性肿瘤亚型的甲基化特征及临床关联。
方法细节:作者按肿瘤类型(ALL、CLL、DLBCL、MCL、HL)分类,梳理现有研究中通过甲基化阵列(如Illumina Infinium)、甲基化特异性PCR(MS-PCR)、Bisulfite pyrosequencing等技术检测的甲基化基因,及与临床预后(如DFS、OS、CR率)的关联。
结果解读:例如,T-ALL研究中,44/50例患者至少1个基因甲基化,CIMP阳性(≥3个基因甲基化)患者的DFS和OS显著短于CIMP阴性患者;CLL中,78例患者的19个基因(如SOX11、DLX1)高甲基化与更短OS相关;MCL中,38例患者的7个基因(如SOX9、HOXA9)高甲基化与高Ki-67指数(增殖活性)相关。
实验所用关键产品:文献未提及具体实验产品,领域常规使用甲基化阵列试剂盒、MS-PCR试剂及Bisulfite pyrosequencing检测系统。
3.2 甲基化调控的信号通路分析
实验目的:解析异常甲基化对关键信号通路的调控机制。
方法细节:作者整合现有研究,分析WNT、JAK-STAT、p53通路的甲基化调控——通过检测通路抑制剂基因(如WNT的WIF-1、JAK-STAT的SHP1)的甲基化状态,关联通路活性(如β-catenin核转移、STAT磷酸化)及肿瘤表型(如增殖、凋亡)。
结果解读:例如,ALL中WNT抑制剂(WIF-1、sFRP2)高甲基化与更长DFS相关,提示通路抑制可改善预后;CLL中SHP1高甲基化导致JAK-STAT通路持续激活,促进肿瘤细胞增殖;ALL中p53通路13个基因(如TP53、CDKN1C)甲基化的患者,CR率(84%)显著低于非甲基化患者(91%)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用通路抑制剂(如WNT抑制剂XAV939)、Western blot试剂(如β-catenin抗体)检测通路活性。
3.3 靶向甲基化及信号通路的治疗策略总结
实验目的:总结基于甲基化的靶向治疗策略及临床进展。
方法细节:作者梳理DNMT抑制剂(如阿扎胞苷、地西他滨)、HDAC抑制剂(如罗米地辛、伏立诺他)、通路靶向药物(如JAK2抑制剂Pacritinib、WNT抑制剂Quercetin)的临床前及临床研究结果,包括药物疗效(如CR率、PR率)、不良反应(如骨髓抑制)。
结果解读:例如,阿扎胞苷治疗1例转化为ALL的骨髓增生异常综合征患者,实现CR超过6个月;地西他滨治疗复发/难治CLL的I期试验中,8例患者达到稳定疾病(SD);HDAC抑制剂与DNMT抑制剂联合使用,在DLBCL细胞系中协同诱导凋亡。
实验所用关键产品:文献提及的药物包括阿扎胞苷(Vidaza)、地西他滨(Dacogen)、罗米地辛(Depsipeptide)等,具体实验试剂未明确。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
文献中的Biomarker主要为异常甲基化的功能基因,包括:(1)抑癌基因(p15、p16、SHP1、DAPK);(2)WNT通路抑制剂(WIF-1、sFRP1、sFRP4);(3)JAK-STAT通路抑制剂(SHP1、SOCS1);(4)p53通路基因(TP53、CDKN1C、TP73)。筛选验证逻辑为:基因组筛选→细胞系/临床验证→临床关联——首先通过甲基化阵列筛选差异甲基化基因,然后用MS-PCR、Bisulfite pyrosequencing在细胞系或临床样本中验证,最后关联预后(如OS、DFS)或治疗反应(如CR率)。
研究过程详述
Biomarker来源包括淋巴恶性肿瘤患者的血液/组织样本(如ALL患者骨髓样本、CLL患者外周血样本)及细胞系(如HL的KM-H2细胞系)。验证方法:(1)甲基化特异性PCR(MS-PCR)检测基因启动子甲基化状态;(2)甲基化阵列分析全基因组甲基化谱;(3)Bisulfite pyrosequencing定量甲基化水平。
特异性与敏感性数据:例如,ALL中p53通路13个基因甲基化的患者占78%(n=200),其CR率(84%)显著低于非甲基化患者(91%,P<0.05);T-ALL中CIMP阳性患者(≥3个基因甲基化)的DFS和OS显著短于CIMP阴性患者(n=50,P<0.05);CLL中19个甲基化基因(如SOX11、DLX1)与更短OS相关(n=78,P<0.05)。
核心成果提炼
(1)预后关联:甲基化Biomarker可作为淋巴恶性肿瘤的预后指标——CIMP阳性T-ALL患者预后更差,CLL中多基因甲基化与短OS相关,ALL中p53通路甲基化患者治疗反应更差。
(2)治疗靶点:部分甲基化Biomarker可作为靶向治疗的靶点——DNMT抑制剂(如地西他滨)可恢复甲基化抑癌基因(如p15、p16)的表达,抑制肿瘤细胞增殖;JAK2抑制剂(如Pacritinib)可靶向JAK-STAT通路激活的CLL或HL患者。
(3)创新性:首次系统总结了不同淋巴恶性肿瘤亚型的甲基化Biomarker,关联其临床意义与治疗潜力,为个性化治疗提供了表观遗传学依据。