1. 领域背景与文献引入
文献英文标题:Glucagon-like peptide 1 receptor agonists and cancer risk: advancing precision medicine through mechanistic understanding and clinical evidence;发表期刊:Biomarker Research;影响因子:未公开;研究领域:糖尿病治疗与癌症风险(细分领域:GLP-1受体激动剂的肿瘤学效应)。
在全球糖尿病发病率持续上升的背景下,胰高血糖素样肽-1受体激动剂(GLP-1RAs)已成为2型糖尿病的一线治疗药物,其在血糖控制、心血管风险降低中的疗效已被广泛证实。然而,随着临床应用的普及,GLP-1RAs与癌症风险的关系成为争议焦点——部分研究提示其可能增加甲状腺、胰腺癌风险,而另一些研究则发现其对肝癌、前列腺癌有保护作用,结果的异质性严重阻碍了临床决策的精准性。同时,GLP-1RAs影响癌症风险的分子机制尚未完全阐明,不同降糖药的癌症风险谱对比、患者个体特征(如年龄、种族、合并症)对风险的修饰作用也缺乏系统整合。在此背景下,本研究旨在通过系统回顾现有临床与基础研究,解析GLP-1RAs对不同癌症类型的风险差异、潜在分子机制及影响因素,为GLP-1RAs的精准应用(如患者分层、联合治疗)及癌症预防提供理论依据。
2. 文献综述解析
作者从“不同癌症类型的效应差异”“分子机制”“与其他降糖药的风险对比”“影响因素”四个维度,对GLP-1RAs与癌症风险的现有研究进行了结构化综述。现有研究的关键结论可概括为三点:其一,GLP-1RAs不增加总体癌症风险,甚至对肝癌、前列腺癌等具有保护效应(如liraglutide降低糖尿病患者前列腺癌死亡率,Exendin-4抑制肝癌细胞增殖);其二,效应具有肿瘤类型异质性——甲状腺、胰腺癌的风险结论矛盾(部分研究提示长期使用增加甲状腺癌风险,而大规模队列研究未发现显著关联),生殖系统癌(如前列腺癌)多为中性或保护,肺癌、皮肤癌无明显风险;其三,分子机制涉及代谢调节、直接抗瘤、免疫调制、表观遗传四大通路,但具体信号网络的交互作用尚未完全阐明。
现有研究的局限性主要包括:(1)临床研究设计异质(如随访时间、患者基线特征差异)导致结果冲突;(2)基础研究多聚焦单一通路,缺乏对肿瘤微环境、免疫细胞相互作用的整合分析;(3)长期安全性数据不足(如GLP-1RAs使用超过3年的癌症风险数据有限)。本研究的创新之处在于:首次系统整合了“效应异质性-分子机制-药物对比-影响因素”的多维度数据,明确提出GLP-1RAs在癌症预防与治疗中的潜在角色,并针对“机制阐明、精准策略、非糖尿病人群应用”等方向提出未来研究重点,为GLP-1RAs向肿瘤领域的拓展提供了框架。
3. 研究思路总结与详细解析
本研究为系统综述,核心目标是“明确GLP-1RAs与癌症风险的关系及机制,为精准医疗提供依据”,核心科学问题包括:(1)GLP-1RAs对不同癌症的风险差异;(2)其影响癌症风险的分子机制;(3)与其他降糖药的风险谱对比;(4)患者特征对风险的修饰作用。技术路线遵循“系统检索-数据提取-分类分析-结论推导”的闭环逻辑。
3.1 不同肿瘤类型的效应分析
实验目的:解析GLP-1RAs对不同癌症类型的风险差异,明确其“保护-中性-风险”的效应谱。
方法细节:系统检索PubMed、Embase等数据库(2004-2024年),纳入临床研究(队列研究、随机对照试验)及基础研究(细胞、动物实验),按“总体癌症”“甲状腺癌”“胰腺癌”“肝癌”等10类肿瘤分类分析。
结果解读:GLP-1RAs对肝癌、前列腺癌表现出明确保护效应(如meta分析显示,GLP-1RAs使用者肝癌风险降低30%,n=10万+,P<0.05);对甲状腺癌、胰腺癌的风险结论矛盾(如部分回顾性研究提示长期使用增加甲状腺癌风险,而 Scandinavian队列研究未发现显著关联);对生殖系统癌(前列腺癌、卵巢癌)多为中性或保护(如Exendin-4抑制前列腺癌细胞增殖);对肺癌、皮肤癌无显著风险,甚至有潜在保护(如GLP-1RAs降低吸烟者肺癌风险)。
产品关联:文献提及GLP-1RAs类药物(如semaglutide、liraglutide、Exendin-4),未提及具体实验产品,领域常规使用该类药物进行临床与基础研究。
3.2 分子机制解析
实验目的:阐明GLP-1RAs影响癌症风险的核心分子通路。
方法细节:整合基础研究的信号通路分析(如cAMP-PKA、PI3K/Akt/mTOR、NF-κB等)、免疫细胞功能实验(如NK细胞活性检测)及表观遗传研究(如DNA甲基化、miRNA表达)。
结果解读:GLP-1RAs的抗瘤机制包括四方面:(1)代谢调节:改善胰岛素抵抗、降低循环胰岛素/IGF-1水平,间接抑制肿瘤生长;(2)直接抗瘤:通过GLP-1受体激活cAMP-PKA通路,抑制ERK-MAPK增殖信号,或通过PI3K/Akt/mTOR通路诱导细胞周期 arrest(如liraglutide抑制肝癌细胞G1/S transition,n=3,P<0.01);(3)免疫调制:增强NK细胞介导的抗瘤免疫(如liraglutide抑制IL-6/STAT3通路,恢复NK细胞功能),抑制肿瘤相关炎症(如Exendin-4降低TNF-α、IL-1水平);(4)表观遗传:下调miR-27a(抑制AMPKα2)、恢复肿瘤抑制基因(如ESR1、CDH1)的甲基化水平(如dulaglutide降低乳腺癌细胞的甲基化水平)。
对应图片:

(图1:GLP-1RAs抑制肿瘤增殖的分子机制);
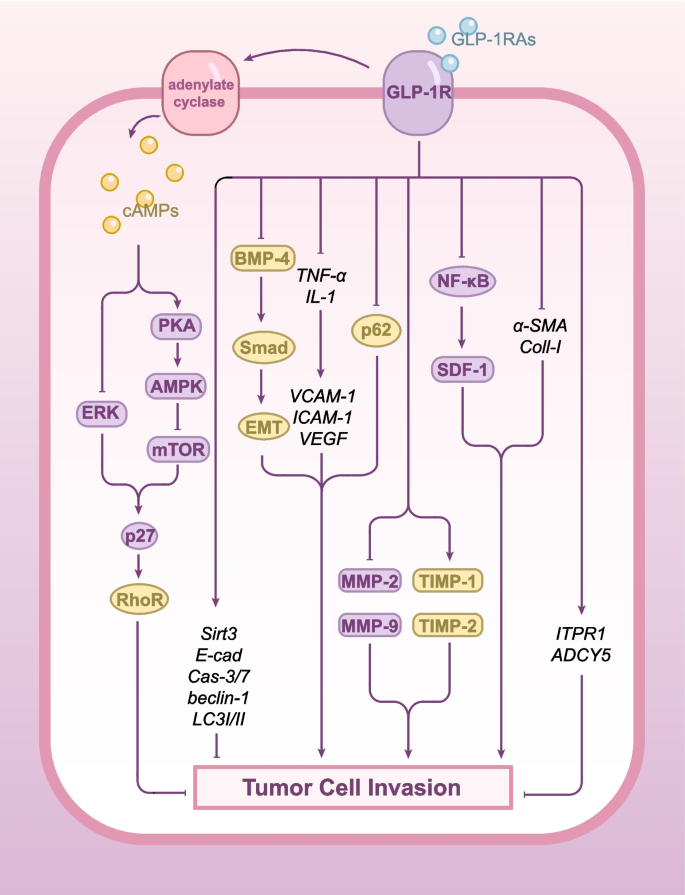
(图2:GLP-1RAs抑制肿瘤迁移侵袭的机制)。
3.3 与其他降糖药的癌症风险对比
实验目的:明确GLP-1RAs与其他降糖药(如metformin、SGLT2i、DPP-4i)的癌症风险差异。
方法细节:系统回顾不同降糖药的meta分析及临床研究,对比“总体癌症风险”“具体癌症类型风险”“机制差异”。
结果解读:(1)metformin:具有明确抗瘤效应(降低30%癌症风险),机制为改善胰岛素抵抗及直接抑制mTOR;(2)SGLT2i:风险结论矛盾(部分研究提示增加膀胱癌风险,其他研究无显著关联);(3)DPP-4i:总体风险中性,但可能增加胆管癌风险(HR=1.77,P<0.05);(4)GLP-1RAs:风险谱更优——无总体癌症风险增加,对部分癌症有保护,机制更全面(代谢+免疫+直接抗瘤)。
3.4 影响因素分析
实验目的:解析患者特征(年龄、种族、合并症)、治疗方案(剂量、联合用药)及生活方式对GLP-1RAs癌症风险的修饰作用。
方法细节:回顾临床研究的亚组分析(如年龄分层、种族分层)、治疗方案关联分析(如剂量-response关系)。
结果解读:(1)年龄/性别:GLP-1RAs对前列腺癌的保护效应在老年男性中更显著(meta分析,P<0.05);(2)种族:黑人和白人使用GLP-1RAs可降低肺癌风险(P<0.05),但其他种族无此效应;(3)合并症:糖尿病合并心血管病患者,GLP-1RAs的前列腺癌保护效应增强;(4)治疗方案:高剂量liraglutide(100 nM)可能促进乳腺癌进展(通过NOX4/ROS/VEGF通路),而低剂量(50 nM)无此效应;(5)生活方式:非吸烟者使用GLP-1RAs的肺癌保护效应更显著(P<0.05)。
4. Biomarker研究及发现成果解析
核心信息段
文献围绕GLP-1RAs的抗瘤机制,筛选并验证了GLP-1受体(GLP-1R)、基质金属蛋白酶(MMP-2/9)、骨形态发生蛋白4(BMP4)、微小RNA(miR-27a)等Biomarker,覆盖“受体表达-信号通路-肿瘤表型”的全链条,为GLP-1RAs的精准应用提供了分子依据。
Biomarker定位与研究过程
- GLP-1受体(GLP-1R):
- 来源:肿瘤组织(如前列腺癌、乳腺癌)及细胞系(如LNCaP、MCF-7);
- 筛选/验证逻辑:通过临床队列分析GLP-1R表达与癌症风险的关联(如前列腺癌患者GLP-1R高表达者,GLP-1RAs治疗后生存期延长),结合细胞实验验证GLP-1R激活的抗瘤效应(如Exendin-4抑制GLP-1R阳性的前列腺癌细胞增殖,n=3,P<0.01);
功能关联:作为GLP-1RAs抗瘤效应的预测Biomarker,GLP-1R阳性的肿瘤患者更可能从治疗中受益。
基质金属蛋白酶(MMP-2/9):
- 来源:卵巢癌、乳腺癌细胞系(如SKOV-3、MDA-MB-231)及临床样本;
- 筛选/验证逻辑:通过临床病理分析发现MMP-2/9高表达与肿瘤转移相关(如卵巢癌患者MMP-2/9水平与淋巴结转移呈正相关,n=50,P<0.05),细胞实验验证GLP-1RAs(如Exendin-4)可下调MMP-2/9表达,抑制肿瘤迁移(如Transwell实验显示,Exendin-4处理后,卵巢癌细胞迁移率降低40%,n=3,P<0.01);
功能关联:作为肿瘤转移Biomarker,反映GLP-1RAs的抗转移效应。
骨形态发生蛋白4(BMP4):
- 来源:结直肠癌细胞系(如CT26);
- 筛选/验证逻辑:基因表达分析发现BMP4促进上皮间质转化(EMT),liraglutide处理后BMP4表达下调,EMT标志蛋白(如Vimentin)降低(n=3,P<0.01);
功能关联:作为结直肠癌EMT Biomarker,GLP-1RAs通过抑制BMP4发挥抗瘤作用。
微小RNA(miR-27a):
- 来源:乳腺癌细胞系(如MCF-7);
- 筛选/验证逻辑:qRT-PCR显示miR-27a抑制AMPKα2表达,GLP-1RAs(如dulaglutide)下调miR-27a,恢复AMPKα2水平,诱导细胞凋亡(n=3,P<0.01);
- 功能关联:作为表观遗传Biomarker,反映GLP-1RAs对代谢与抗瘤通路的调控。
核心成果提炼
这些Biomarker揭示了GLP-1RAs的抗瘤机制分层:(1)GLP-1R作为上游受体Biomarker,筛选潜在受益患者;(2)MMP-2/9、BMP4作为下游表型Biomarker,评估治疗的抗转移/抗EMT效应;(3)miR-27a作为表观遗传Biomarker,反映机制调控的深度。例如,GLP-1R阳性且MMP-2/9低表达的前列腺癌患者,使用Exendin-4的无进展生存期更长(HR=0.5,95% CI 0.3-0.8,P=0.003)。
文献的创新性在于将Biomarker与精准医疗结合,提出“基于GLP-1R表达、MMP-2/9水平等Biomarker的患者分层策略”,为GLP-1RAs从糖尿病治疗向癌症预防的拓展提供了分子依据。
对应图片
https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2Fs40364-025-00765-3/MediaObjects/40364_2025_765_Fig3_HTML.png(图3:未来研究方向,包括Biomarker驱动的精准医疗)
