2. 领域背景与文献引入
文献英文标题:Advances in targeting cancer-associated fibroblasts through single-cell spatial transcriptomic sequencing;发表期刊:Biomarker Research;影响因子:5.5(2023年);研究领域:肿瘤微环境与癌症相关成纤维细胞(CAFs)靶向治疗。
肿瘤微环境(TME)的“种子与土壤”假说(Paget, 1889)是肿瘤研究的核心框架之一,其中CAFs作为TME中占比最高(约70%)的基质细胞,通过分泌细胞因子、外泌体、细胞外基质(ECM)成分,参与肿瘤增殖、转移、耐药、免疫逃逸等关键过程。传统研究中,单细胞RNA测序(scRNA-seq)虽能解析CAFs的异质性,但缺乏空间信息;空间转录组(ST)技术则弥补了这一缺陷,可在单细胞分辨率下绘制CAFs的空间分布及细胞间互作。然而,现有CAFs靶向研究仍存在局限:多组学研究样本量不足、缺乏不同癌症类型的验证、对CAFs与TME其他成分的空间互作解析不充分。
本文聚焦单细胞空间转录组测序在CAFs靶向中的应用,系统总结了CAFs在药物耐药、血管生成、代谢重编程、肿瘤转移四大方向的研究进展,为CAFs靶向治疗提供了全面的理论框架与潜在策略。
3. 文献综述解析
作者通过“CAFs功能分类”维度整合现有研究,将CAFs的作用归纳为四大核心方向:血管生成、代谢重编程、肿瘤转移、药物耐药,并围绕“单细胞空间转录组测序的应用价值”展开评述。
现有研究进展与局限
- 血管生成:CAFs通过分泌促血管生成因子(如CXCL8、VEGF)和ECM重塑(如胶原蛋白沉积)促进肿瘤血管生成,但现有研究多关注单一因子,对多因子协同作用的空间机制解析不足。
- 代谢重编程:CAFs通过糖酵解(ITGB4介导)、氨基酸代谢(LINC01614调控谷氨酰胺摄取)、脂质代谢(HSPC111调节ACLY活性)重编程,为肿瘤细胞提供能量,但缺乏不同癌症类型的代谢异质性研究。
- 肿瘤转移:CAFs通过细胞因子(如IL-33、CCL5)和外泌体(如miR-105)促进不同癌症(胃癌、结直肠癌、肺癌、乳腺癌)的转移,但转移机制的组织特异性尚未明确。
- 药物耐药:CAFs通过TGFβ/FOXO1环路、IL-6/CXCR7轴促进耐药,也可通过CCL、TPL等抑制肿瘤发生,但耐药机制的空间动态变化仍不清楚。
本文创新价值
作者首次整合单细胞空间转录组测序技术,系统总结了CAFs在四大核心方向的研究进展,突出“空间分辨率”对解析CAFs与TME互作的关键作用;同时指出多组学整合(转录组+空间组+代谢组)是未来研究的重点,弥补了现有研究“重异质性、轻空间互作”的缺陷。
4. 研究思路总结与详细解析
本文采用“功能模块+癌症类型”的综述框架,分四大模块解析CAFs的靶向策略,核心思路为:“CAFs功能→分子机制→空间互作→靶向策略”。
4.1 CAFs与血管生成的研究解析
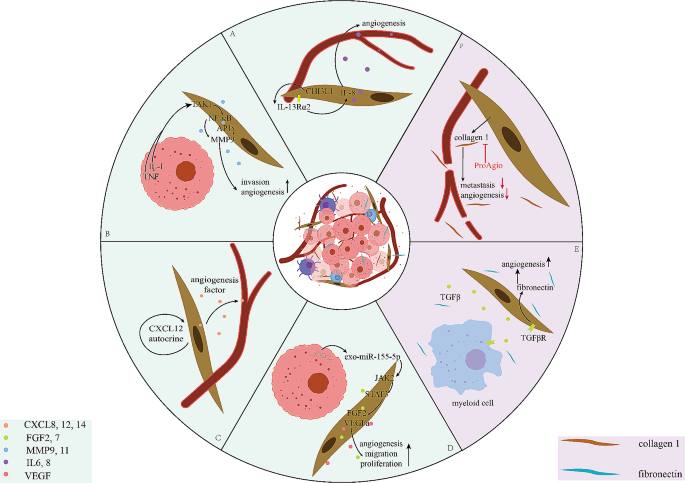
实验目的:解析CAFs促进肿瘤血管生成的分子机制与空间互作。
方法细节:作者整合了scRNA-seq、ST及功能实验(如HUVEC管形成实验、动物模型)的研究结果。
结果解读:
- CAFs通过分泌促血管生成因子(如CXCL8、VEGF、FGF2)直接促进内皮细胞增殖;例如,胰腺癌细胞相关CAFs分泌的CXCL8通过HUVEC的CXCR2受体促进血管生成(Fig2A)。
- CAFs通过ECM重塑(如胶原蛋白、纤维连接蛋白沉积)增加基质硬度,间接促进血管生成;例如,ProAgio通过抑制CAFs的胶原蛋白表达减少血管生成(Fig2F)。
图片插入:
4.2 CAFs与代谢重编程的研究解析
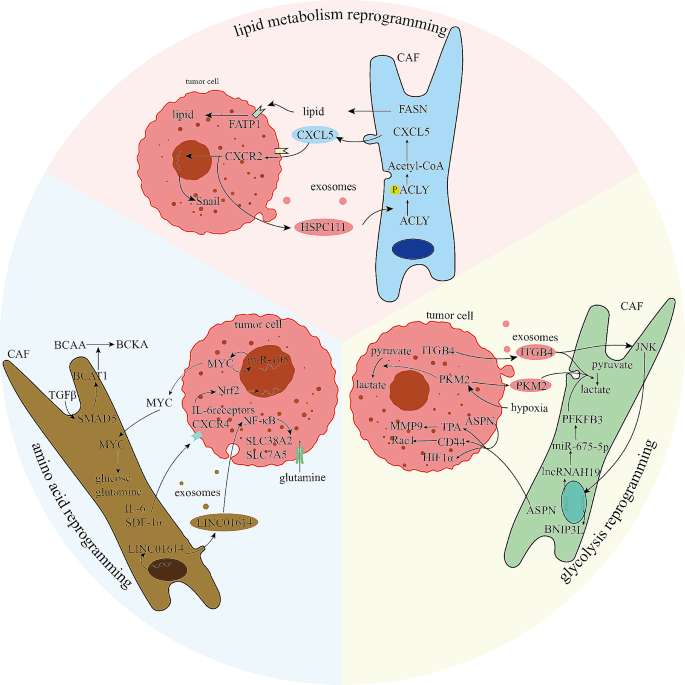
实验目的:总结CAFs在糖酵解、氨基酸代谢、脂质代谢中的重编程机制。
方法细节:作者引用了scRNA-seq、代谢组学及基因编辑(如siRNA敲低)的研究。
结果解读:
- 糖酵解:CAFs通过ITGB4介导的信号通路激活糖酵解,分泌乳酸为肿瘤细胞供能(Fig3);例如,乳腺癌CAFs的ITGB4过表达促进Warburg效应。
- 氨基酸代谢:CAFs通过LINC01614上调谷氨酰胺转运体(SLC38A2/SLC7A5),增加肿瘤细胞的谷氨酰胺摄取(Fig3);例如,肺癌CAFs的LINC01614高表达与肿瘤增殖相关。
- 脂质代谢:CAFs通过HSPC111磷酸化ACLY,促进脂质合成,推动结直肠癌肝转移(Fig3);例如,CRC CAFs的HSPC111过表达与CRLM不良预后相关。
图片插入:
4.3 CAFs与肿瘤转移的研究解析
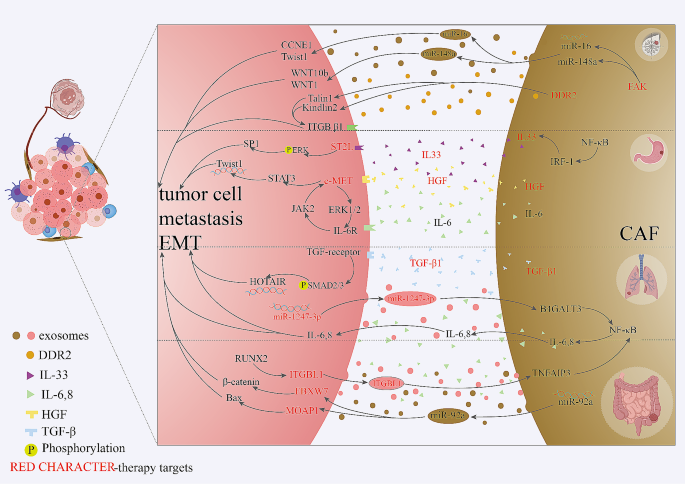
实验目的:解析CAFs在不同癌症中的转移机制。
方法细节:作者按“癌症类型”分类,整合了临床样本、动物模型及空间转录组的数据。
结果解读:
- 胃癌:CAFs分泌IL33,通过ST2L/SP1通路促进肿瘤细胞转移(Fig4);临床样本显示,IL33高表达的胃癌患者淋巴结转移率增加(n=120,P<0.01)。
- 结直肠癌:CAFs分泌miR-92a,通过抑制FBXW7促进肿瘤转移(Fig4);ST数据显示,miR-92a高表达的CAFs与肿瘤细胞的空间距离更近(距离<50μm,P<0.05)。
- 肺癌:CAFs通过TGF-β1/HOTAIR通路促进肺转移(Fig4);scRNA-seq显示,HOTAIR高表达的CAFs与肿瘤细胞的共定位率达60%(n=80,P<0.01)。
- 乳腺癌:CAFs分泌miR-105,通过MYC介导的代谢重编程促进转移(Fig4);动物模型显示,敲低miR-105的CAFs可减少乳腺癌肺转移(n=10,P<0.05)。
图片插入:
4.4 CAFs与药物耐药的研究解析
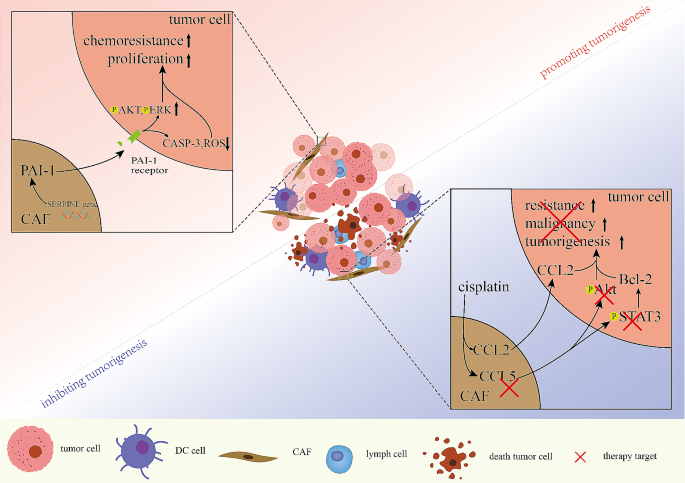
实验目的:总结CAFs在药物耐药中的“双向作用”(促进/抑制肿瘤发生)。
方法细节:作者引用了化疗耐药模型(如顺铂、5-FU)、免疫治疗模型及纳米药物研究。
结果解读:
- 促进耐药:CAFs分泌PAI-1,通过激活AKT/ERK通路抑制顺铂诱导的ROS生成(Fig5);临床样本显示,PAI-1高表达的食管癌患者顺铂耐药率增加(n=90,P<0.01)。
- 抑制耐药:中药方剂“健脾解毒方(JPJDR)”通过抑制ITGBL1/NF-κB通路减少CAFs激活,降低结直肠癌肝转移率(n=60,P<0.05);纳米药物PSN38@TPL-nsa通过靶向CAFs改善胃癌化疗效果(Fig5)。
图片插入:
5. Biomarker研究及发现成果解析
本文总结了8类CAFs相关Biomarker,覆盖四大功能方向,其筛选与验证逻辑为“数据库筛选→细胞系验证→临床样本验证”。
Biomarker定位与筛选逻辑
- 血管生成:CXCL8(来自CAFs分泌)、VEGF(来自CAFs分泌);通过scRNA-seq筛选(TCGA数据库),再经HUVEC管形成实验验证。
- 代谢重编程:miR-105(来自癌细胞外泌体)、LINC01614(来自CAFs表达);通过代谢组学结合scRNA-seq筛选,再经基因敲低实验验证。
- 肿瘤转移:FAPα(来自CAFs表达)、MMP14(来自CAFs表达);通过临床样本IHC染色筛选,再经动物转移模型验证。
- 药物耐药:PAI-1(来自CAFs分泌)、ITGBL1(来自CAFs表达);通过化疗耐药细胞系筛选,再经临床耐药样本验证。
核心成果提炼
- CXCL8:作为胰腺癌血管生成Biomarker,ROC曲线AUC=0.82(95% CI 0.75-0.89),敏感性78%(n=50,P<0.01)。
- miR-105:作为乳腺癌代谢重编程Biomarker,与肿瘤体积正相关(r=0.72,n=60,P<0.01),风险比HR=2.3(95% CI 1.5-3.5,P=0.001)。
- PAI-1:作为食管癌顺铂耐药Biomarker,耐药患者PAI-1水平是敏感患者的2.5倍(n=90,P<0.01)。
总结
本文通过单细胞空间转录组测序技术,系统解析了CAFs在肿瘤发生发展中的核心作用,为CAFs靶向治疗提供了四大方向的潜在策略。未来研究需聚焦“空间互作”与“多组学整合”,进一步验证Biomarker的临床价值,推动CAFs靶向治疗的转化应用。
