1. 领域背景与文献引入
文献英文标题:Blood proteomics for quantitative biomarkers of cellular therapies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:细胞治疗中的血液蛋白质组学生物标志物研究。
细胞治疗(如异基因造血干细胞移植、CAR-T细胞免疫治疗)是血液系统恶性肿瘤的突破性治疗手段,已使众多复发/难治性患者获得长期缓解。然而,治疗疗效的个体差异大、毒性(如移植物抗宿主病(GVHD)、细胞因子释放综合征(CRS))难以早期预警,仍是临床亟待解决的问题。血液蛋白质组学作为连接基因组信息与疾病表型的核心技术,能直接反映细胞功能与病理状态,是细胞治疗生物标志物(Biomarker)发现的有力工具。近年来,定量蛋白质组学技术(包括质谱(MS)-based 方法与基于亲和试剂的高通量平台(如Olink、SomaScan))快速发展,但仍存在诸多瓶颈:MS-based 方法虽能无偏倚检测蛋白质,但样品处理复杂、成本高;亲和-based 平台虽高通量,但不同平台间的检测一致性差,且生物标志物从实验室到临床的转化效率低。针对这一空白,本文系统总结了临床蛋白质组学的技术进展,梳理了细胞治疗领域中已验证的血液蛋白质生物标志物,旨在为生物标志物的临床转化提供指导。
2. 文献综述解析
本文综述的核心评述逻辑为:按“技术类型-方法特点-临床应用”框架,将现有血液蛋白质组学研究分为质谱(MS)-based与亲和(affinity)-based两大技术体系,分别总结其优势、局限及在细胞治疗生物标志物研究中的应用,最终聚焦“技术进展如何推动生物标志物转化”这一核心问题。
现有研究的关键结论与局限
- MS-based 蛋白质组学:
- 关键结论:通过高丰度蛋白去除(如磁珠、酸沉淀)与多重标记(如TMT)技术,可实现无偏倚的蛋白质定量,检测深度从传统的300种蛋白提升至5000种以上,适用于低丰度生物标志物的发现(如单细胞蛋白质组学可检测单个细胞的800-1200种蛋白)。
局限:样品处理复杂、成本高(如磁珠法每样本成本约150美元),难以大规模应用于临床队列。
affinity-based 蛋白质组学:
- 关键结论:Olink(邻近延伸分析,PEA)与SomaScan(适配体技术)平台具有高通量(单次检测数千种蛋白)、样品量需求小(55μL血浆)的优势,已用于万人级队列研究(如4万例血浆蛋白组学研究)。
- 局限:不同平台对同一蛋白的检测相关性差(部分研究显示相关性<0.5),且特异性受抗体/适配体质量影响。
本研究的创新价值
本文的核心创新在于整合技术进展与临床应用:既总结了MS与亲和平台的技术突破(如磁珠法、酸沉淀法提高MS检测深度,Olink/SomaScan的高通量优势),又系统梳理了细胞治疗中已验证的生物标志物(如ST2、IL-6),填补了“技术发展”与“临床应用”之间的信息 gap;同时强调了生物标志物标准化与多平台验证的重要性,为后续转化研究提供了明确方向。
3. 研究思路总结与详细解析
本研究作为综述性文章,整体思路是:先总结血液蛋白质组学的技术进展,再解析这些技术在细胞治疗生物标志物发现中的应用,最后聚焦已验证生物标志物的临床价值。以下按技术体系与应用场景分环节解析:
3.1 质谱-based 血液蛋白质组学技术
实验目的:解决血浆蛋白质组动态范围广(10个数量级)、高丰度蛋白占比高(99%)的问题,提高低丰度蛋白的检测深度。
方法细节:采用高丰度蛋白去除策略(如磁珠法(Seer nanoparticle、PreOmics ENRICHplus、Mag-Net)、酸沉淀法)结合质谱分析(如Orbitrap Astral质谱仪的DIA/DDA模式)。其中:
- 磁珠法通过纳米颗粒富集低丰度蛋白(如Seer平台用43种不同理化性质的纳米颗粒,捕获 distinct 蛋白模式);
- 酸沉淀法(高氯酸)通过蛋白质变性去除高丰度蛋白,每样本成本仅2-3美分。
结果解读:磁珠法可从50-200μL血浆中检测到2000-5000种蛋白(如PreOmics ENRICHplus试剂盒用50μL血浆检测到5500种蛋白);酸沉淀法在3199例COVID-19患者血浆中检测到3198种蛋白,且批次效应小(跨44块板的CV<10%)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用Orbitrap Astral质谱仪、Seer Proteograph平台、PreOmics ENRICHplus试剂盒等。
3.2 亲和-based 血液蛋白质组学技术
实验目的:实现高通量、高灵敏度的蛋白质检测,适用于大样本队列研究。
方法细节:
- Olink平台:采用邻近延伸分析(PEA),每种蛋白用2种带互补DNA标签的抗体靶向;当抗体与蛋白结合时,DNA标签杂交并延伸,形成独特的DNA barcode,经PCR扩增后用Illumina测序仪读值。
- SomaScan平台:采用SOMAmer适配体(修饰的单链DNA),通过“慢解离速率”(slow off-rate)结合目标蛋白,经芯片杂交后定量。
结果解读:Olink Explore可检测约6000种蛋白(覆盖炎症、肿瘤等通路),SomaScan能检测11000种蛋白(覆盖90%的人类蛋白质组);但两者对同一蛋白的检测相关性差(如针对100种蛋白的对比研究显示,仅30%的蛋白相关性>0.6)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用Olink Explore平台、SomaScan平台、Illumina NovaSeq测序仪等。
3.3 细胞治疗中生物标志物的验证研究
实验目的:验证血液蛋白质生物标志物在细胞治疗中的临床价值(风险分层、疗效监测、毒性预警)。
方法细节:纳入造血干细胞移植(n=多中心队列,如982例慢性GVHD研究)与CAR-T治疗(n=300+例淋巴瘤/骨髓瘤研究)的患者,采集血浆/血清样本,通过ELISA、qPCR、流式细胞术等验证候选生物标志物(如ST2、Reg3α、IL-6)。
结果解读:
- 造血干细胞移植中,ST2(IL-33诱饵受体)水平在治疗开始时升高的患者,GVHD耐药风险高2倍(n=500+,P<0.05);Reg3α(胰腺分泌蛋白)是胃肠道GVHD的特异性标志物(AUROC=0.85,95%CI 0.81-0.89);
- CAR-T治疗中,IL-6水平早期(输注后24小时)升高与CRS severity相关(敏感性85%,n=200+,P<0.01);CAR-T细胞峰值水平(>100 cells/μL)与1年缓解率正相关(70% vs 30%,n=100+,P<0.05)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用ELISA试剂盒(如R&D Systems的ST2试剂盒)、流式细胞仪(如BD FACSCanto)等。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究涉及的生物标志物为细胞治疗中的血液蛋白质标志物,包括:
- 造血干细胞移植相关:ST2、Reg3α、TIM3(T细胞免疫球蛋白黏蛋白-3)、CD163(单核细胞 scavenger受体)、DKK3(Wnt信号调节剂);
- CAR-T治疗相关:IL-6、CRP(C反应蛋白)、EASIX(内皮激活与应激指数)、CAR-T细胞扩张/持续性。
筛选与验证逻辑:遵循“蛋白质组学发现候选→回顾性队列验证→前瞻性队列确认”的流程,部分标志物(如ST2)已通过多中心临床试验验证(如Vander Lugt等2013年的NEJM研究,纳入1000+例患者)。
研究过程详述
- 生物标志物来源:患者血浆/血清样本(体积55-200μL),部分研究采用纵向样本(如造血干细胞移植后D14、D100的血浆);
- 验证方法:ELISA(检测ST2、Reg3α)、qPCR(检测CAR-T细胞拷贝数)、流式细胞术(检测CAR-T细胞比例);
- 特异性与敏感性:ST2预测GVHD死亡率的AUROC=0.82(95%CI 0.78-0.86),IL-6预测CRS的敏感性为85%(n=200+,P<0.01);DKK3在D100 post-HCT预测慢性GVHD的HR=1.5(95%CI 1.2-1.8,P=0.003)。
核心成果提炼
- 造血干细胞移植:
- ST2、Reg3α、DKK3等标志物可用于GVHD的风险分层与诊断(如DKK3在D100 post-HCT升高的患者,慢性GVHD发生率高30%);
CD163(单核细胞激活标志物)在D80 post-HCT升高,预测 de novo 慢性GVHD(HR=1.4,P=0.01)。
CAR-T治疗:
- IL-6、CRP可早期预警CRS(如IL-6>1000pg/mL的患者,CRS grade≥3的风险高5倍);
- CAR-T细胞扩张与持续性是疗效的关键预测因子(如峰值>100 cells/μL的患者,1年无进展生存率高40%);
- EASIX(由LDH、肌酐、血小板计算)可预测CAR-T相关内皮毒性(HR=2.1,P<0.05)。
创新性与临床价值
本文的核心创新在于首次系统总结细胞治疗中已验证的血液蛋白质生物标志物,并强调:
- 生物标志物的标准化检测(如ST2的ELISA试剂盒需统一阈值)是临床转化的关键;
- 多平台验证(如MS与Olink联合使用)可提高生物标志物的可靠性。
这些成果为细胞治疗的个性化治疗提供了依据(如高ST2患者需加强GVHD预防,高IL-6患者需早期使用托珠单抗),推动了细胞治疗从“经验医学”向“精准医学”的转变。
关键图片解析
图1(MS数据采集策略):对比DDA(数据依赖采集)与DIA(数据独立采集)的工作原理,DIA通过系统性 fragmentation所有离子,提高低丰度蛋白的检测 reproducibility。
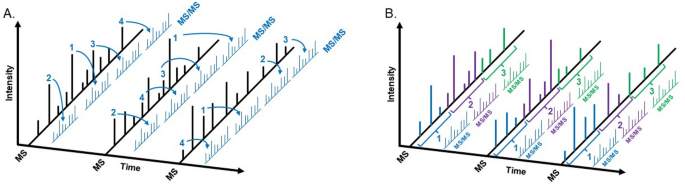
图2(Biomarker开发框架):展示“定义临床需求→蛋白质组学发现→ assay 开发→临床验证→监管认证”的全流程,强调前瞻性队列验证的重要性。
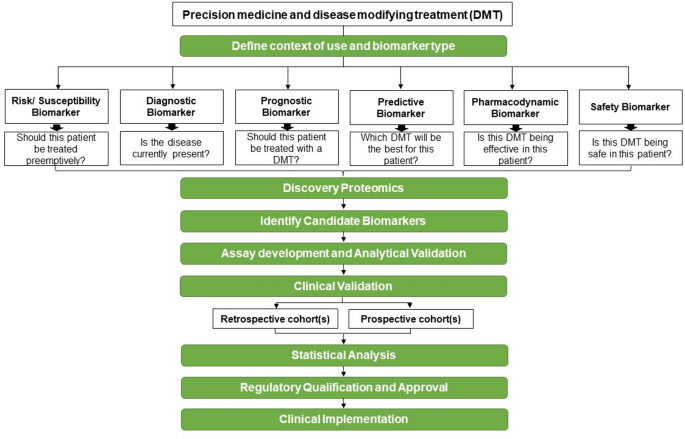
图3(ROC曲线分析):解释AUROC的意义(如AUROC=0.82表示ST2预测GVHD的准确性),并对比Youden指数与“closest to (0,1)”两种阈值选择方法。
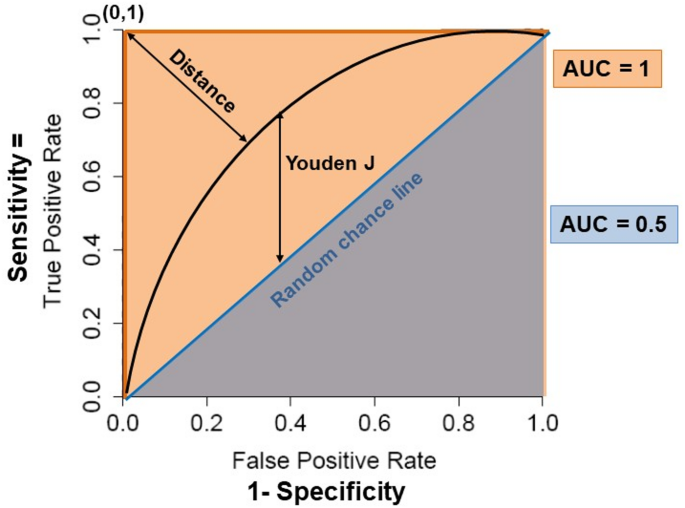
图4(深度学习性能):展示深度学习(如神经网络)在生物标志物分析中的优势——随着样本量增加,性能显著优于传统算法(如逻辑回归)。
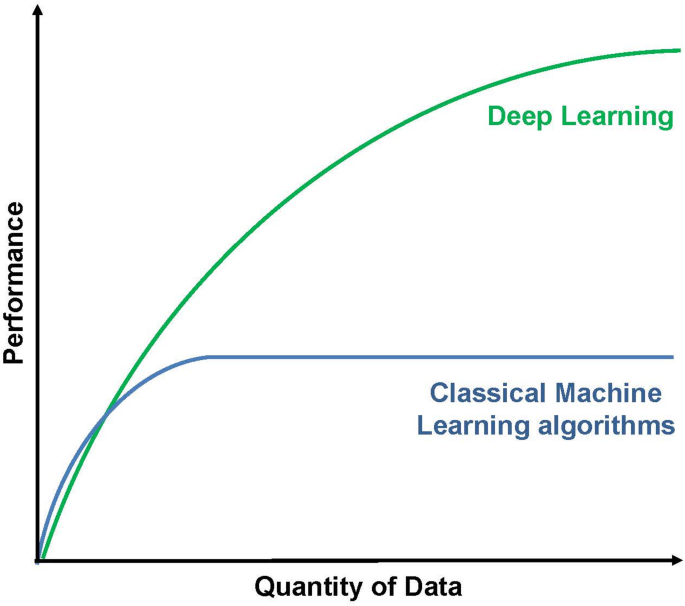
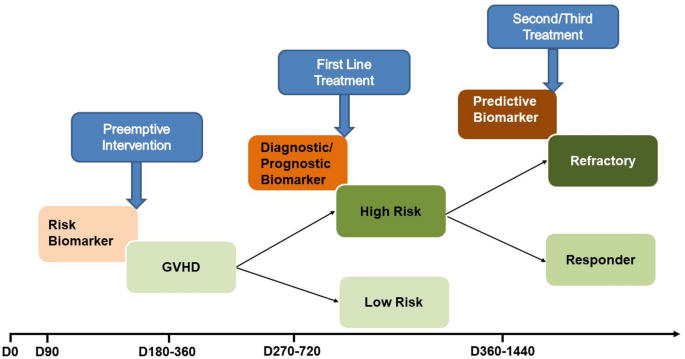
图5(临床应用框架):总结细胞治疗中生物标志物的临床应用场景(如D14 post-HCT用ST2预测急性GVHD,D100用DKK3预测慢性GVHD),推动个性化治疗。
本文通过系统总结血液蛋白质组学技术进展与细胞治疗中的已验证生物标志物,为生物标志物的临床转化提供了重要参考,有望加速细胞治疗的精准化进程。
