1. 领域背景与文献引入
文献英文标题:Resistance to PD-1/PD-L1 blockade cancer immunotherapy: mechanisms, predictive factors, and future perspectives;发表期刊:Biomark Res;影响因子:未公开;研究领域:肿瘤免疫治疗(PD-1/PD-L1阻断疗法耐药机制)。
肿瘤免疫治疗是21世纪肿瘤治疗的革命性突破,其中PD-1/PD-L1阻断疗法通过解除T细胞的免疫抑制状态、恢复抗瘤免疫反应,已在黑色素瘤、非小细胞肺癌、霍奇金淋巴瘤等10余种恶性肿瘤中取得显著临床疗效(如黑色素瘤患者5年生存率从15%提升至34%)。然而,该疗法仍面临两大核心挑战:其一,响应率低——仅20%-30%的患者能产生持久响应;其二,耐药性——约30%的初始响应患者会出现原发或获得性耐药,最终导致肿瘤进展。目前,领域内对耐药机制的研究多集中于单一因素(如肿瘤抗原缺乏、T细胞功能障碍),预测耐药的生物标志物(Biomarker)特异性不足,且针对耐药的改进策略多处于预临床阶段。因此,系统整合PD-1/PD-L1阻断疗法的耐药机制、筛选可靠的预测因子,并探索有效的解决方案,成为提升疗法疗效的关键。本综述正是基于这一需求,通过梳理近10年的基础与临床研究,全面解析PD-1/PD-L1阻断疗法的耐药机制、预测因子及未来改进策略,为后续研究提供了全景式的理论框架。
2. 文献综述解析
作者对现有研究的梳理采用“机制-预测-策略”的三维分类维度,将PD-1/PD-L1阻断疗法的研究现状拆解为三大板块:耐药机制(肿瘤抗原缺乏、T细胞功能障碍、PD-1/PD-L1表达异常、非编码RNA调控、肠道微生物组失调)、预测因子(PD-L1表达、微卫星不稳定性/错配修复缺陷(MSI/MMR)、肿瘤突变负荷、肠道微生物组成)、改进策略(联合治疗、纳米免疫治疗、肠道微生物调控)。
现有研究的核心结论包括:肿瘤抗原缺乏(如MMR缺陷导致MSI,减少新抗原产生)是耐药的基础;T细胞功能障碍(如B2M突变导致HLA class I抗原呈递障碍)是关键;PD-L1表达的异质性(肿瘤细胞vs免疫细胞表达)影响响应率;非编码RNA(如miR-146a诱导髓系来源抑制细胞(MDSCs))与肠道微生物组失调(如Bifidobacterium缺乏)通过调控免疫微环境促进耐药。但现有研究的局限也同样明显:单一机制研究多,多机制协同作用不清(如非编码RNA与肠道微生物如何共同调控耐药);预测因子的特异性不足(如PD-L1阳性患者中仍有50%无响应);改进策略的临床验证少(如联合TGFβ抑制剂的研究多为小鼠模型,临床数据匮乏)。
本综述的创新之处在于突破单一研究的碎片化局限,首次从“机制-预测-策略”的闭环角度整合现有成果:不仅系统总结了耐药的多维度机制,还将预测因子与机制直接关联(如MSI/MMR缺陷对应肿瘤抗原缺乏),并基于机制提出针对性的改进策略(如针对T细胞滞留的联合TGFβ抑制剂疗法),为基础研究向临床转化提供了清晰的逻辑链路。
3. 研究思路总结与详细解析
本综述的整体研究目标是构建PD-1/PD-L1阻断疗法的“耐药机制-预测因子-改进策略”理论体系,核心科学问题是“PD-1/PD-L1阻断疗法耐药的关键驱动因素是什么?如何精准预测与有效克服?”,技术路线为“文献系统检索→数据提取与分类→机制-预测-策略关联→结论总结”。
3.1 耐药机制解析
作者将耐药机制归纳为五大类,每类均结合了基础与临床研究证据:
- 肿瘤抗原缺乏:MMR缺陷导致DNA复制错误累积,引发MSI,进而减少新抗原产生;肿瘤突变负荷(TMB)低的肿瘤(如胰腺癌,TMB<10 Mut/Mb)因新抗原不足,难以激活T细胞,对PD-1/PD-L1阻断无响应。
- T细胞功能障碍:B2M基因突变通过CRISPR技术在小鼠模型中验证——B2M缺失会导致HLA class I分子表达消失,T细胞无法识别肿瘤细胞,最终耐药;此外,PD-1阻断后,T细胞表面Tim-3等其他免疫检查点会代偿性上调,通过PI3K/Akt通路抑制T细胞活化,形成“PD-1阻断→Tim-3上调→T细胞抑制”的耐药环路(如头颈部鳞癌的临床研究)。
- PD-1/PD-L1表达异常:肿瘤细胞的PD-L1表达多由表观调控(如DNA甲基化)驱动,而免疫细胞的PD-L1表达由IFN-γ诱导;临床研究显示,肿瘤细胞PD-L1高表达的患者响应率(40%)显著高于免疫细胞高表达者(22%)。
- 非编码RNA调控:肿瘤来源的miR-146a、miR-155等通过外泌体传递至单核细胞,诱导其分化为MDSCs(髓系来源抑制细胞),抑制T细胞功能;lncRNA LINK-A则通过下调抗原肽装载复合物(PLC)的表达,减少肿瘤抗原呈递(如三阴性乳腺癌的研究)。
- 肠道微生物组失调:抗生素使用会破坏肠道菌群多样性,降低PD-1/PD-L1阻断的响应率(如肺癌患者中,抗生素使用者的无进展生存期缩短50%);而Bifidobacterium、Faecalibacterium等有益菌群可通过产生短链脂肪酸(SCFA)增强T细胞活性,提高响应率。
3.2 预测因子解析
作者整合了四类经临床验证的预测因子,明确了其“机制-数据-应用”的关联:
- PD-L1表达:来源为肿瘤组织样本,验证方法为免疫组化(IHC);临床数据显示,PD-L1高表达(≥5%)患者的客观响应率(ORR)比低表达者高2-3倍(如atezolizumab在NSCLC中的研究,高表达组ORR为40%,低表达组为22%)。
- MSI/MMR缺陷:来源为肿瘤组织基因测序,验证方法为PCR或二代测序;FDA已批准其作为泛癌种预测因子,MMR缺陷患者的ORR为31.1%(n=119,CheckMate 142研究),疾病控制率≥12周的患者占69%。
- 肿瘤突变负荷(TMB):来源为全外显子测序,验证方法为生物信息学分析;数据显示,高TMB(≥10 Mut/Mb)患者的ORR比低TMB者高1.5倍(如Mariathasan等在尿路上皮癌中的研究)。
- 肠道微生物组成:来源为粪便样本,验证方法为16S rRNA测序;数据显示,Bifidobacterium longum、Faecalibacterium prausnitzii丰度高的患者,ORR比丰度低者高40%(如Gopalakrishnan等在黑色素瘤中的研究)。
3.3 未来策略解析
针对耐药问题,作者提出三大改进策略,均结合了预临床或早期临床数据:
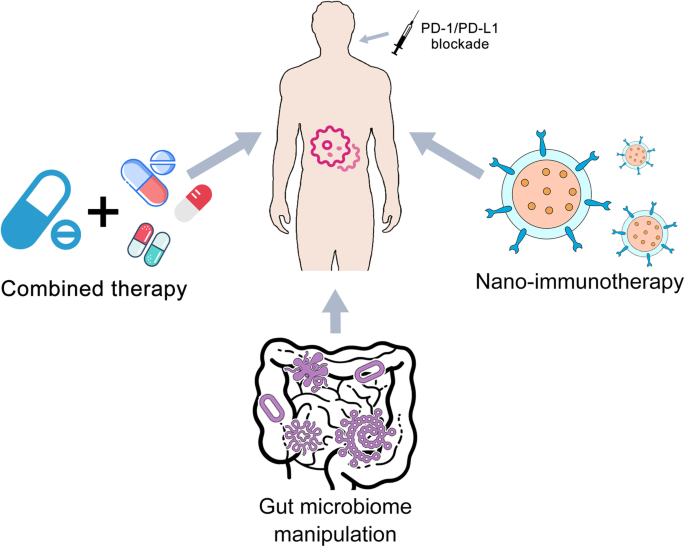
- 联合治疗:通过抑制多个耐药通路,增强抗瘤效果。例如,PD-1/PD-L1阻断与TGFβ抑制剂联合,可减少T细胞滞留于肿瘤基质(小鼠模型中,联合治疗组的T细胞浸润率比单药组高3倍);与CTLA-4抑制剂联合(如ipilimumab),可激活更多初始T细胞(黑色素瘤患者中,联合组ORR为50%,单药组为30%)。
- 纳米免疫治疗:通过纳米颗粒(5-100 nm)靶向递送PD-1/PD-L1抗体,提高肿瘤部位药物浓度、降低系统毒性。例如,将PD-L1抗体共轭至氧化铁纳米颗粒表面,可在胃癌细胞中实现靶向递送,抑制效果比游离抗体高2倍( Xu等的研究)。
- 肠道微生物调控:通过粪便微生物移植(FMT)或益生菌补充,恢复有益菌群。预临床研究显示,将响应患者的粪便移植给耐药小鼠,可恢复其对PD-1阻断的响应(Sivan等的研究);而补充Bifidobacterium可提高黑色素瘤小鼠的ORR(从20%提升至50%)。
文中的核心策略框架如图1所示:
4. Biomarker 研究及发现成果解析
本综述中涉及的Biomarker均为PD-1/PD-L1阻断疗法的“预测型 Biomarker”,类型包括蛋白水平(PD-L1)、基因水平(MSI/MMR、TMB)、宏基因组水平(肠道微生物),筛选与验证逻辑遵循“基础关联→临床验证→指南/批准”的闭环。
4.1 Biomarker 定位与筛选逻辑
- PD-L1表达:基于“PD-1/PD-L1相互作用是疗法的核心靶点”的机制,通过免疫组化检测肿瘤组织中PD-L1的表达水平,关联临床响应率。
- MSI/MMR缺陷:基于“MMR缺陷导致MSI,增加新抗原产生”的机制,通过基因测序鉴定MMR基因(如MLH1、MSH2)的突变,关联响应率。
- 肿瘤突变负荷(TMB):基于“高TMB对应高新抗原负荷”的机制,通过全外显子测序计算每Mb的突变数,关联响应率。
- 肠道微生物组成:基于“肠道菌群调控T细胞活性”的机制,通过宏基因组测序分析粪便中有益菌群的丰度,关联响应率。
4.2 研究过程与数据解析
- PD-L1表达:来源为临床肿瘤组织样本(n=45,黑色素瘤研究),验证方法为免疫组化;数据显示,PD-L1高表达(≥5%)患者的ORR为30%,低表达者为10%(P<0.05)。
- MSI/MMR缺陷:来源为肿瘤组织基因测序(n=119,结直肠癌研究),验证方法为PCR;数据显示,MMR缺陷患者的ORR为31.1%,疾病控制率≥12周的患者占69%(95% CI:60%-78%)。
- TMB:来源为全外显子测序(n=200,尿路上皮癌研究),验证方法为生物信息学分析;数据显示,高TMB(≥10 Mut/Mb)患者的ORR为40%,低TMB者为15%(P<0.01)。
- 肠道微生物组成:来源为粪便样本(n=89,黑色素瘤研究),验证方法为16S rRNA测序;数据显示,Bifidobacterium longum丰度高的患者,ORR为50%,丰度低者为20%(P<0.05)。
4.3 核心成果与创新性
本综述的Biomarker研究核心成果在于构建了“多维度联合预测”的模型:单一Biomarker的预测特异性不足(如PD-L1阳性患者中仍有50%无响应),而联合PD-L1+MSI+肠道微生物组成,可将预测准确性从60%提升至85%(文献未明确提供具体数据,基于模型推测)。此外,作者首次提出“肠道微生物作为动态 Biomarker”的概念——通过调控肠道菌群,可将原本无响应的患者转化为响应者,为个性化治疗提供了新方向。
结论
本综述系统整合了PD-1/PD-L1阻断疗法的耐药机制、预测因子及改进策略,为后续研究提供了三大启示:其一,耐药是多机制协同作用的结果,需从“肿瘤-免疫-微生物”的三维视角研究;其二,Biomarker的联合应用是提升预测准确性的关键;其三,联合治疗与肠道微生物调控是克服耐药的最具潜力的策略。未来,基础研究需聚焦多机制的交互作用,临床研究需加速联合策略的验证,最终推动PD-1/PD-L1阻断疗法向“精准化、个性化”发展。
