1. 领域背景与文献引入
文献英文标题:Antiangiogenic therapy reverses the immunosuppressive breast cancer microenvironment;发表期刊:Biomark Res;影响因子:未公开;研究领域:乳腺癌肿瘤微环境、抗血管生成治疗与免疫治疗交叉领域
乳腺癌是全球女性最常见的恶性肿瘤之一,其中三阴性乳腺癌(TNBC)因缺乏激素受体和HER2表达,临床预后最差。近年来,免疫检查点抑制剂(ICB)为乳腺癌治疗带来突破,但仅10–30%的患者能从ICB中获益(文献引用),核心瓶颈在于肿瘤微环境(TME)的免疫抑制性:肿瘤血管异常(结构紊乱、灌注不足)导致局部缺氧、酸性环境,抑制树突状细胞(DC)成熟和细胞毒性T淋巴细胞(CTL)浸润;同时,血管内皮细胞表达程序性死亡配体1(PD-L1)、Fas配体(FasL)等分子,选择性抑制CTL功能并促进调节性T细胞(Tregs)活化(文献引用)。
抗血管生成治疗通过“血管正常化”(prune不成熟血管、改善血管结构与灌注)缓解TME缺氧,理论上可增强免疫细胞浸润,但单独使用抗血管生成药物(如贝伐珠单抗)在乳腺癌中的总生存(OS)获益有限(文献引用)。因此,抗血管生成治疗与免疫治疗的联合策略成为研究热点——前者改善TME的“免疫可及性”,后者激活抗瘤免疫,二者协同有望突破单药局限。
本文的研究初衷是系统解析抗血管生成治疗逆转乳腺癌免疫抑制性TME的分子与细胞机制,梳理联合免疫治疗的临床证据与生物标志物,为优化乳腺癌治疗策略提供理论支持。
2. 文献综述解析
文献综述采用“TME免疫抑制特征→血管生成与免疫的交互作用→现有治疗的局限→联合治疗的潜力”的逻辑框架,对领域研究进行分类总结:
(1)TME免疫抑制的核心驱动因素
文献将乳腺癌TME的免疫抑制归因于两大相互关联的机制:① 血管异常:肿瘤血管结构紊乱、通透性增加导致缺氧,抑制DC成熟和CTL活化,同时血管内皮细胞表达PD-L1/FasL直接抑制T细胞;② 免疫细胞的促血管生成与免疫抑制作用:肿瘤相关巨噬细胞(TAMs)向M2型极化,分泌VEGF、CXCL8促进血管生成并抑制免疫;Tregs通过分泌VEGF和抑制Th1细胞促进血管生成;髓源性抑制细胞(MDSCs)分泌VEGF、MMP9增强血管生成并抑制T细胞;癌相关成纤维细胞(CAFs)分泌VEGF、CXCL12、podoplanin等促进血管生成和免疫抑制(文献引用)。
(2)现有研究的局限
既往研究多聚焦于“单因素”调控(如单独抗血管生成或单独免疫治疗),存在三大不足:① 单独抗血管生成治疗的“血管正常化窗口”短(数周至数月),易出现耐药;② 单独免疫治疗受限于TME的免疫抑制状态,响应率低;③ 联合治疗的机制研究多集中在其他癌种(如肝癌、肺癌),乳腺癌中的数据有限,且缺乏针对“剂量、时序、生物标志物”的系统探索(文献引用)。
(3)文献的创新价值
本文的核心创新是构建了“血管生成-免疫抑制”的双向调控网络,明确抗血管生成治疗通过“改善血管结构→缓解缺氧→调控免疫细胞功能”逆转TME免疫抑制,并系统总结了乳腺癌中联合治疗的preclinical证据(如小鼠模型中联合治疗增加CD8+ T细胞浸润、抑制肿瘤生长)和临床研究(如IMpassion130中atezolizumab联合白蛋白紫杉醇提高PD-L1+ TNBC的响应率),为联合治疗的临床转化提供了理论框架。
3. 研究思路总结与详细解析
本文是一篇机制性综述,研究目标是“阐述抗血管生成治疗逆转乳腺癌免疫抑制性TME的机制及联合免疫治疗的潜力”,核心科学问题包括:① 血管生成异常如何驱动乳腺癌TME免疫抑制?② 抗血管生成治疗如何逆转这一过程?③ 联合免疫治疗的协同机制是什么?
技术路线遵循“现状总结→机制解析→证据整合→展望”的闭环逻辑,分三部分展开:
3.1 TME免疫抑制特征与血管生成的交互作用
实验目的:明确乳腺癌TME中免疫抑制与血管生成的相互关系。
方法细节:通过回顾100余篇基础与临床研究,分析“血管异常”与“免疫细胞功能”的双向调控:① 血管异常通过缺氧诱导HIF-1α表达,促进TAMs向M2型极化、Tregs浸润和CAFs活化;② 免疫细胞分泌的VEGF、ANG2、CXCL12等分子进一步加剧血管异常,形成“血管生成-免疫抑制”正反馈 loop。
结果解读:血管异常是TME免疫抑制的“始动因素”,而免疫细胞的促血管生成作用则放大了这一效应。例如,M2型TAMs分泌的VEGF促进血管生成,而血管异常导致的缺氧又进一步促进M2型极化;CAFs分泌的VEGF通过激活VEGFR2信号促进血管内皮细胞增殖,同时分泌的CXCL12招募MDSCs抑制免疫(文献引用)。
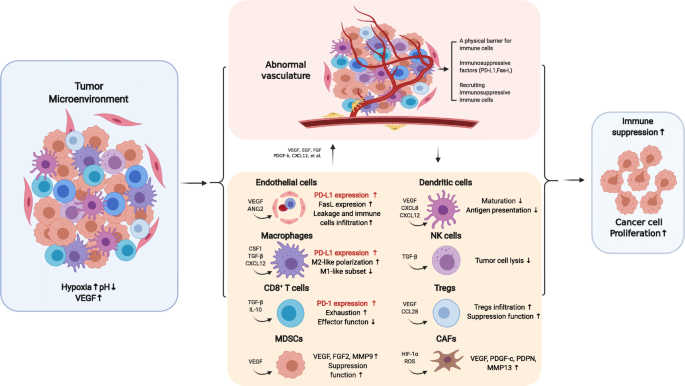
图1展示了“血管生成-免疫抑制”的正反馈 loop:肿瘤血管结构紊乱导致缺氧,促进TAMs向M2型极化、Tregs/MDSCs浸润、CAFs活化;这些免疫细胞分泌VEGF、ANG2等分子进一步加剧血管异常,最终形成免疫抑制性TME。
3.2 抗血管生成治疗对免疫抑制TME的逆转机制
实验目的:探讨抗血管生成治疗逆转免疫抑制性TME的分子与细胞机制。
方法细节:综述VEGF抑制剂(如贝伐珠单抗)、ANG2抑制剂(如trebananib)等抗血管生成药物的作用:① 血管正常化:prune不成熟血管,改善血管结构与灌注,缓解缺氧;② 免疫细胞调控:促进DC成熟和抗原提呈,增加CD8+ T细胞浸润,将M2型TAMs转为M1型(分泌IL-12、TNF-α抑制血管生成),减少Tregs和MDSCs的数量与功能(文献引用)。
结果解读:抗血管生成治疗通过“血管正常化”打破“血管生成-免疫抑制” loop,将TME从“免疫抑制”转为“免疫支持”。例如,VEGF抑制剂通过阻断VEGF/VEGFR1通路促进DC成熟,增加CTL浸润;ANG2抑制剂通过阻断ANG2/TIE2通路抑制TAMs的促血管生成作用,同时增加ICAM1/VCAM1表达促进T细胞跨内皮迁移(文献引用)。
3.3 抗血管生成联合免疫治疗的协同效应及临床证据
实验目的:评估抗血管生成联合免疫治疗的协同机制及临床疗效。
方法细节:分析preclinical模型(如小鼠乳腺癌模型)和临床研究(如IMpassion130、KEYNOTE-355)的结果:① 协同机制:抗血管生成治疗改善血管正常化,为免疫细胞浸润提供“通道”;免疫治疗激活的CTL进一步促进血管正常化(如分泌IFN-γ抑制VEGF表达),形成“免疫激活-血管正常化”正反馈;② 临床疗效:联合治疗在TNBC中提高了客观缓解率(ORR)和无进展生存(PFS),如IMpassion130中atezolizumab联合白蛋白紫杉醇在PD-L1+ TNBC中的ORR达53%(单药组为33%)(文献引用)。
结果解读:联合治疗的协同效应显著优于单药,且抗血管生成治疗可降低免疫治疗的不良反应(如减少免疫相关肺炎、结肠炎的发生率)(文献引用)。
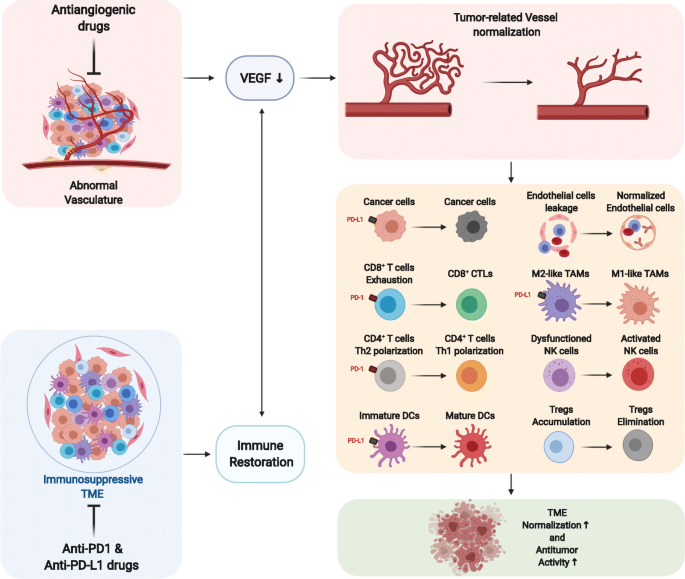
图2展示了联合治疗的核心机制:抗血管生成治疗促进血管正常化,改善TME灌注与氧合;免疫治疗激活CTL并增加其浸润;二者协同抑制肿瘤生长,同时减少免疫相关不良反应。
4. Biomarker研究及发现成果
(1)Biomarker定位与筛选逻辑
文献涉及的Biomarker分为三类:① 血清生物标志物(反映血管与免疫状态):ANG2、VEGF-A;② 组织生物标志物(反映TME特征):PD-L1、肿瘤突变负荷(TMB)、高内皮静脉(HEVs);③ 功能影像学标志物(反映血管灌注):动态增强MRI(DCE-MRI)、动态光学乳腺成像(DOBI)。筛选逻辑为“基础研究发现→临床研究验证→关联治疗响应”。
(2)研究过程与核心成果
- 血清ANG2:作为血管成熟的关键因子,ANG2水平与免疫治疗响应负相关(黑色素瘤研究中,ANG2高表达者免疫治疗无响应,OS更短)(文献引用);
- 血清VEGF-A:与抗血管生成治疗的疗效相关,治疗后VEGF-A下降提示血管正常化(文献引用);
- 组织PD-L1:免疫细胞上的PD-L1表达(而非肿瘤细胞)与联合治疗响应正相关(如IMpassion130中PD-L1+患者的ORR更高)(文献引用);
- HEVs:肿瘤中HEVs的存在提示良好的免疫细胞浸润(如表达CCL21促进T细胞归巢),预测联合治疗的响应率(文献引用);
- TMB:TMB高的肿瘤(如TNBC)对联合治疗更敏感,因突变负荷高导致 neoantigen 多,易激活CTL(文献引用)。
(3)创新性与局限性
创新性:文献首次系统梳理了乳腺癌中联合治疗的生物标志物,提出“血清ANG2+组织HEVs+PD-L1”的组合 biomarker 可预测联合治疗响应;局限性:现有生物标志物多来自小样本研究,缺乏大样本验证,且功能影像学标志物的临床应用仍需标准化。
综上,本文通过系统解析“血管生成-免疫抑制”的交互作用,为抗血管生成联合免疫治疗提供了理论基础,同时指出生物标志物的开发是未来临床转化的关键方向。
