1. 领域背景与文献引入
文献英文标题:The role of biomarkers in personalized immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(精准免疫肿瘤学)。
过去十年,免疫检查点抑制剂(ICI)如抗CTLA-4、抗PD-1/PD-L1抗体彻底改变了晚期恶性肿瘤的治疗范式,显著延长了黑色素瘤、非小细胞肺癌(NSCLC)等患者的生存期。然而,ICI治疗的临床响应率差异极大(部分肿瘤响应率不足20%),且存在免疫相关不良反应(irAEs)风险,因此亟需高敏感性和特异性的生物标志物来筛选获益人群、预测疗效及指导治疗决策。当前领域的核心挑战包括:(1)单一生物标志物(如PD-L1)的预测价值有限(仅28.9%的FDA批准适应症中PD-L1具有预测性);(2)肿瘤内/间异质性、肿瘤微环境(TME)复杂性及宿主免疫状态差异导致生物标志物解读困难;(3)耐药机制(原发性/获得性)未完全阐明,缺乏针对耐药人群的生物标志物指导组合治疗。
本综述旨在系统总结已获批生物标志物(如PD-L1、肿瘤突变负荷(TMB)、微卫星不稳定性(MSI))、实验性生物标志物(如肿瘤浸润淋巴细胞(TILs)、基因表达谱(GEP)、循环肿瘤DNA(ctDNA))及新兴技术(如单细胞RNA测序(scRNA-seq))在ICI治疗中的作用,探讨组合生物标志物策略的价值,为精准免疫肿瘤学的发展提供框架。
2. 文献综述解析
作者通过“已获批生物标志物-实验性生物标志物-耐药机制-组合策略-新兴技术”的逻辑框架,对现有研究进行分类评述:
(1)现有研究的核心结论与局限
- 已获批生物标志物:PD-L1(IHC检测,通过肿瘤比例评分(TPS)或联合阳性评分(CPS)评估)是目前应用最广的预测标志物,但存在“假阴性”(基线PD-L1阴性患者仍可能响应)和“假阳性”(PD-L1高表达者可能耐药)问题;MSI-H/dMMR(通过PCR或NGS检测)是首个“泛癌种” biomarker,2017年FDA批准 pembrolizumab用于MSI-H/dMMR晚期肿瘤;TMB(通过WES或NGS panel评估,≥10 mutations/megabase为高值)2020年获批用于经治晚期实体瘤。
- 实验性生物标志物:TILs密度(“免疫炎症型”TME与更好疗效相关)、GEP(IFN-γ基因签名预测PD-1抑制剂响应)、微生物组( Akkermansia 丰度与响应相关)等显示出潜力,但存在检测标准化不足(如TILs的空间异质性)、技术局限性(如GEP无法解析细胞空间关系)等问题。
- 外周血生物标志物:ctDNA(早期下降与响应相关)、可溶性PD-L1(sPD-L1,基线低水平与更长生存期相关)、中性粒细胞/淋巴细胞比值(NLR,低比值与更好疗效相关)等因非侵入性优势受关注,但缺乏大样本验证。
(2)本综述的创新价值
现有研究多聚焦单一生物标志物,而本综述的核心贡献在于:(1)整合“组织-外周血-新兴技术”的多维度生物标志物,系统分析其互补价值;(2)提出组合生物标志物策略(如PD-L1+TMB、PD-L1+CD8+ TILs),解决单一标志物的局限性;(3)关联生物标志物与耐药机制(如肿瘤 intrinsic 耐药中的抗原缺失、extrinsic 耐药中的TME抑制),为克服耐药提供指导。
3. 研究思路总结与详细解析
本综述为系统性综述,无具体实验环节,作者通过“现状梳理-问题分析-策略提出”的逻辑展开:
3.1 生物标志物分类与临床应用
作者首先将生物标志物分为组织生物标志物(肿瘤组织来源)和外周血生物标志物(血液来源),分别讨论其检测方法、临床价值及局限:
- 组织生物标志物:详细阐述PD-L1的检测方法(如22C3、28-8、SP142抗体)、评分标准(TPS用于NSCLC,CPS用于尿路上皮癌/胃癌);TMB的计算方法(WES vs NGS panel)及临床阈值(≥10 mutations/megabase);MSI的检测技术(IHC/PCR/NGS)及适应症(泛癌种经治患者)。
- 外周血生物标志物:重点讨论ctDNA(通过个性化NGS panel检测,早期突变等位基因分数(MAF)下降≥50%与响应相关)、sPD-L1(ELISA检测,基线低水平与NSCLC患者更长生存期相关)、NLR(预处理低比值与ICI疗效相关)。
3.2 组合生物标志物策略
作者提出“免疫原性+炎症状态”双维度组合策略,例如:
- PD-L1(炎症状态)+ TMB(免疫原性): meta分析显示,两者组合预测NSCLC患者总生存期(OS)的能力优于单一标志物;
- PD-L1 + CD8+ TILs:CD8+ TILs密度与PD-L1表达的乘积(CD8+×PD-L1签名)可显著区分durvalumab治疗患者的OS差异;
- TMB + GEP:基于TMB(高/低)和GEP(炎症/非炎症)将患者分为4组,其中“TMB高+GEP炎症”组响应率最高。
3.3 新兴技术与未来方向
作者强调单细胞多组学(如scRNA-seq)和空间转录组学的潜力:scRNA-seq可解析TME中肿瘤细胞、免疫细胞及 stromal 细胞的转录组特征(如黑素瘤中TCF7+ CD8+ T细胞与响应相关),空间转录组学可补充细胞间的空间关系;同时提出动态监测(如ctDNA的纵向检测)可解决肿瘤进化导致的耐药问题。
文中关键图片:
- 图1:FDA批准肿瘤免疫治疗生物标志物的时间线(如2011年ipilimumab获批,2017年pembrolizumab获批MSI-H适应症)
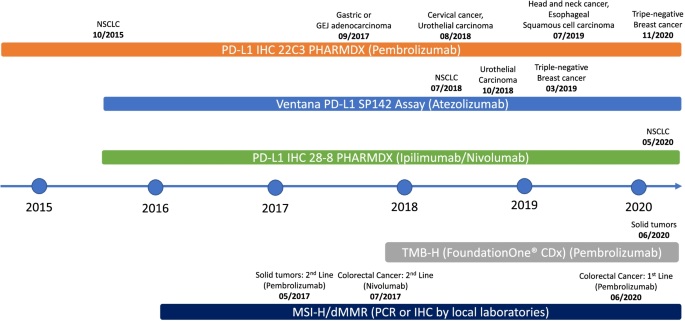
;
- 图2:组合生物标志物策略的逻辑框架(如TMB低+炎症冷肿瘤需联合化疗/放疗激活免疫)
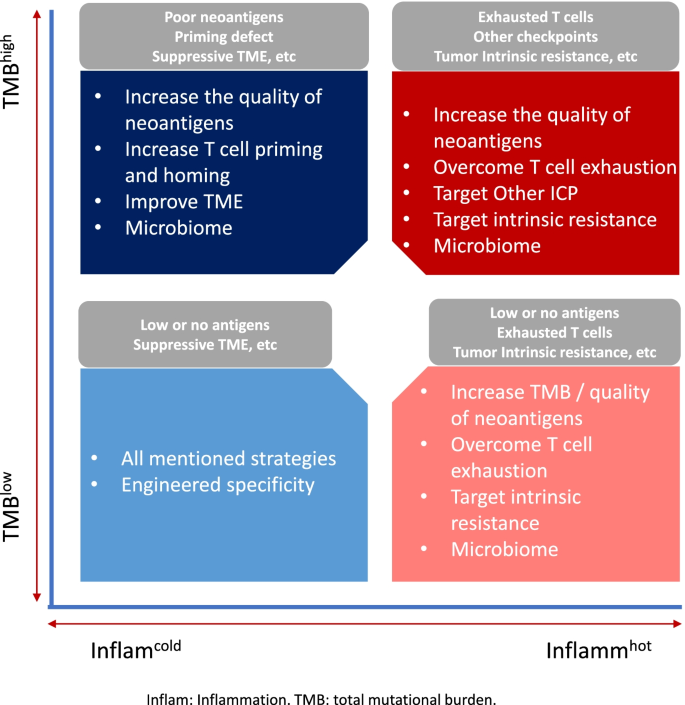
;
- 图3:临床试验中生物标志物的应用策略(如富集策略筛选获益人群,分层策略指导组合治疗)
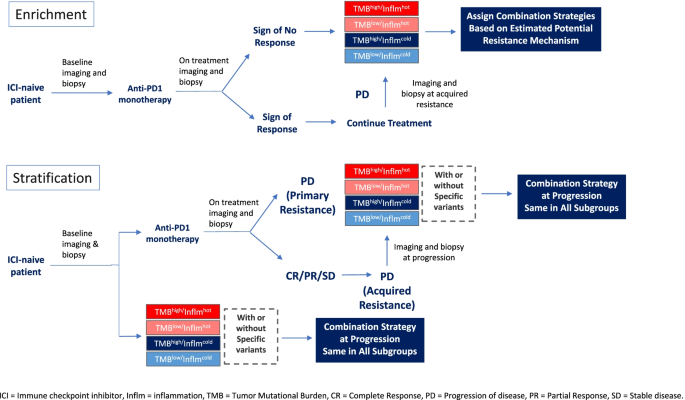
。
4. Biomarker 研究及发现成果解析
(1)核心Biomarker定位与筛选逻辑
文中覆盖的主要生物标志物及特征如下:
| 生物标志物 | 类型 | 来源 | 筛选/验证逻辑 | 关键临床数据 |
|---|---|---|---|---|
| PD-L1 | 组织标志物(蛋白) | 肿瘤组织 | IHC检测→TPS/CPS评分→临床 trial 验证 | NSCLC中TPS≥50%患者pembrolizumab响应率45.2%(n=105,P<0.001);尿路上皮癌CPS≥10%患者响应率29% |
| TMB | 组织标志物(基因组) | 肿瘤组织 | WES/NGS panel计算→cutoff值(≥10 mut/Mb)→验证 | TMB-H患者ICI治疗无进展生存期(PFS)较TMB-L延长2倍(n=255,P=0.003) |
| MSI-H/dMMR | 组织标志物(基因组) | 肿瘤组织 | IHC/PCR/NGS检测→泛癌种验证 | MSI-H患者pembrolizumab响应率40%(n=149,P<0.001),获批一线结直肠癌适应症 |
| TILs | 组织标志物(细胞) | 肿瘤组织 | IHC计数→密度/位置分析→疗效关联 | CD8+ TILs高浸润患者ICI OS延长3个月(n=120,P=0.02) |
| ctDNA | 外周血标志物(核酸) | 外周血 | 个性化NGS panel→纵向监测MAF变化→响应关联 | NSCLC患者ctDNA MAF下降≥50%者OS延长12个月(n=89,P<0.001) |
(2)关键成果与创新性
- PD-L1的标准化:文中总结Blueprint项目结果,指出22C3、28-8抗体在肿瘤细胞PD-L1检测中的高一致性(κ值>0.8),为临床标准化提供依据;
- 组合策略的预测价值:meta分析显示,PD-L1+TMB+CD8+ TILs组合预测NSCLC患者OS的AUC值达0.78(95% CI 0.72-0.84),显著优于单一标志物;
- 新兴生物标志物的潜力:scRNA-seq发现黑素瘤中TCF7+ CD8+ T细胞与ICI响应相关(响应者中占比35% vs 非响应者10%,P=0.01);ctDNA动态监测可早期预测ICI耐药(治疗6周后ctDNA未清除者耐药风险高3倍,n=56,P=0.005)。
(3)局限与展望
作者指出当前生物标志物的局限性:(1)肿瘤异质性(原发灶与转移灶生物标志物不一致);(2)检测标准化不足(如PD-L1抗体的非互换性);(3)动态监测缺乏共识(如ctDNA的检测时间点)。未来方向包括:(1)开发“泛癌种+组织学特异性”组合生物标志物;(2)整合空间转录组与单细胞技术解析TME;(3)开展前瞻性临床试验验证动态监测策略。
本综述通过系统梳理现有与新兴生物标志物,为精准免疫治疗的生物标志物应用提供了全面框架,强调组合策略与动态监测的重要性,对临床实践和未来研究具有重要指导价值。
