1. 领域背景与文献引入
文献英文标题:Structures and biological functions of zinc finger proteins and their roles in hepatocellular carcinoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:肝细胞癌与锌指蛋白功能研究。
锌指蛋白(Zinc Finger Protein, ZFP)是人类基因组中最大的转录因子家族,通过保守的锌指结构域(如C2H2、BTB、KRAB等)结合DNA、RNA或蛋白质,参与转录调控、细胞分化、免疫反应等多种生物学过程。肝细胞癌(Hepatocellular Carcinoma, HCC)是全球第三大癌症相关死亡原因,约占原发性肝癌的75%-80%,其早期症状隐匿,诊断困难,尽管手术、化疗、靶向治疗等手段不断发展,患者5年生存率仍不足20%,且发病机制尚未完全阐明。
近年来,锌指蛋白在癌症中的作用受到广泛关注,但针对肝细胞癌的系统研究较少,多数研究聚焦于单个锌指蛋白的功能,缺乏对其结构-功能关联及不同阶段作用的整合分析。因此,本文综述锌指蛋白的结构分类、生物学功能及其在肝细胞癌中的作用机制,为肝细胞癌的分子机制研究和治疗靶点开发提供参考。
2. 文献综述解析
本文以“结构-功能-疾病关联”为核心逻辑,将现有研究分为锌指蛋白的结构分类、生物学功能、肝细胞癌中的作用机制三个模块,系统总结了锌指蛋白的结构多样性如何决定其功能多样性,以及这些功能如何转化为对肝细胞癌发生发展的调控作用。
现有研究的关键结论
- 结构域功能:锌指蛋白的结构域决定其功能特性——BTB域参与转录抑制和蛋白降解,SCAN域促进蛋白寡聚化,KRAB域抑制转座元件,SET域参与甲基化修饰,C2H2域是主要的核酸结合域。
- 生物学功能:锌指蛋白通过转录调控(如ZEB1促进HDGF转录)、蛋白-蛋白互作(如SMRZ与SMT3b结合调控肌细胞周期)、转录后调控(如Regnase-1降解mRNA调节造血干细胞稳态)多层面调控基因表达。
- 肝细胞癌中的作用:锌指蛋白通过调控细胞周期(ZNF384促进Cyclin D1表达)、凋亡(ZNF307上调caspase-3)、干细胞特性(ZFX维持肿瘤干细胞自我更新)、EMT(ZEB1促进迁移)、代谢重编程(ZFP91抑制糖酵解)、炎症反应(Miz1抑制巨噬细胞活化)等过程影响肝癌进展;部分锌指蛋白(如ZNF191)在早期促进增殖、晚期抑制转移,表现出双向作用。
现有研究的局限性与本文创新价值
现有研究的局限性在于:缺乏对结构域功能的系统解析、不同锌指蛋白的协同/拮抗作用尚不明确、临床转化证据不足。本文的创新价值在于首次系统整合锌指蛋白的结构-功能关系与肝细胞癌的关联,强调结构域多样性对功能的影响,并指出部分锌指蛋白的双向作用可能成为肝癌分期治疗的靶点(如ZNF191的阶段特异性作用)。
3. 研究思路总结与详细解析
本文采用“从结构到功能,从正常到疾病”的组织思路,先介绍锌指蛋白的结构分类及功能,再总结其在正常细胞中的生物学功能,最后聚焦肝细胞癌解析其作用机制。
3.1 锌指蛋白的结构分类及功能
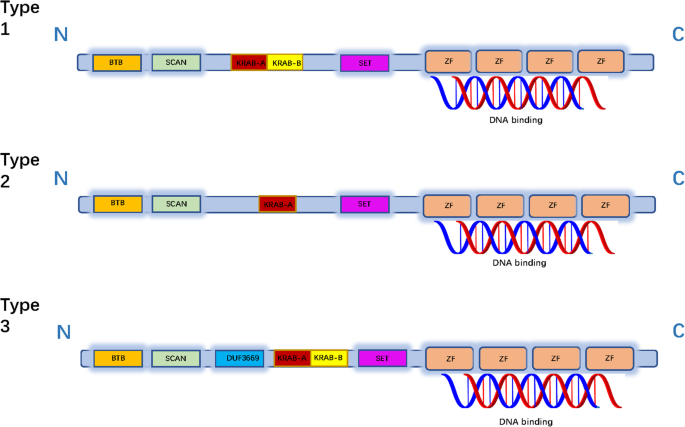
本部分目的是阐明锌指蛋白的结构多样性与功能多样性的关联,作者通过综述现有研究,将锌指蛋白的结构域分为BTB、SCAN、KRAB、SET、C2H2等类型,并详细描述各结构域的功能:
- BTB域:高度保守的蛋白-蛋白相互作用域,参与转录抑制、细胞骨架动态调控;
- SCAN域:富含亮氨酸,通过与其他SCAN域蛋白结合形成寡聚体,增强转录活性;
- KRAB域:主要存在于四足动物中,通过招募共抑制因子抑制转座元件活性;
- SET域:参与组蛋白或非组蛋白的甲基化修饰,调控基因表达;
- C2H2域:最常见的锌指结构域,通过CX2CX3FX5LX2HX3H序列结合DNA、RNA或蛋白质,是转录调控的核心结构域。
这些结构域的功能总结如图1所示:
3.2 锌指蛋白的生物学功能
本部分目的是总结锌指蛋白在正常细胞中的核心功能,作者分类综述了转录调控、蛋白-蛋白互作、转录后调控三个方面:
- 转录调控:锌指蛋白最主要的功能,通过直接结合靶基因启动子激活/抑制转录(如ZEB1促进HDGF转录,ZNF322A抑制c-Myc转录);
- 蛋白-蛋白互作:通过结构域与其他蛋白结合调控细胞过程(如SMRZ通过RING域与SMT3b结合调控肌细胞周期);
- 转录后调控:通过结合mRNA的3’UTR区域影响其稳定性或剪接(如Regnase-1降解Gata2 mRNA调节造血干细胞稳态)。
3.3 锌指蛋白在肝细胞癌中的作用机制
本部分目的是解析锌指蛋白如何调控肝细胞癌的发生发展,作者按肿瘤的关键生物学过程分类,详细描述了以下机制:
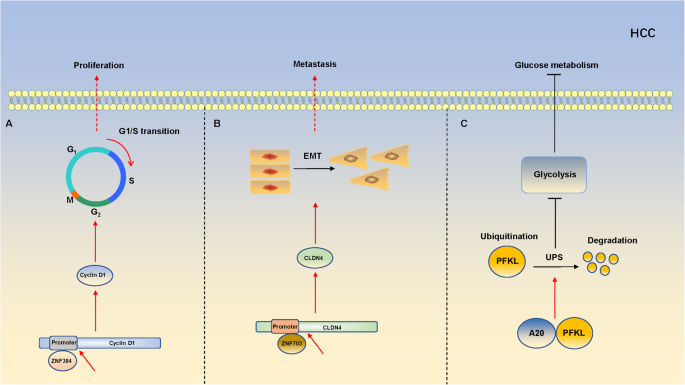
(1)细胞周期调控
ZNF143激活MDIG降低H3K9me3,促进CDC6表达;ZNF384结合Cyclin D1启动子,加速G1/S期转换,促进肝癌细胞增殖。
(2)凋亡调控
ZNF307上调caspase-3和Bax(促凋亡蛋白),下调Bcl-2(抗凋亡蛋白),促进肝癌细胞凋亡;ZNF263通过ER应激依赖的自噬抑制凋亡,增强抗药性。
(3)干细胞特性维持
ZFX直接结合Nanog和SOX-2的启动子,激活其转录,维持肝癌干细胞的自我更新和化疗耐药性;ZFX高表达与患者不良预后相关。
(4)EMT与转移
ZEB1增强Wnt信号通路活性,促进肝癌细胞迁移;ZNF703结合CLDN4启动子,上调其表达,促进EMT和索拉非尼耐药,高表达ZNF703的患者预后较差。
(5)代谢重编程
ZFP91促进hnRNP A1的Lys48连接泛素化降解,抑制其依赖的PKM剪接,导致PKM2水平下降,抑制糖酵解和肝癌细胞增殖;A20与PFKL结合,促进其泛素化降解,抑制糖酵解。
(6)炎症反应抑制
Miz1通过两种机制抑制炎症:一是在细胞溶质中与MTDH竞争结合RelA,抑制NF-κB激活;二是减少肝细胞分泌TNF-α、IL-1β等细胞因子,抑制巨噬细胞促炎表型转换。
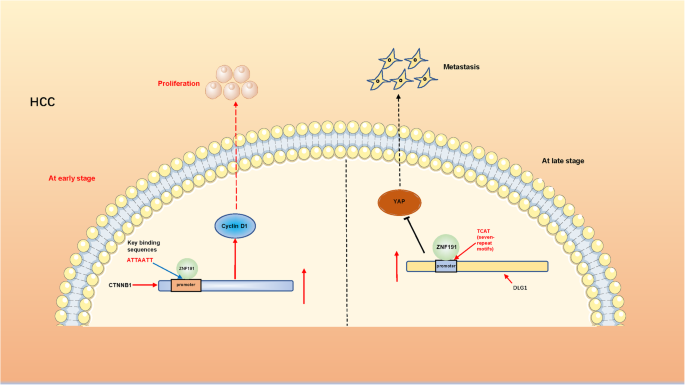
(7)双向作用(ZNF191)
ZNF191在肝癌早期结合β-catenin启动子,激活其转录,促进增殖;晚期结合DLG1启动子,激活其表达,抑制YAP活性和转移(如图3所示)。
上述机制总结如图2所示:
4. Biomarker研究及发现成果解析
本文中涉及的Biomarker主要是具有预后价值的锌指蛋白,筛选逻辑基于临床样本的表达水平与预后的相关性分析,部分Biomarker还关联免疫浸润特征。
Biomarker定位与研究过程
- ZBTB20:高表达ZBTB20的肝癌患者临床预后差、复发率高,机制与促进肝内脂肪生成有关;
- ZNF689:高表达ZNF689的患者生存期短、复发率高,可能通过调控细胞周期促进肿瘤进展;
- ZIC2:最新研究表明,ZIC2表达水平可预测肝癌患者预后,且与免疫浸润细胞(如CD8+ T细胞、巨噬细胞)正相关,提示其可能作为免疫治疗靶点;
- ZNF191:由于其在肝癌不同阶段的双向作用,ZNF191的表达水平可能作为分期标志物——早期高表达提示增殖活跃,晚期高表达提示转移风险降低。
核心成果提炼
这些锌指蛋白作为肝细胞癌的预后Biomarker具有以下特点:
- 预后相关性:ZBTB20、ZNF689高表达与不良预后相关;
- 免疫关联:ZIC2与免疫浸润正相关,为免疫治疗提供靶点;
- 阶段特异性:ZNF191的双向作用为分期治疗提供依据。
然而,目前多数Biomarker的验证样本量较小,缺乏多中心、大样本的临床研究,其特异性和敏感性(如ROC曲线下面积)尚未明确,需进一步验证(如ZIC2的预后价值需在更大队列中确认)。
关键图片展示
图1:锌指蛋白结构域功能示意图

图2:锌指蛋白调控肝癌的机制示意图

图3:ZNF191在肝癌不同阶段的双向作用示意图
结论:锌指蛋白作为关键转录因子,在肝细胞癌的发生发展中发挥重要作用,其结构-功能关系及阶段特异性作用为肝癌的分子诊断和靶向治疗提供了新方向。未来需开展更多系统研究,验证其临床应用价值。
