1. 领域背景与文献引入
文献英文标题:Identification of the source of elevated hepatocyte growth factor levels in multiple myeloma patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤(血液系统恶性肿瘤)。
多发性骨髓瘤(multiple myeloma, MM)是起源于浆细胞的恶性血液肿瘤,恶性浆细胞(CD138+细胞)依赖骨髓微环境存活,并通过改变微环境细胞因子分泌促进疾病进展。肝细胞生长因子(hepatocyte growth factor, HGF)是一种多效细胞因子,通过结合其受体c-MET诱导肿瘤细胞增殖、迁移及耐药。既往研究显示,约50% MM患者血清及骨髓HGF水平显著升高,且与不良预后密切相关,但HGF的主要来源(恶性浆细胞或骨髓微环境细胞)及调控机制尚未明确,这一空白限制了HGF作为MM预后生物标志物(Biomarker)及治疗靶点的临床应用。本文针对这一核心问题,通过多层面实验明确MM患者中HGF的细胞来源,并揭示骨髓微环境对HGF分泌的调控作用。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“HGF在MM中的功能与来源争议”展开:
1. HGF的功能共识:已有研究证实HGF/c-MET信号通路可促进MM细胞增殖、存活及骨髓归巢,且血清HGF水平升高与MM患者化疗耐药、生存期缩短相关;
2. 来源争议:既往推测HGF可能由骨髓基质细胞(bone marrow stromal cells, BMSC)或恶性浆细胞产生,但缺乏直接证据;
3. 研究局限:未系统分析HGF来源的细胞特异性,也未探讨基因异常(如扩增、突变)或微环境对HGF分泌的调控作用。
本文的创新价值在于:首次通过临床样本与细胞实验结合,明确MM患者中HGF主要由CD138+恶性浆细胞产生,并揭示骨髓微环境通过可溶性因子及细胞接触协同促进HGF分泌,填补了HGF来源及调控机制的研究空白。
3. 研究思路总结与详细解析
3.1 HGF mRNA在骨髓活检与CD138+细胞中的表达分析
实验目的:比较健康人群与MM患者骨髓组织及恶性浆细胞中HGF mRNA水平,明确HGF表达的细胞特异性。
方法细节:收集19例健康人、46例MM患者的骨髓活检样本(提取RNA用Qiagen RNeasy Fibrous Tissue Kit),及22例健康人、14例意义未明单克隆丙种球蛋白病(MGUS)、34例冒烟型MM(SMM)、344例MM患者、45株MM细胞系的CD138+细胞(提取核酸用Qiagen AllPrep DNA/RNA Mini Kit);通过Affymetrix U133Plus2.0微阵列芯片分析CD138+细胞HGF基因表达谱,并用Life Technologies High Capacity RNA-to-CDNA Kit反转录、TaqMan探针(HGF: Hs00379140_m1;内参GAPDH: Hs99999905_m1)实时PCR验证骨髓活检样本HGF mRNA水平。
结果解读:MM患者骨髓活检HGF mRNA水平(均值±标准差=39.1±69.1)显著高于健康人(5.0±2.4,Mann-Whitney检验p<0.0001);CD138+细胞中,MM患者HGF mRNA水平显著高于健康人(p<0.0001),且不同疾病阶段(MGUS→SMM→MM)HGF mRNA呈现异质性升高(
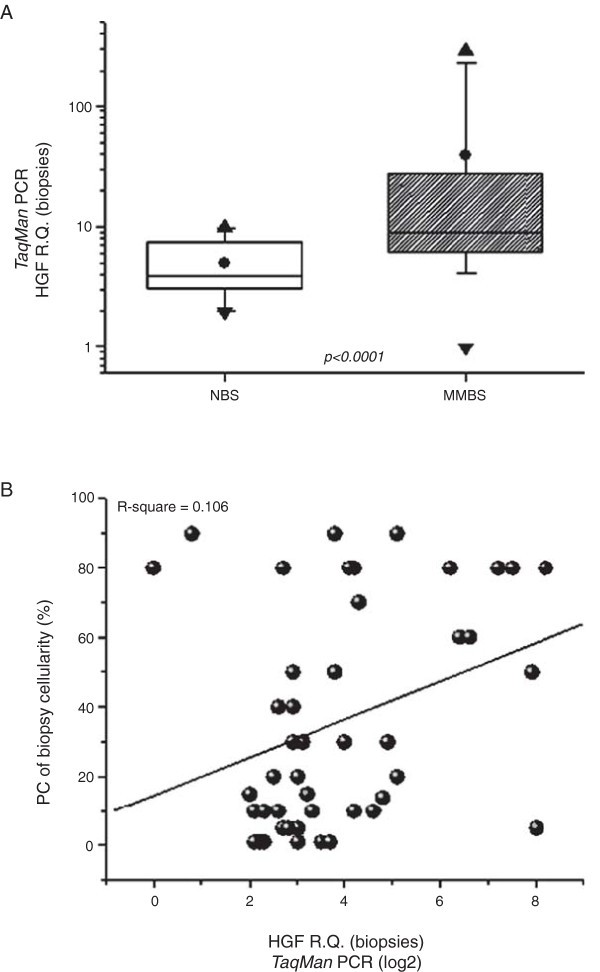
,Figure 1A)。
产品关联:实验所用关键产品:Qiagen AllPrep DNA/RNA Mini Kit、RNeasy Fibrous Tissue Kit;Life Technologies High Capacity RNA-to-CDNA Kit、TaqMan探针;Affymetrix U133Plus2.0微阵列芯片。
3.2 HGF来源的相关性验证
实验目的:验证CD138+细胞是否为HGF的主要产生细胞。
方法细节:分析46例MM患者骨髓活检HGF mRNA与对应CD138+细胞mRNA的相关性,及29例患者CD138+细胞mRNA与血清HGF蛋白(R&D DuoSet ELISA Development Kit检测)的相关性。
结果解读:骨髓活检HGF mRNA与CD138+细胞mRNA显著正相关(R²=0.633,线性回归分析);CD138+细胞mRNA与血清HGF蛋白同样显著相关(R²=0.663,
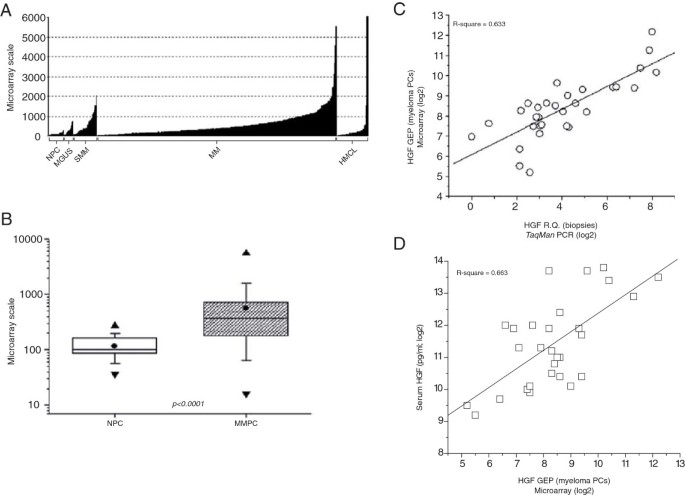
,Figure 2D),直接证实CD138+恶性浆细胞是MM患者HGF的主要来源。
产品关联:实验所用关键产品:R&D Systems DuoSet ELISA Development Kit。
3.3 HGF基因异常分析
实验目的:探究HGF高表达是否由基因扩增或启动子突变驱动。
方法细节:对24例MM患者CD138+细胞行荧光原位杂交(fluorescence in situ hybridization, FISH)检测HGF基因拷贝数;选取5例低血清HGF、7例高血清HGF患者,用Stratagene PfuUltra II Fusion HS DNA Polymerase扩增HGF启动子区域,Applied Biosystems BigDye Terminator v1.1测序试剂盒测序。
结果解读:HGF基因拷贝数为1-3,但与mRNA水平无相关性;启动子测序未发现功能突变,仅检测到3个常见单核苷酸多态性(SNP:Rs3735520、Rs11763015、Rs149178895),提示基因扩增或突变不是HGF高表达的原因(
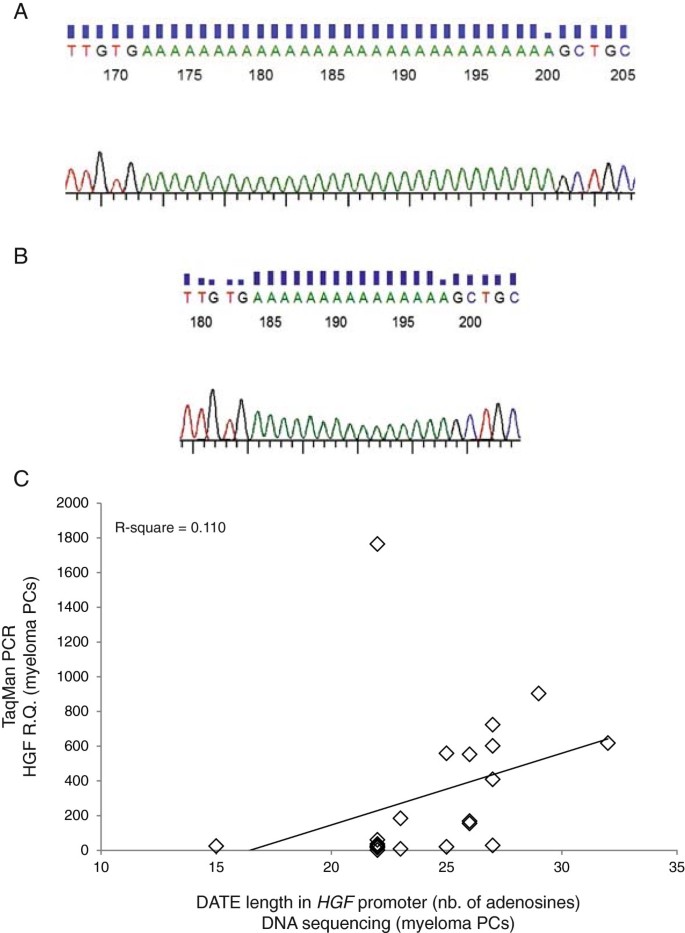
,Figure 3)。
产品关联:实验所用关键产品:Stratagene PfuUltra II Fusion HS DNA Polymerase;Applied Biosystems BigDye Terminator v1.1 Cycle Sequencing Kit、3130x/Genetic Analyzer。
3.4 骨髓微环境对HGF分泌的调控
实验目的:探究骨髓微环境是否促进HGF分泌。
方法细节:将MM细胞系(ANBL-6、JJN3、U266)与BMSC或HS-5细胞(永生化骨髓基质细胞系)共培养48小时,或用Transwell小室(仅允许可溶性因子通过)分离培养,ELISA检测上清HGF水平。
结果解读:ANBL-6、JJN3与BMSC/HS-5共培养后,HGF分泌较单独培养显著增加(p<0.05);Transwell培养(仅可溶性因子)也能促进HGF分泌,但幅度小于直接共培养(
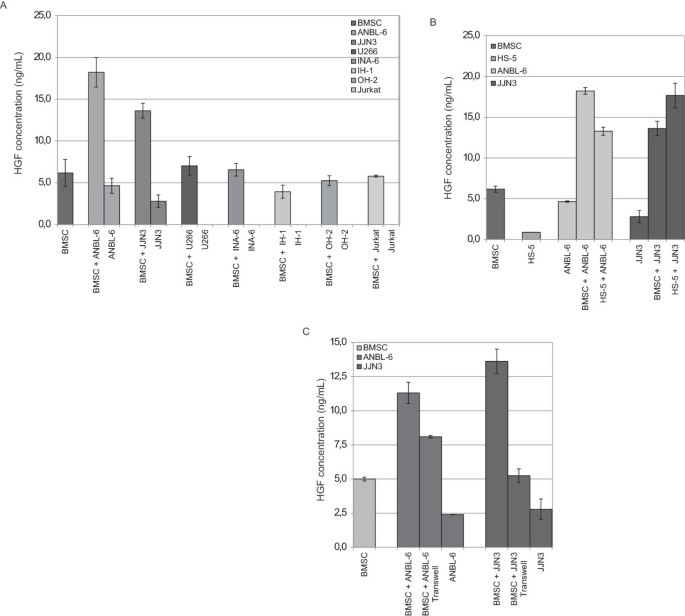
,Figure 4),提示骨髓微环境通过可溶性因子+细胞接触协同促进HGF分泌。
产品关联:实验所用关键产品:R&D Systems DuoSet ELISA Development Kit。
4. Biomarker研究及发现成果解析
Biomarker定位
本文聚焦的Biomarker为肝细胞生长因子(HGF),筛选/验证逻辑为“临床样本mRNA分析→ CD138+细胞来源验证→ 血清蛋白水平关联→ 微环境调控机制解析”,形成“细胞-组织-血清”的完整验证链。
研究过程详述
- 来源:HGF样本来自MM患者骨髓活检组织、CD138+恶性浆细胞及外周血清;
- 验证方法:
- 实时PCR检测骨髓活检及CD138+细胞HGF mRNA水平;
- ELISA定量血清HGF蛋白水平;
- 共培养实验验证微环境对HGF分泌的调控;
- 特异性与敏感性:CD138+细胞mRNA与血清HGF蛋白显著相关(R²=0.663),骨髓活检mRNA与CD138+细胞mRNA显著相关(R²=0.633),提示HGF作为Biomarker的细胞特异性及血清关联性。
核心成果提炼
- 来源明确:首次证实MM患者中HGF主要由CD138+恶性浆细胞产生,而非骨髓微环境细胞;
- 调控机制:骨髓微环境通过可溶性因子(如基质细胞分泌的细胞因子)及细胞接触促进恶性浆细胞分泌HGF;
- 临床意义:HGF血清水平与恶性浆细胞mRNA水平直接相关,结合既往研究中“HGF升高提示不良预后”的结论,HGF可作为MM患者预后分层的Biomarker,且其细胞来源为靶向干预(如抑制恶性浆细胞HGF分泌或阻断微环境调控)提供了理论依据;
- 创新性:突破了“HGF可能来自微环境”的传统认知,明确了恶性浆细胞的核心作用,并揭示了微环境的协同调控机制。
数据支撑:MM患者骨髓活检HGF mRNA较健康人升高(p<0.0001,n=46 vs 19);CD138+细胞mRNA与血清HGF相关(R²=0.663,n=29);共培养实验中ANBL-6与BMSC共培养HGF分泌增加(文献未明确具体倍数,但统计显著)。
本文通过多维度实验明确了MM患者HGF的细胞来源及调控机制,为HGF作为Biomarker的临床应用及靶向治疗提供了关键证据,填补了领域内的长期空白。
