1. 领域背景与文献引入
文献英文标题:CCR7 as a novel therapeutic target in t-cell PROLYMPHOCYTIC leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:T细胞幼淋巴细胞白血病(T-PLL)的靶向治疗。
T细胞幼淋巴细胞白血病(T-PLL)是一种罕见但侵袭性极强的成熟T细胞白血病,占成人成熟淋巴细胞白血病的2%。其临床特征为外周血中幼淋巴细胞显著增多,常累及骨髓、淋巴结、肝脾等器官,预后极差——中位总生存期(OS)仅7.5-20个月。现有治疗手段以化疗(如嘌呤类似物)和靶向CD52的单克隆抗体阿仑单抗为主:化疗耐药率高,阿仑单抗虽能诱导>90%的缓解率,但几乎所有患者在12个月内复发;异基因造血干细胞移植(allo-HSCT)是唯一可能治愈的方法,但仅适用于少数年轻、体能状态好的患者。因此,T-PLL的治疗仍存在巨大未满足需求,寻找新的治疗靶点是当前研究热点。
趋化因子受体CCR7是调控淋巴细胞归巢至次级淋巴器官的关键分子,在多种恶性肿瘤中参与调控肿瘤细胞的迁移、侵袭、生存及耐药。例如,CCR7在成人T细胞白血病/淋巴瘤(ATLL)中促进细胞向淋巴结转移,在实体瘤(如乳腺癌)中与不良预后相关。但CCR7在T-PLL中的作用尚未明确:既无研究报道其与患者预后的关联,也未探索其作为治疗靶点的潜力。针对这一空白,本文系统研究了CCR7在T-PLL中的生物学功能、临床意义及靶向治疗价值,为T-PLL提供了新的治疗策略。
2. 文献综述解析
作者对现有研究的评述逻辑可分为三部分:T-PLL的临床治疗局限→CCR7在恶性肿瘤中的作用→CCR7在T-PLL中的研究空白。
现有研究总结
- T-PLL的治疗现状:化疗耐药率高,阿仑单抗是一线疗法但复发率近100%,allo-HSCT仅适用于少数患者,缺乏持续有效的后续治疗手段。
- CCR7的肿瘤生物学功能:CCR7通过结合配体CCL19/CCL21,调控肿瘤细胞的迁移(如ATLL细胞向淋巴结转移)、侵袭(如乳腺癌细胞的基质降解)及生存(如慢性淋巴细胞白血病细胞的抗凋亡);在实体瘤中,CCR7高表达与不良预后相关,但在血液瘤中的预后意义尚未报道。
- CCR7靶向治疗的进展:抗CCR7单抗在其他肿瘤(如慢性淋巴细胞白血病)中显示出抑制迁移和生存的作用,但未在T-PLL中开展研究。
本文创新价值
通过对比现有研究的空白,本文的创新点清晰:①首次报道CCR7在T-PLL中的高表达及不良预后意义,为T-PLL的预后分层提供了新 biomarker;②首次系统阐明CCR7调控T-PLL细胞迁移、生存的分子机制(激活MEK/ERK、PI3K/AKT通路);③首次验证抗CCR7单抗在T-PLL中的体内外疗效,为T-PLL的靶向治疗提供了新候选药物。
3. 研究思路总结与详细解析
整体框架
研究目标:明确CCR7在T-PLL中的生物学功能、临床预后意义,及抗CCR7单抗的治疗潜力;核心科学问题:CCR7是否调控T-PLL细胞的迁移/生存?是否与患者预后相关?抗CCR7单抗是否能抑制T-PLL进展?技术路线:临床样本分析(CCR7表达与预后)→体外功能实验(迁移、生存、信号通路)→体内动物模型(抗CCR7疗效),形成“临床-基础-转化”的闭环验证。
3.1 CCR7在T-PLL患者中的表达及预后分析
实验目的:检测T-PLL患者CCR7表达水平,分析其与预后的关联。
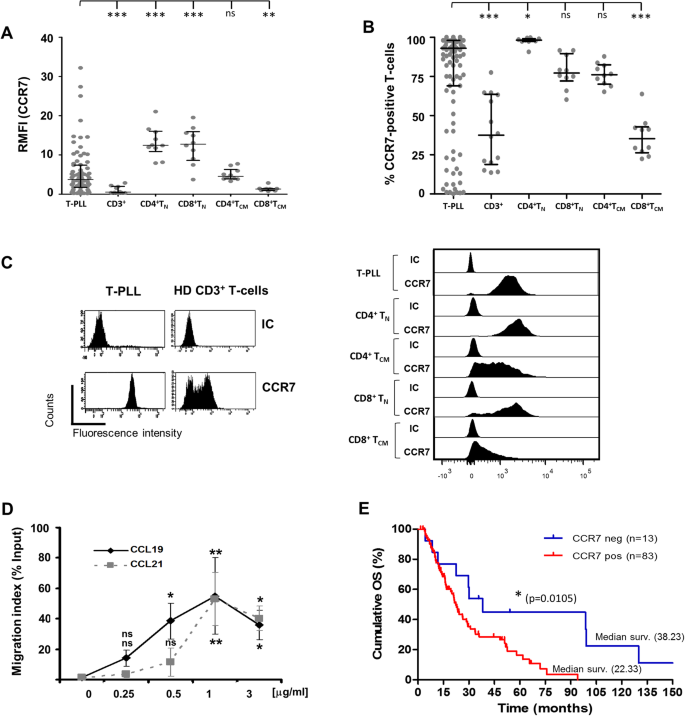
方法细节:收集109例T-PLL患者(符合WHO诊断标准)及14例健康供者的外周血样本,通过密度梯度离心分离外周血单个核细胞(PBMC);采用流式细胞术检测CCR7表达——使用PE或PE-cy5.5标记的抗CCR7抗体(克隆150503,R&D Systems),同时标记CD5、CD7、CD3等T细胞表面 marker 以区分肿瘤细胞;通过ROC曲线分析设定CCR7阳性截断值(20% CCR7+肿瘤细胞),采用Kaplan-Meier法分析OS,Cox回归模型评估风险比(HR)。
结果解读:T-PLL患者的CCR7表达显著高于健康供者——相对中位荧光强度(RMFI)为5.591±0.7163 vs 1.094±0.3021(p<0.001);75.95%±3.187的T-PLL细胞表达CCR7,而健康供者仅39.76%±6.030(p<0.01)。预后分析显示:CCR7阳性患者(>20% CCR7+细胞,83/96例)的中位OS为22.33个月,显著短于CCR7阴性患者(38.23个月,p=0.0105);Cox回归分析确认CCR7阳性是独立不良预后因素(HR=2.426,p=0.044)。
产品关联:实验所用关键产品:R&D Systems的抗CCR7抗体(克隆150503)、BD Biosciences的CD5-FITC(克隆UCHT2)、CD7-APC(克隆M-7 T01)、CD3-APC-H7(克隆SK7)抗体。
3.2 CCR7调控T-PLL细胞的迁移、侵袭及信号通路
实验目的:验证CCR7对T-PLL细胞迁移、侵袭的调控作用,及下游信号通路。
方法细节:①迁移实验:将T-PLL细胞(>95%纯度)接种于Transwell上室,下室加入CCL19/CCL21(1μg/mL),4小时后计数迁移细胞;②侵袭实验:Transwell上室铺Matrigel,细胞接种后加入CCL19/CCL21,24小时后计数侵袭细胞;③信号通路检测:细胞血清饥饿4小时,用抗CCR7单抗(10μg/mL)预处理30分钟,再加入CCL19/CCL21刺激,通过Western blot检测ERK1/2、AKT、MLC的磷酸化水平。
结果解读:CCR7介导T-PLL细胞向CCL19/CCL21的剂量依赖性迁移(1μg/mL时迁移率最高);抗CCR7单抗完全抑制迁移(p<0.01)和侵袭(p<0.001)。信号通路分析显示:CCL19/CCL21可激活ERK1/2(Thr202/Tyr204磷酸化)、AKT(Ser473磷酸化)及MLC(Ser19磷酸化),而抗CCR7单抗能阻断这些磷酸化(p<0.05),提示CCR7通过MEK/ERK、PI3K/AKT、Rho/ROCK通路调控细胞功能。
产品关联:实验所用关键产品:PeproTech的CCL19/CCL21、BD Biosciences的Matrigel、Cell Signaling Technology的磷酸化抗体。
3.3 抗CCR7单抗的体外疗效评估
实验目的:评估抗CCR7单抗的体外细胞毒性(CDC、ADCC)及对细胞生存的影响。
方法细节:①补体依赖细胞毒性(CDC):T-PLL细胞与抗CCR7单抗(150503克隆)、阿仑单抗或同型对照孵育30分钟,加入兔补体(25%),1.5小时后用7-AAD染色检测细胞死亡;②抗体依赖细胞介导的细胞毒性(ADCC):将T-PLL细胞与抗CCR7单抗孵育后,加入人或小鼠NK细胞(E:T=6:1),4小时后检测细胞死亡;③细胞生存实验:细胞接种于1% FBS培养基,加入CCL19/CCL21刺激,抗CCR7单抗预处理,72小时后用Annexin-V/7-AAD检测生存情况。
结果解读:抗CCR7单抗诱导显著的CDC效应——在0.125-5μg/mL浓度下,细胞溶解率优于阿仑单抗(p<0.05);对阿仑单抗复发患者的肿瘤细胞仍有效(p<0.01)。ADCC实验无显著细胞毒性(p>0.05)。细胞生存实验显示:CCL19/CCL21能增强T-PLL细胞生存(生存比例增加15%-20%),而抗CCR7单抗完全阻断这一效应(p<0.05)。
产品关联:实验所用关键产品:Genzyme的阿仑单抗、BD Biosciences的Annexin-V/7-AAD试剂盒、Serotec-Bio-Rad的兔补体。
3.4 抗CCR7单抗的体内疗效评估
实验目的:验证抗CCR7单抗在体内对T-PLL的抑制作用。
方法细节:构建T-PLL小鼠模型——将SUP-T11细胞(T-PLL样细胞系,携带t(14;14)易位)尾静脉注射入免疫缺陷小鼠(RAG2−/−γc−/−或NSG),第21天(骨髓中检测到肿瘤细胞)开始腹腔注射抗CCR7单抗(10mg/kg)或同型对照,每周2次(第3-5周)、每周1次(第7-9周);监测小鼠生存情况,通过流式细胞术检测外周血、骨髓、淋巴结等器官的肿瘤负荷,生物发光成像(IVIS)追踪肿瘤进展。
结果解读:在RAG2−/−γc−/−小鼠中,抗CCR7单抗显著延长生存——对照组中位生存86.5天,治疗组均存活至127天(实验终点,p<0.01);治疗组外周血及器官中未检测到肿瘤细胞,而对照组肿瘤负荷持续增加。在NSG小鼠(缺乏补体)中,抗CCR7单抗的疗效减弱(中位生存160天 vs 110.5天,p>0.05),提示Fc段介导的CDC是体内疗效的关键机制。
产品关联:实验所用关键产品:The Jackson Laboratory的NSG小鼠、Caliper Life Sciences的IVIS Lumina II成像系统、Cell Marque的抗hCD45抗体。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文的核心Biomarker是CCR7,其类型为“细胞表面受体类Biomarker”(表达于T-PLL细胞表面)。筛选与验证逻辑为:临床样本检测(CCR7表达)→预后关联分析(OS、HR)→体外功能验证(迁移、生存)→体内疗效验证(xenograft模型),形成完整的“临床意义-功能机制-治疗潜力”验证链。
研究过程详述
Biomarker来源:T-PLL患者的外周血肿瘤细胞(通过流式细胞术分选CD3+CD5+CD7+的肿瘤细胞)。
验证方法:①表达验证:流式细胞术检测109例患者的CCR7表达,对比健康供者;②预后验证:ROC曲线设定截断值(20% CCR7+细胞),Kaplan-Meier分析OS,Cox回归评估独立性;③功能验证:体外实验验证CCR7对迁移、生存的调控;④疗效验证:体内模型验证抗CCR7单抗的疗效。
特异性与敏感性:ROC曲线分析显示,20% CCR7+细胞的截断值具有高敏感性(84.55%,95%CI 76.93-90.44%),能有效区分预后差异。
核心成果提炼
- 临床意义:CCR7是T-PLL的独立不良预后Biomarker——CCR7阳性患者的OS显著短于阴性患者(22.33个月 vs 38.23个月,p=0.0105),HR=2.426(p=0.044)。
- 功能关联:CCR7通过激活MEK/ERK、PI3K/AKT通路,促进T-PLL细胞的迁移、侵袭及生存;阻断CCR7能抑制这些功能。
- 治疗潜力:抗CCR7单抗通过CDC效应诱导肿瘤细胞死亡,对阿仑单抗复发患者仍有效;体内模型中显著延长生存,清除肿瘤负荷。
- 创新性:首次将CCR7作为T-PLL的预后Biomarker和治疗靶点,为T-PLL的精准治疗提供了新方向。
综上,本文通过多维度研究明确了CCR7在T-PLL中的关键作用,为T-PLL的预后分层和靶向治疗提供了重要依据,具有显著的临床转化价值。
