1. 领域背景与文献引入
文献英文标题:Extrachromosomal circular DNA (eccDNA): an emerging star in cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(额外染色体环状DNA与癌症的关联研究)。
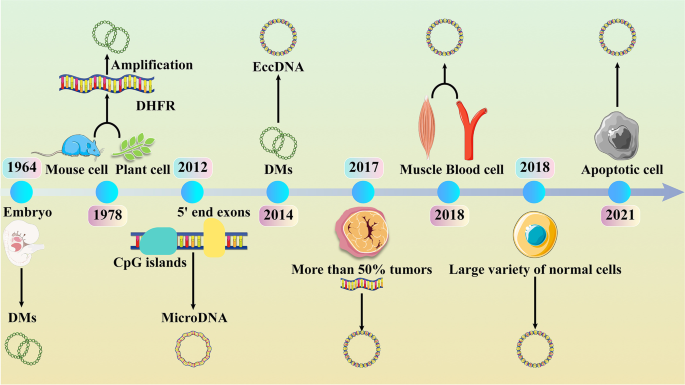
额外染色体环状DNA(eccDNA)是一类独立于染色体的环状DNA分子,其研究可追溯至1964年——科学家首次在小麦胚胎和猪精子中发现双微体(DMs),这是eccDNA的早期形态。后续研究逐步揭示eccDNA的广泛分布性(涵盖动植物、微生物)、复杂生物发生机制及肿瘤相关性:2012年发现富含CpG岛和基因5’端外显子的microDNA;2017年Verhaak等通过分析2572株肿瘤细胞系,发现超半数人类肿瘤携带eccDNA且常包含癌驱动基因;2018年Møller等首次在健康人肌肉、血液细胞中检测到eccDNA,打破“eccDNA仅存在于肿瘤细胞”的认知;2021年Paulsen等明确DNA损伤修复通路与eccDNA生成的关联,Wang等则发现细胞凋亡参与eccDNA生物发生。
当前eccDNA研究的热点集中在三大方向:生物发生机制(如DNA损伤修复、染色体重排对eccDNA生成的调控)、肿瘤功能(如eccDNA介导的癌基因扩增、肿瘤异质性)、临床应用(如作为肿瘤诊断/预后标志物)。未解决的核心问题包括:eccDNA具体生成机制的细节(如不同通路对eccDNA类型的选择性)、不同大小/来源eccDNA的功能差异、临床应用中的敏感性与特异性验证。
本文作为2022年发表的系统性综述,旨在整合eccDNA的起源、生物发生、功能研究进展,并结合2022年更新的“癌症hallmarks”(如细胞衰老、非突变表观遗传重编程),重点阐述eccDNA在肿瘤中的多维度作用及临床转化潜力,填补了现有研究中“eccDNA与最新癌症理论结合分析”的空白。
2. 文献综述解析
本文以“历史脉络-生物发生机制-肿瘤功能-临床应用”为核心评述逻辑,将eccDNA研究与2022年更新的癌症hallmarks(共14项)结合,系统总结了eccDNA的研究现状与未来方向。
现有研究的关键结论可归纳为四点:(1)起源与分类:eccDNA来源广泛(涵盖染色体重复序列、基因区域、端粒等),按大小与结构分为小多分散DNA(spcDNA)、端粒环(t-circles)、microDNA(100-400bp)、额外染色体DNA(ecDNA,百万级bp)四类;(2)生物发生机制:eccDNA生成涉及DNA损伤修复(同源重组HR、微同源介导末端连接MMEJ、经典非同源末端连接c-NHEJ)、断裂-融合-桥(BFB)循环、染色体碎裂(chromothripsis)、细胞凋亡四大通路;(3)肿瘤功能:eccDNA通过促进癌基因扩增(如MYC、EGFR)、增加肿瘤异质性(随机分配导致细胞间基因差异)、诱导细胞衰老(核孔复合物功能障碍导致eccDNA核内积累)、激活促炎反应(进入细胞质激活cGAS-STING通路)推动肿瘤进展;(4)临床潜力:eccDNA可作为液体活检标志物(循环eccDNA)、治疗靶点(阻断生成通路)及预后指标(ecDNA扩增与不良预后相关)。
现有研究的优势在于技术驱动的发现:下一代测序(WGS)、超分辨显微镜等技术突破,推动了eccDNA的鉴定与功能解析;局限性则包括机制细节不清(如不同通路对eccDNA类型的调控差异)、功能区分不足(不同大小eccDNA的具体作用未明确)、临床验证缺乏(诊断标志物的敏感性/特异性未大规模验证)。
本文的创新点在于:(1)结合最新癌症hallmarks(2022年更新),将eccDNA功能与“癌基因不稳定性、肿瘤异质性、细胞衰老、促炎反应”等hallmarks关联,提供了更系统的肿瘤调控框架;(2)强调临床转化价值,从诊断、治疗、预后三方面总结eccDNA的应用潜力,为基础研究向临床过渡提供了理论支撑;(3)整合凋亡机制,纳入2021年最新研究(Wang等关于eccDNA与凋亡的关联),补充了eccDNA生物发生的新通路。
3. 研究思路总结与详细解析
本文为综述类文献,未开展原始实验,而是通过整合1964年至今的关键研究,构建了“eccDNA的历史-分类-生物发生-肿瘤功能-临床应用”的完整逻辑链。以下按综述结构解析核心内容:
3.1 历史脉络与分类梳理
作者首先回顾eccDNA的发现史:1964年首次报道双微体(DMs);2012年发现microDNA(源于CpG岛与基因5’端外显子);2017年Verhaak等证实肿瘤细胞中eccDNA携带癌基因;2018年Møller等发现正常细胞(肌肉、血液)也存在eccDNA;2021年Paulsen、Wang等分别揭示DNA损伤修复与凋亡对eccDNA生成的调控。
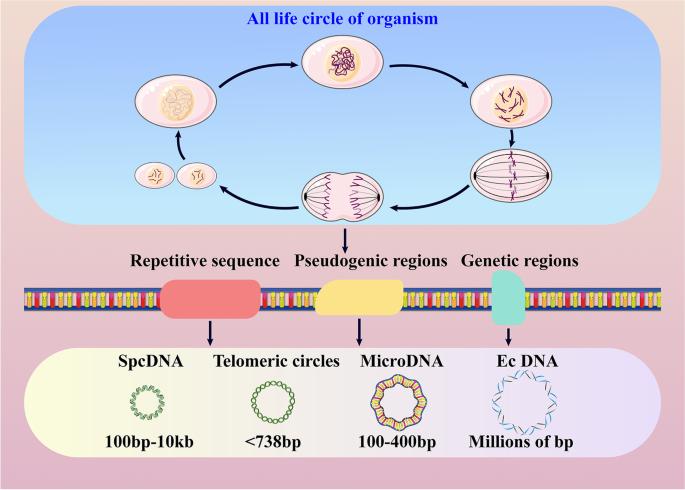
基于大小与来源,作者将eccDNA分为四类:spcDNA(100bp-10kb,源于重复序列)、t-circles(端粒来源)、microDNA(100-400bp,源于基因区域)、ecDNA(百万级bp,常携带癌基因)。图1展示了eccDNA的历史里程碑(
)。
3.2 生物发生机制整合分析
作者总结了eccDNA生成的四大通路,结合具体研究验证:
- DNA损伤修复:microDNA生成依赖MMEJ通路(缺失MMEJ关键蛋白会减少microDNA),而c-NHEJ通路抑制microDNA生成;ecDNA生成则与HR、NHEJ通路相关(沉默BRCA1、PRKDC会降低ecDNA数量,Paulsen等2021年研究)。
- BFB循环:重复序列通过同源重组 excision形成eccDNA,如中国仓鼠卵巢细胞中的spcDNA(Cohen等2003年研究)。
- 染色体碎裂:严重DNA损伤导致染色体断裂重排,促进ecDNA扩增(Shoshani等2021年研究发现,甲氨蝶呤诱导chromothripsis会增加DMs拷贝数)。
- 细胞凋亡:凋亡DNA片段(ADFs)经DNA连接酶3(Lig3)连接形成eccDNA,敲低Lig3会显著减少eccDNA生成(Wang等2021年研究)。
图2可视化了eccDNA的起源与分类(
)。
3.3 肿瘤相关功能系统性总结
结合2022年更新的癌症hallmarks,作者阐述了eccDNA的四大肿瘤功能:
1. 促进癌基因不稳定性:eccDNA携带完整癌基因(如MYC、EGFR),通过高拷贝数与高转录活性(形成ecDNA hubs增强转录)导致癌基因过表达,推动肿瘤恶性生长(Verhaak等2017年研究)。
2. 增加肿瘤异质性:eccDNA无着丝粒, mitosis时随机分配,导致细胞间eccDNA拷贝数差异,进而形成肿瘤异质性(Turner等2017年研究)。
3. 诱导细胞衰老:正常细胞通过核孔复合物(NPCs)排出eccDNA,而衰老细胞NPCs功能障碍,导致eccDNA核内积累,成为衰老标志物(Qiu等2021年研究)。
4. 激活促炎反应:eccDNA进入细胞质后,激活cGAS-STING通路,促进干扰素(IFN)与细胞因子分泌,诱导肿瘤相关炎症(Wang等2021年研究)。
图3展示了eccDNA功能与癌症hallmarks的关联(

)。
3.4 临床应用潜力探讨
作者从三方面总结eccDNA的临床价值:
- 早期诊断:循环eccDNA(液体活检)携带完整癌基因信息,比线性循环肿瘤DNA(cfDNA)更长(30-60%>250bp),可能作为更特异的早期标志物(Kumar等2017年研究)。
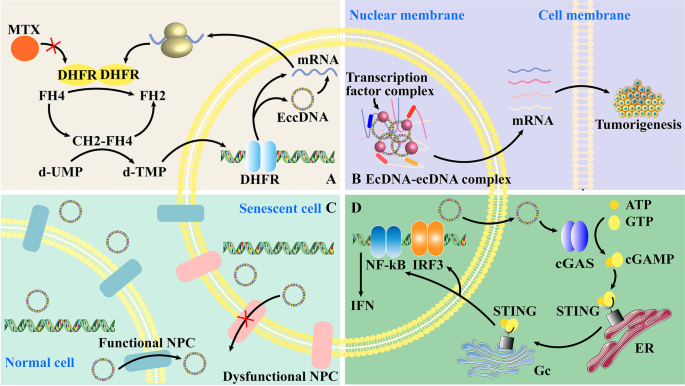
- 治疗靶点:阻断eccDNA生成通路可克服耐药,如抑制MMEJ通路减少microDNA生成,或敲低Lig3降低凋亡相关eccDNA,进而减少耐药基因(如DHFR、RAB3B)表达(Cai等2019年、Lin等2022年研究)。
- 预后评估:ecDNA扩增与多种癌症的不良预后相关,Kim等2020年分析3212例患者(n=3212),发现ecDNA扩增患者5年生存率更差;胰腺癌中EGFR、MYC高拷贝数预测短生存期(Zhao等2021年研究)。
图4可视化了eccDNA的临床应用机制(
)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文关注eccDNA作为肿瘤Biomarker的潜力,包括:(1)诊断Biomarker:循环eccDNA(液体活检);(2)治疗Biomarker:eccDNA生成通路(如MMEJ、Lig3);(3)预后Biomarker:ecDNA扩增水平。筛选逻辑为“基础研究(细胞/动物实验验证机制)→临床样本验证(全基因组测序、液体活检分析关联性)”。
研究过程详述
- 来源:eccDNA主要源于肿瘤细胞染色体(癌基因区域、重复序列),循环eccDNA来自肿瘤细胞分泌或凋亡释放的 extracellular vesicles(EVs)。
- 验证方法:采用全基因组测序(WGS)鉴定ecDNA扩增(Kim等2020年)、荧光原位杂交(FISH)检测eccDNA定位(Hung等2021年)、液体活检检测循环eccDNA(Kumar等2017年)。
- 特异性与敏感性:综述提到循环eccDNA比线性cfDNA更易携带完整癌基因,可能具有更高特异性,但未明确具体AUC(曲线下面积)或敏感性数据(文献未提供大规模临床验证结果)。
核心成果与创新性
- 诊断价值:循环eccDNA可能弥补现有标志物(如KRAS)的不足,作为泛癌早期诊断标志物(Crosby等2022年研究支持“eccDNA诱导的免疫反应是癌症共同特征”)。
- 治疗价值:eccDNA生成通路(如MMEJ、Lig3)可作为靶点,阻断后降低耐药基因表达,如抑制Lig3减少RAB3B扩增,克服顺铂耐药(Lin等2022年研究)。
- 预后价值:ecDNA扩增与不良预后强相关,Kim等2020年分析3212例患者(n=3212),发现ecDNA扩增患者5年生存率显著降低(P<0.05);胰腺癌中EGFR高拷贝数患者生存期缩短(HR=未明确,P<0.05)。
创新性:本文首次系统总结eccDNA作为多维度Biomarker的潜力,结合最新临床研究数据(如2022年Lin等关于顺铂耐药的研究),为eccDNA的临床转化提供了明确方向——循环eccDNA可用于早期诊断,生成通路可作为治疗靶点,扩增水平可预测预后。
综上,本文作为eccDNA领域的最新综述,整合了历史研究与前沿发现,为理解eccDNA在肿瘤中的作用及临床应用提供了全面框架,是该领域的关键参考文献。
