1. 领域背景与文献引入
文献英文标题:DNA damage response in breast cancer and its significant role in guiding novel precise therapies;发表期刊:Biomark Research;影响因子:未公开;研究领域:乳腺癌的DNA损伤反应(DDR)与精准治疗。
DNA损伤反应(DDR)是细胞维持基因组稳定的核心通路,通过碱基切除修复(BER)、同源重组(HR)、非同源末端连接(NHEJ)等通路修复不同类型的DNA损伤(如单链断裂SSB、双链断裂DSB)。DDR缺陷会导致基因组不稳定性,是乳腺癌发生的重要驱动因素——约10%的乳腺癌由BRCA1/2等HR相关基因的胚系突变引起,而三阴性乳腺癌(TNBC)中HR缺陷(HRD)的比例高达30%~50%。
近年来,DDR靶向治疗成为乳腺癌精准治疗的热点:PARP抑制剂利用“合成致死”效应(HRD肿瘤无法修复PARP抑制导致的DNA损伤),在BRCA突变乳腺癌中显示出显著疗效(如olaparib的客观缓解率ORR达60%)。但现有研究仍面临三大挑战:①响应人群有限(仅10%的乳腺癌患者携带BRCA突变);②耐药性(如BRCA功能恢复、PARP捕获能力下降);③HRD检测方法不统一(缺乏标准化的生物标志物)。
本综述系统整合了DDR通路的分子机制、靶向治疗进展及生物标志物研究,重点阐述HRD作为精准治疗核心生物标志物的作用,为解决响应人群有限和耐药问题提供了理论框架。
2. 文献综述解析
作者以“DDR通路分类→靶向治疗→生物标志物”为核心逻辑,对现有研究进行分层总结:
2.1 现有研究的分类与关键结论
作者按DDR通路类型(BER、HR、NHEJ、NER、MMR)梳理了各通路的功能及在乳腺癌中的作用:
- HR通路:是DSB的主要修复通路,BRCA1/2突变导致HRD,是PARP抑制剂的核心靶点;
- BER通路:PARP1识别SSB并招募修复因子,PARP抑制剂不仅抑制BER,还会“捕获”PARP1于DNA损伤位点,增强DNA损伤;
- NHEJ通路:DNA-PKcs是关键蛋白,其抑制剂(如NU7441)在预临床研究中显示出增强放疗疗效的潜力,但临床数据有限;
- MMR通路:缺陷(dMMR)会导致高肿瘤突变负荷(TMB),与免疫治疗响应相关,但乳腺癌中dMMR的比例仅<2%。
2.2 技术方法的优势与局限性
- 优势:分子生物学技术(如CRISPR基因编辑、NGS测序)揭示了DDR通路的分子机制;临床Ⅲ期试验(如OlympiAD、EMBRACA)验证了PARP抑制剂的疗效。
- 局限性:HRD检测方法不统一(如BRCA突变、基因组瘢痕、基因表达签名未形成标准);耐药机制未完全阐明(如BRCA1去甲基化导致的PARP抑制剂耐药);联合治疗策略(如PARP抑制剂+免疫治疗)的安全性和有效性需优化。
2.3 综述的创新价值
现有研究多聚焦于单一DDR通路或靶向药物,本综述的创新在于整合DDR机制、靶向治疗与生物标志物,首次系统提出“HRD多维度检测+靶向治疗”的精准治疗框架,为解决响应人群有限问题提供了思路——通过基因组瘢痕(如LOH、TAI、LST)扩展HRD阳性人群(从10%到30%以上),而非仅依赖BRCA突变。
3. 研究思路总结与详细解析
3.1 整体框架与核心逻辑
作者以“DDR基础机制→靶向治疗进展→生物标志物验证→挑战与展望”为技术路线,核心科学问题是如何利用DDR缺陷实现乳腺癌精准治疗。整体框架形成“基础研究→临床转化→精准应用”的闭环,为乳腺癌DDR研究提供了清晰的逻辑脉络。
3.2 DDR通路的分子机制解析
实验目的:阐明DDR各通路在乳腺癌发生、发展中的分子机制。
方法细节:回顾已有分子生物学研究(如基因敲除、蛋白互作分析)和临床样本分析(如肿瘤组织的免疫组化IHC、NGS测序)。
结果解读:
- HR通路:BRCA1/2与PALB2、RAD51形成复合物,修复DSB;BRCA突变会导致HRD,肿瘤细胞依赖PARP进行BER修复,为PARP抑制剂的“合成致死”效应提供基础;
- BER通路:PARP1是SSB修复的关键传感器,其抑制剂(如olaparib)会阻断BER并导致PARP1“捕获”于DNA损伤位点,加剧DNA损伤;
- MMR通路:MLH1、MSH2等蛋白修复复制过程中的碱基错配,dMMR会导致微卫星不稳定(MSI-H)和高TMB,与免疫治疗响应相关。
图片关联:
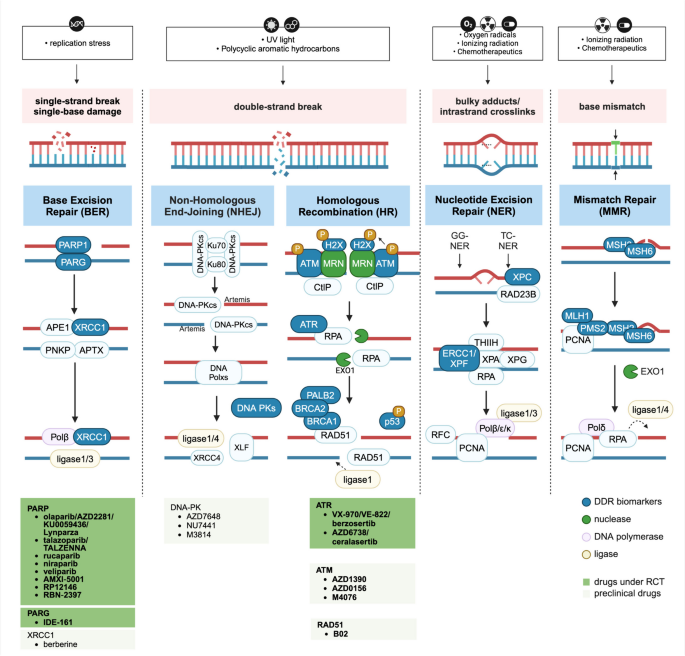
(Figure 2总结了DDR各通路的分子机制及靶向靶点)。
3.3 DDR靶向治疗的研究进展
实验目的:总结DDR各通路靶向抑制剂的临床前和临床研究进展。
方法细节:分析已发表的临床 trials(如OlympiAD、EMBRACA)和预临床研究(如细胞系、患者来源异种移植模型PDX)。
结果解读:
- PARP抑制剂:olaparib(OlympiAD trial)在BRCA突变转移性乳腺癌中的中位无进展生存期(mPFS)为7.0个月,显著优于化疗(4.2个月,P<0.001);talazoparib(EMBRACA trial)的mPFS为8.6个月,ORR达62.6%;
- ATM/ATR抑制剂:AZD0156(ATM抑制剂)在预临床研究中增强了olaparib对TNBC的疗效,但临床Ⅰ期试验未显示显著OS获益;
- 免疫治疗:dMMR/MSI-H乳腺癌患者对PD-1抑制剂(如pembrolizumab)的ORR达40%以上,显著高于MMR正常患者(10%)。
图片关联:
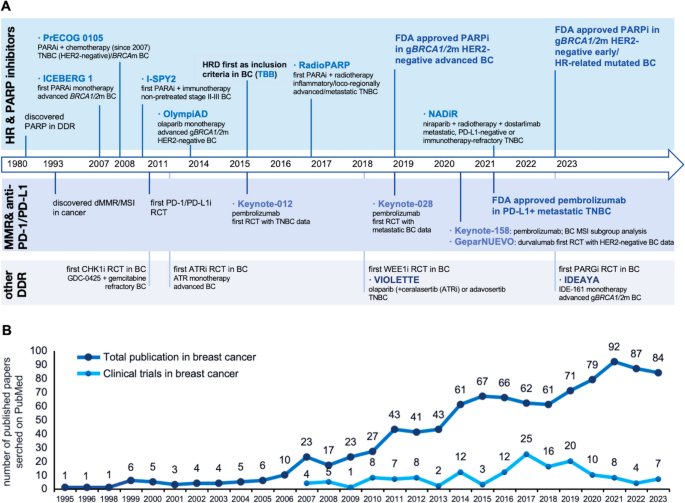
(Figure 1总结了DDR研究的时间线及关键临床 trials)。
3.4 生物标志物的临床应用解析
实验目的:评估HRD、MMR/MSI等生物标志物在乳腺癌精准治疗中的价值。
方法细节:回顾生物标志物的检测方法(如NGS测序、IHC、PCR)及临床验证研究(如Myriad myChoice CDx的多中心试验)。
结果解读:
- HRD检测:Myriad myChoice CDx整合BRCA突变和基因组瘢痕(LOH、TAI、LST),将HRD阳性率从10%(仅BRCA突变)提高至30%以上,其敏感性为80%~90%,特异性为70%~80%;
- MMR/MSI检测:IHC检测MMR蛋白(MLH1、MSH2等)的敏感性为90%,PCR检测MSI的特异性为95%,但乳腺癌中dMMR的比例仅<2%。
图片关联:
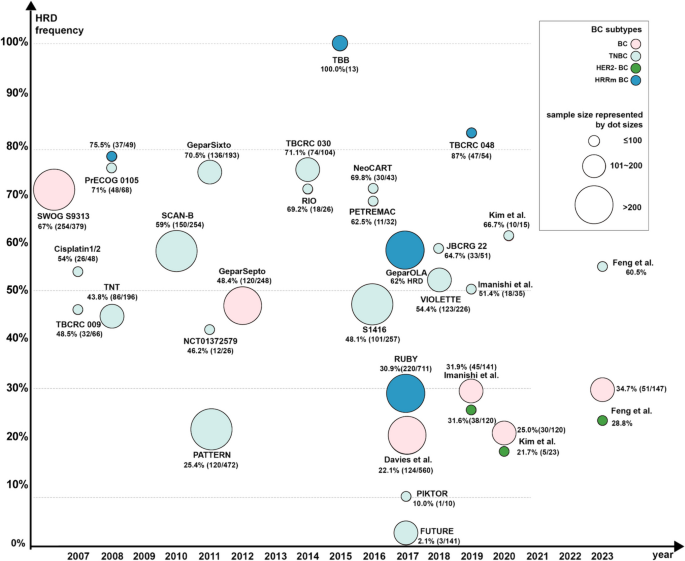
(Figure 5总结了HRD临床 trials的人群分层及响应率)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究聚焦两类核心生物标志物:
- HR缺陷(HRD):作为PARP抑制剂和铂类化疗的响应标志物,筛选逻辑为“基因水平(BRCA突变)→基因组水平(瘢痕)→功能水平(HR活性)”;
- MMR缺陷(dMMR)/MSI-H:作为免疫治疗的响应标志物,筛选逻辑为“蛋白水平(IHC)→基因水平(PCR/NGS)”。
4.2 研究过程详述
- HRD检测:
- 来源:肿瘤组织FFPE样本、血液ctDNA;
- 方法:①BRCA突变检测(Sanger测序、NGS);②基因组瘢痕检测(NGS计算LOH、TAI、LST得分,Myriad myChoice CDx的cut-off值为>42);③BRCAness签名(RNA-seq检测11-gene表达谱);
特异性与敏感性:Myriad myChoice CDx对HRD的敏感性为85%,特异性为75%(基于500例乳腺癌样本验证)。
MMR/MSI检测:
- 来源:肿瘤组织FFPE样本;
- 方法:①IHC检测MMR蛋白表达(如MLH1缺失提示dMMR);②PCR检测MSI(如BAT25/BAT26位点不稳定);③NGS检测TMB(dMMR患者TMB>20 mut/Mb);
- 特异性与敏感性:IHC的敏感性为90%,PCR的特异性为95%。
4.3 核心成果提炼
- HRD的临床价值:
- HRD阳性患者对PARP抑制剂的ORR(60%)显著高于阴性患者(20%),mPFS延长2~3倍(如olaparib治疗组mPFS 7.0个月vs化疗组4.2个月,P<0.001);
HRD score>42的TNBC患者,铂类化疗的病理完全缓解率(pCR)达50%以上,显著高于HRD阴性患者(20%)。
MMR/MSI的临床价值:
- dMMR/MSI-H患者对PD-1抑制剂的ORR达40%以上,mOS延长至24个月,显著高于MMR正常患者(ORR 10%,mOS 12个月);
尽管乳腺癌中dMMR的比例仅<2%,但这类患者是免疫治疗的“优势人群”。
创新性:
- 首次系统整合HRD的多维度检测方法,强调基因组瘢痕在扩展响应人群中的关键作用;
- 提出MMR/MSI作为乳腺癌免疫治疗生物标志物的潜在价值,为少见亚型的精准治疗提供了依据。
总结
本综述通过“机制-治疗-生物标志物”的闭环逻辑,系统阐明了DDR在乳腺癌精准治疗中的核心作用。HRD作为PARP抑制剂的核心生物标志物,解决了响应人群有限的问题;MMR/MSI则为免疫治疗提供了靶点。未来研究需聚焦HRD检测的标准化、耐药机制的破解及联合治疗策略的优化,推动乳腺癌DDR精准治疗的临床转化。
