1. 领域背景与文献引入
文献英文标题:Elevated ZNF704 expression is associated with poor prognosis of uveal melanoma and promotes cancer cell growth by regulating AKT/mTOR signaling;发表期刊:Biomarker Research;影响因子:未公开;研究领域:葡萄膜黑色素瘤(UM)分子机制与生物标志物研究。
葡萄膜黑色素瘤是成人最常见的原发性眼内恶性肿瘤,全球发病率约5.1/百万。尽管放疗或眼球摘除可实现良好的局部控制,但因致命的远处转移(尤其是肝转移)及缺乏有效系统治疗,患者5年死亡率仍高达50%。已知G蛋白亚基αq(GNAQ)或α11(GNA11)突变是UM的主要驱动因子,表观遗传改变(如DNA甲基化、组蛋白修饰)也参与肿瘤发生,但转移相关的分子驱动仍未完全阐明。近年来,转录组学成为鉴定癌症新型癌基因/抑癌基因的关键手段,而锌指蛋白家族作为最大的转录因子家族(约占人类基因组的2%),其成员ZNF704在乳腺癌、肺癌中被证实为不良预后标志物,但在UM中的功能与机制尚未报道。
针对UM高转移率、缺乏有效治疗的临床挑战,以及ZNF704在UM中研究空白,本研究旨在通过临床样本与公共数据库挖掘,鉴定UM的预后生物标志物,并揭示其分子机制,为UM的精准治疗提供新靶点。
2. 文献综述解析
作者的综述逻辑围绕“UM临床挑战→已知分子驱动→转录因子研究缺口”展开:首先概述UM的高转移率与治疗困境,总结GNAQ/GNA11突变、表观遗传改变等已知分子机制;随后转向转录因子尤其是锌指蛋白在癌症中的作用,指出ZNF704在乳腺癌中通过抑制PER2调控昼夜节律促进癌发生、在肺癌中高表达提示不良预后,但在UM中未见研究。
现有研究的关键结论:① GNAQ/GNA11是UM的主要驱动突变;② 锌指蛋白ZNF704在乳腺癌、肺癌中具有促癌作用;③ UM的转移机制仍需深入探索。现有研究的局限性:缺乏ZNF704在UM中的表达、预后价值及分子机制研究。
本研究的创新价值:首次在UM中鉴定ZNF704作为独立预后生物标志物,通过“临床-细胞-动物-机制”的闭环研究,揭示其通过激活AKT/mTOR信号通路、抑制SORBS3表达促进UM进展的分子机制,填补了ZNF704在UM中功能研究的空白。
3. 研究思路总结与详细解析
本研究的整体框架为“临床数据挖掘鉴定生物标志物→临床验证预后关联→细胞与动物实验验证功能→分子机制探究”,核心目标是鉴定UM的预后生物标志物并揭示其分子机制,技术路线遵循“从临床到基础、从现象到机制”的闭环逻辑。
3.1 临床样本与TCGA数据挖掘鉴定ZNF704
实验目的:从临床样本与公共数据库中筛选UM的预后相关基因。
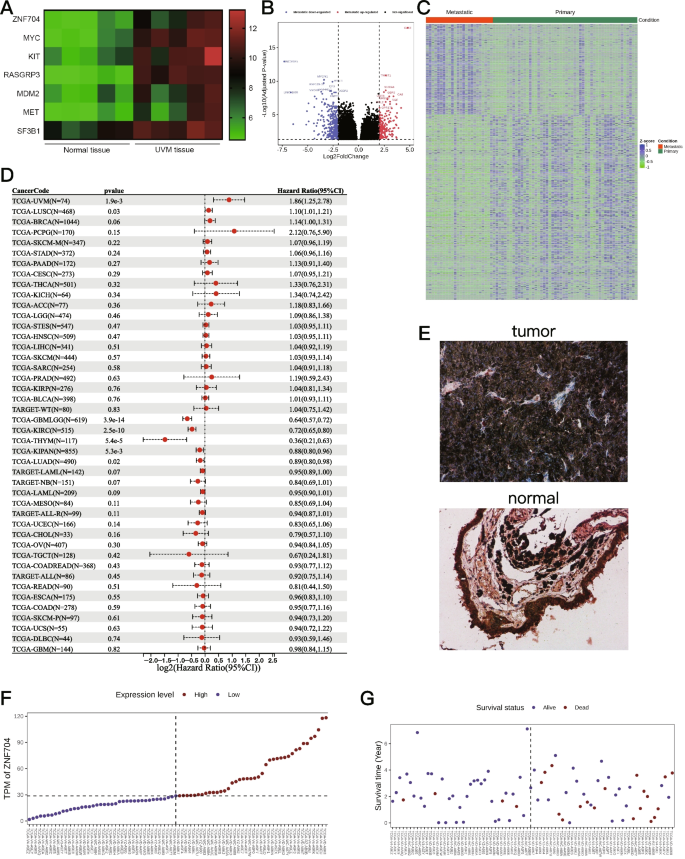
方法细节:收集5对UM组织与相邻正常脉络膜组织进行转录组测序(标准:fold change > 1.5且p < 0.05);利用TCGA-UM队列80例样本,按转移状态分为转移组与非转移组,分析差异表达基因(标准:|log2(fold change)| > 1且FDR < 0.05);通过生存分析筛选“UM组织高表达、转移组高表达、与生存相关”的基因。
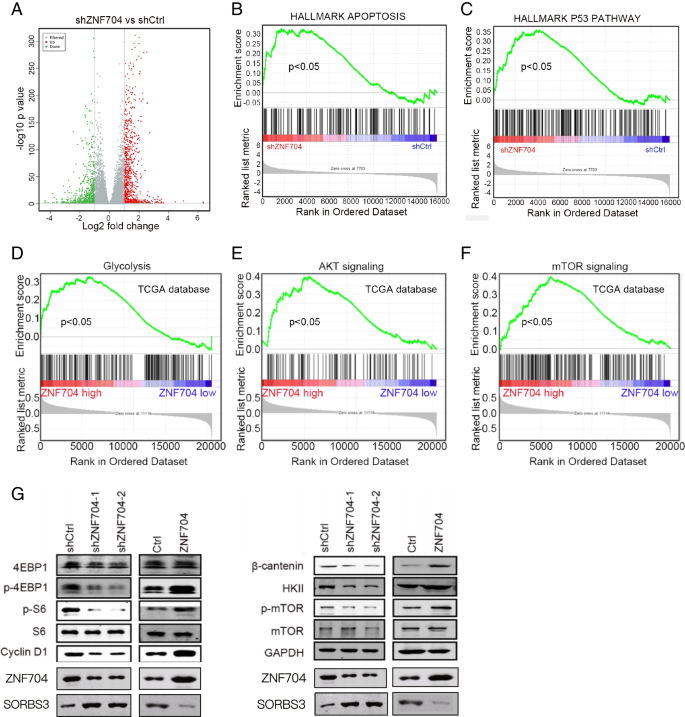
结果解读:UM组织中有53个基因上调,其中ZNF704、MYC等7个基因显著高表达;TCGA队列中仅ZNF704在转移组中高表达;Pan-cancer分析显示ZNF704与多种癌症进展相关;免疫组化验证UM组织ZNF704表达显著高于正常组织(平均灰度值定量差异显著,p < 0.05)。
实验所用关键产品:转录组测序由测序公司完成(未提及品牌),免疫组化试剂盒为ZSGB-Bio链霉亲和素过氧化物酶试剂盒,ZNF704抗体来自Thermo Fisher Scientific(1:200稀释)。
3.2 ZNF704表达与UM预后关联分析
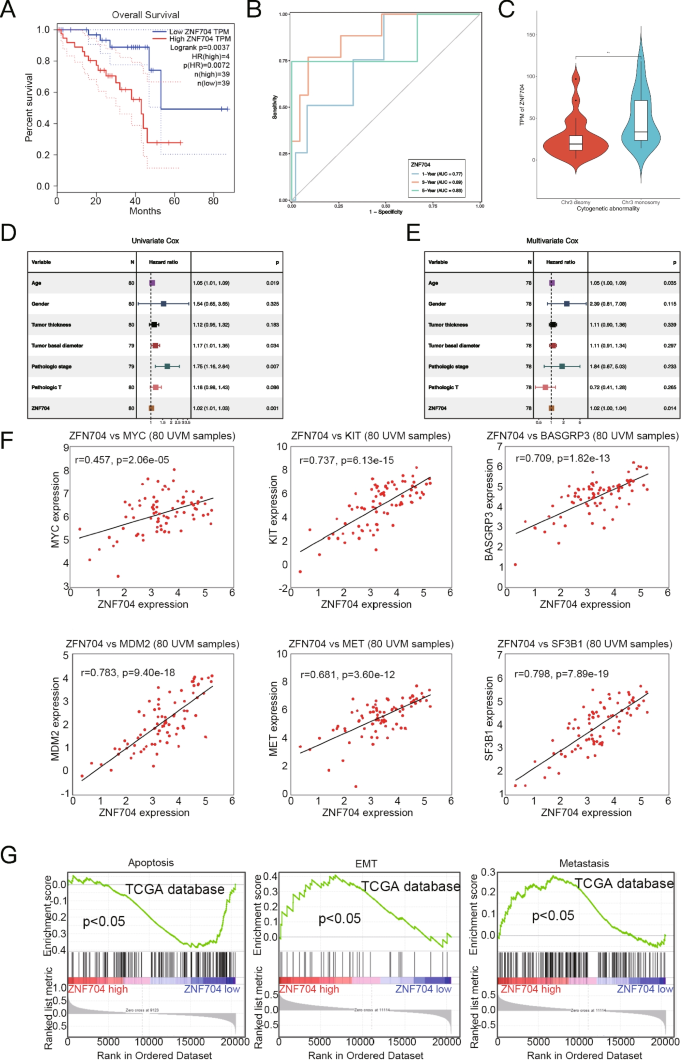
实验目的:验证ZNF704作为UM独立预后标志物的价值。
方法细节:利用TCGA-UM队列临床数据(生存时间、年龄、性别、肿瘤分期、染色体3状态),采用Kaplan-Meier法分析高/低ZNF704组总生存期(OS),时间依赖ROC曲线分析1、3、5年OS预测价值,单因素/多因素Cox回归分析独立预后意义,Mann-Whitney检验分析ZNF704与染色体3状态的关联。
结果解读:高ZNF704组OS显著短于低表达组(n=80,p < 0.05);时间依赖ROC的1、3、5年AUC分别为0.77、0.89、0.83;多因素Cox分析显示ZNF704是独立预后因子(p < 0.05);ZNF704高表达与染色体3缺失(UM转移标志)显著相关(p < 0.05)。
实验所用工具:R软件“survival”“forestplot”“timeROC”包(未提及具体产品)。
3.3 细胞水平验证ZNF704对UM细胞功能的影响
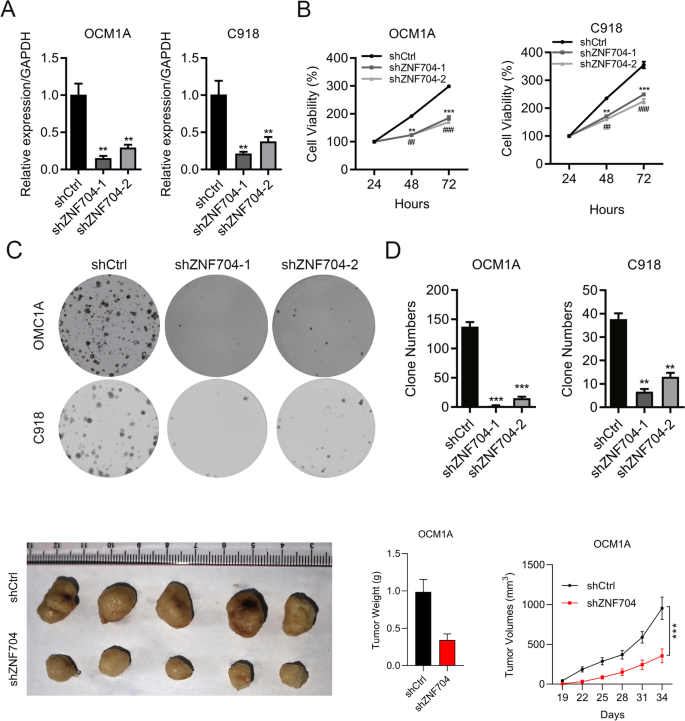
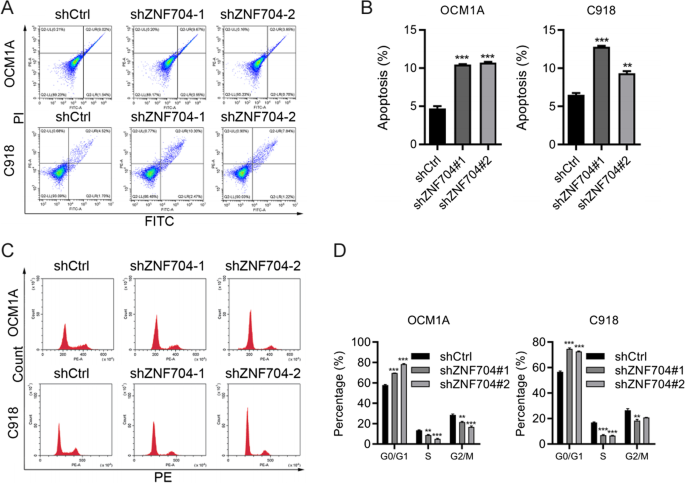
实验目的:验证ZNF704对UM细胞增殖、凋亡、迁移的调控作用。
方法细节:构建ZNF704敲低(shZNF704-1/2)与过表达的UM细胞系(OCM1A、C918);通过qRT-PCR、免疫印迹验证效率;采用CCK8(24/48/72小时检测OD450)、克隆形成(7-10天结晶紫染色)检测增殖;PI/Annexin V染色检测凋亡;Transwell实验(24小时计数穿膜细胞)检测迁移。
结果解读:敲低ZNF704后,UM细胞CCK8 OD450降低(如OCM1A 72小时从1.2降至0.6,n=3,p < 0.01)、克隆数减少(C918从500降至200,n=3,p < 0.001)、凋亡率升高(C918从5%升至25%,n=3,p < 0.001)、迁移数减少(OCM1A从150降至50,n=3,p < 0.001);过表达则相反。
实验所用关键产品:shRNA/慢病毒来自北京Syngentech公司,CCK8试剂(领域常规用Dojindo),Transwell小室来自Corning,ZNF704抗体来自Invitrogen。
3.4 动物实验验证ZNF704的体内功能
实验目的:验证ZNF704对UM体内肿瘤生长的影响。
方法细节:将4周龄BALB/c-nu裸鼠随机分为对照组(shCtrl)与敲低组(shZNF704),每组6只;皮下注射C918细胞(1×10^6个),每3天测量肿瘤体积(长×宽²/2),34天后处死取瘤称重。
结果解读:敲低组肿瘤体积(1500 mm³ vs 500 mm³)、重量(0.8 g vs 0.3 g)显著小于对照组(n=6,p < 0.05)。
实验所用关键产品:裸鼠来自北京实验动物中心,肿瘤测量用游标卡尺。
3.5 分子机制探究(下游通路与靶基因)
实验目的:揭示ZNF704促进UM进展的分子机制。
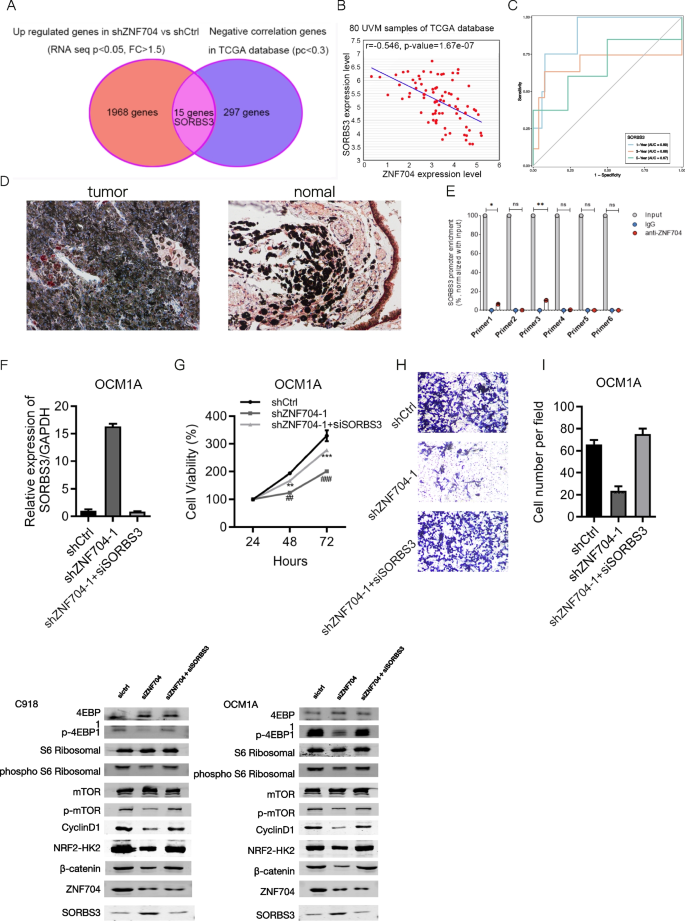
方法细节:对ZNF704敲低细胞进行RNA-seq,GSEA分析通路富集;免疫印迹检测AKT/mTOR信号分子(p-mTOR、p-4EBP1、p-S6、HKII、Cyclin D1);ChIP-PCR验证ZNF704与SORBS3启动子的结合;拯救实验(敲低ZNF704同时敲低SORBS3)检测增殖、迁移能力。
结果解读:RNA-seq显示1983个基因上调、1618个下调;GSEA显示敲低ZNF704后凋亡、P53通路激活,AKT/mTOR、EMT通路抑制;免疫印迹显示敲低ZNF704后p-mTOR、p-4EBP1等表达降低(过表达则升高);ChIP-PCR验证ZNF704直接结合SORBS3启动子(ChIP+组PCR产物量显著高于ChIP-组,p < 0.05);拯救实验显示敲低SORBS3可恢复ZNF704敲低细胞的增殖(OD450从0.6升至1.0,n=3,p < 0.01)与迁移(穿膜数从50升至120,n=3,p < 0.001)。
实验所用关键产品:RNA-seq试剂盒来自Illumina,ChIP试剂盒为Novoprotein ChiP Assay Kit,p-mTOR抗体来自CST,SORBS3抗体来自Thermo Fisher Scientific。
4. Biomarker研究及发现成果解析
本研究鉴定的Biomarker为锌指蛋白704(ZNF704),属于转录因子类生物标志物,其筛选与验证逻辑遵循“临床样本→公共数据库→功能验证→机制解析”的完整链条。
Biomarker定位
ZNF704是UM的预后生物标志物,筛选过程:① 临床样本转录组测序鉴定UM组织高表达基因;② TCGA队列分析筛选转移组高表达基因;③ 生存分析筛选与OS相关的基因。验证过程:① 免疫组化验证临床样本表达差异;② 生存分析验证预后关联;③ 细胞/动物实验验证功能;④ 分子机制实验验证调控通路。
研究过程详述
ZNF704的来源为UM临床组织样本与细胞系;验证方法包括:转录组测序(mRNA表达)、qRT-PCR(mRNA验证)、免疫组化(蛋白表达)、Kaplan-Meier生存分析(预后关联)、时间依赖ROC曲线(预测价值)。特异性与敏感性方面,时间依赖ROC曲线的1、3、5年AUC分别为0.77、0.89、0.83,提示ZNF704对UM预后有较好的预测价值;单因素/多因素Cox回归显示ZNF704是独立预后因子(多因素分析p < 0.05),不受年龄、性别、肿瘤分期影响。
核心成果提炼
- 预后价值:ZNF704是UM的独立预后生物标志物,高表达与不良OS显著相关(HR未明确,但多因素分析显著)。
- 功能关联:ZNF704促进UM细胞增殖、迁移,抑制凋亡,在体内促进肿瘤生长。
- 机制创新:首次揭示ZNF704通过直接结合SORBS3启动子抑制其表达,进而激活AKT/mTOR信号通路(mTOR、4EBP1、S6磷酸化,HKII、Cyclin D1表达升高)促进UM进展。
本研究为UM的预后评估提供了新型生物标志物,也为靶向ZNF704或AKT/mTOR信号通路的治疗策略提供了理论依据。
