1. 领域背景与文献引入
文献英文标题:CETN1 is a cancer testis antigen with expression in prostate and pancreatic cancers;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤生物标志物(癌症睾丸抗原)。
癌症睾丸抗原(CTA)是一类具有“正常睾丸高表达、其他正常组织低表达、癌症组织再激活”特征的基因家族,因正常成人组织表达受限,成为肿瘤免疫治疗靶点及生物标志物开发的核心候选。中心体作为细胞微管组织中心,其异常扩增与肿瘤细胞的无序分裂密切相关,中心体蛋白家族(CETN1-3)中,CETN2在所有器官广泛表达,而前期小鼠研究显示CETN1仅在睾丸组织特异性表达。然而,人类CETN1是否属于CTA家族、其在癌症中的表达模式及调控机制尚未明确,这一空白限制了对CETN1在肿瘤发生中作用的理解。本研究旨在验证人类CETN1的CTA身份,并探索其在前列腺癌和胰腺癌中的表达及调控机制,为肿瘤生物标志物的开发提供新候选。
2. 文献综述解析
作者通过“CETN家族功能→CTA特征→中心体与癌症关联”三大维度,系统评述了现有研究:(1)CETN家族中,CETN2在人体所有器官表达,CETN1在小鼠睾丸特异性表达,但人类CETN1的组织谱未知;(2)CTA的核心特征是“正常睾丸高表达、癌症中再激活”,其调控常与DNA甲基化相关,但CETN1的调控机制未被探索;(3)中心体蛋白异常与癌症相关,但CETN1在人类癌症中的作用无报道。现有研究的局限性在于:缺乏对人类CETN1组织表达谱的系统分析,未明确其是否符合CTA定义,且对其在癌症中的功能及调控机制不清楚。
本研究的创新点在于:首次证实人类CETN1是新的CTA,明确其在前列腺癌和胰腺癌中高表达;揭示CETN1的表达受DNA甲基化调控;通过生物信息学预测其为内在无序蛋白(IDP),为理解其在肿瘤中的功能提供了结构基础。
3. 研究思路总结与详细解析
本研究的整体目标是验证CETN1的CTA身份及在前列腺/胰腺癌中的表达;核心科学问题是CETN1的组织表达模式、癌症中的调控机制及功能特征;技术路线遵循“数据库挖掘→实验验证→机制探索→功能预测”闭环,具体分为以下环节:
3.1 正常组织及睾丸癌中CETN1表达模式分析
实验目的是明确CETN1的组织表达谱,为其CTA身份提供依据。方法上,作者挖掘GEO数据库的公共微阵列数据,分析CETN1-3在正常组织(睾丸、肺、肝等)及睾丸癌(精原细胞瘤、胚胎癌等)中的mRNA表达。结果显示:人类CETN1在正常睾丸中特异性高表达,其他正常组织几乎无表达(图1);与正常睾丸相比,CETN1在睾丸癌(如精原细胞瘤、胚胎癌)中表达显著下调(正常睾丸n=6,精原细胞瘤n=12,胚胎癌n=15,文献未明确倍数)(图3)。这一结果符合CTA“正常睾丸高表达、睾丸癌下调”的核心特征,初步提示CETN1为CTA。
实验所用关键产品:文献未提及具体数据库工具,领域常规使用GEO数据库及GEO2R分析软件。
<图片1:
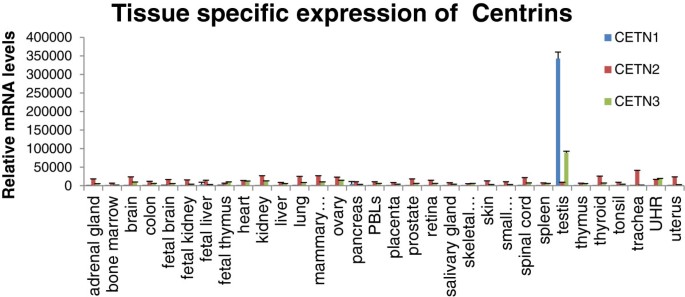
>
<图片3:
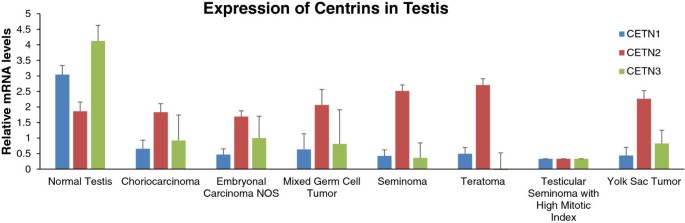
>
3.2 前列腺癌及胰腺癌中CETN1表达验证
实验目的是验证CETN1在前列腺癌和胰腺癌中的表达,明确其肿瘤相关性。方法上,作者收集临床前列腺癌样本(n=37)、正常前列腺组织(n=23)及胰腺癌异种移植瘤样本(n=20)、正常胰腺组织(n=5),通过qPCR检测CETN1 mRNA水平。结果显示:前列腺癌中CETN1表达较正常高6倍(n=37 vs n=23,文献未明确P值);胰腺癌异种移植瘤中CETN1表达较正常高25倍(n=20 vs n=5,文献未明确P值)(图2)。这一结果证实CETN1在前列腺癌和胰腺癌中“再激活”表达,符合CTA的癌症相关性特征。
实验所用关键产品:qPCR使用iScript cDNA合成试剂盒(Bio-Rad)、iQ SYBR Green Supermix(Bio-Rad);RNA提取使用RNeasy试剂盒(Qiagen)。
<图片2:
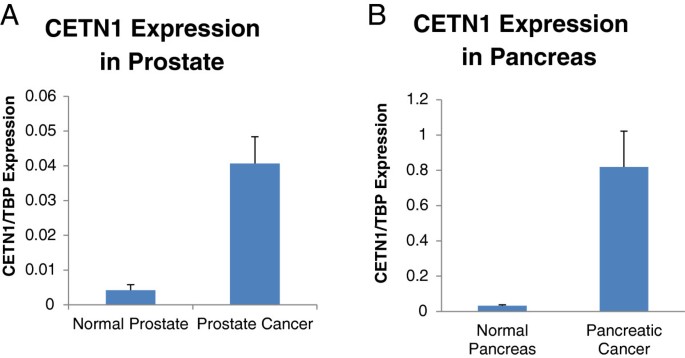
>
3.3 细胞系中CETN1表达的调控机制研究
实验目的是探索CETN1的表达调控机制,重点关注DNA甲基化的作用。方法上,作者选取正常前列腺上皮细胞(PrEC)、良性前列腺细胞(BPH1)、前列腺癌细胞(CWR22、DU145)及结肠癌细胞(SW480),用DNA甲基化抑制剂5-AZA(3μmol/L,72小时)单独处理,或联合组蛋白去乙酰化酶抑制剂TSA(300nmol/L,最后24小时)处理,随后qPCR检测CETN1表达。结果显示:未处理的细胞系中CETN1表达极低;5-AZA单独或联合TSA处理后,CETN1表达显著升高,而TSA单独处理无效果(图4)。这提示CETN1的表达主要受DNA甲基化调控,组蛋白乙酰化影响较小。
实验所用关键产品:5-AZA和TSA购自Sigma Aldrich;细胞培养使用RPMI培养基(Invitrogen)、前列腺上皮细胞基础培养基(PrEGM,Lonza)及配套BulletKit(Lonza)。
<图片4:
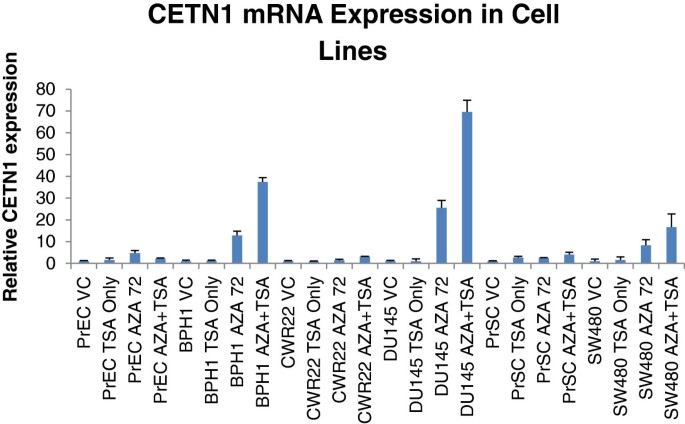
>
3.4 CETN1的内在无序性生物信息学分析
实验目的是预测CETN1的蛋白质结构特征,探索其功能潜力。方法上,作者使用FoldIndex(基于电荷-疏水性)和RONN(基于神经网络)两种算法,分析人类CETN1-3及酵母同源蛋白CDC31的内在无序性。结果显示:两种算法均预测CETN1为内在无序蛋白(IDP),无序区域占比高。这提示CETN1可能作为“枢纽蛋白”,通过参与多种蛋白互作网络调控肿瘤发生。
实验所用关键产品:文献未提及具体工具,领域常规使用FoldIndex(http://bip.weizmann.ac.il/fldbin/findex)和RONN(http://www.bioinformatics.nl/~berndb/ronn.html)在线工具。
3.5 酵母CDC31功能互补实验
实验目的是验证CETN1与酵母CDC31的功能保守性。方法上,作者在酵母中表达CDC31、CETN1、CETN2及GFP融合的CETN1/2,随后敲除 endogenous CDC31基因,观察细胞生长。结果显示:CETN1和CETN2均无法补偿CDC31敲除后的生长缺陷,提示人类CETN1与酵母CDC31的功能不保守。
实验所用关键产品:文献未提及具体试剂,领域常规使用酵母穿梭载体(如pRS系列)和同源重组基因敲除方法。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的生物标志物为CETN1(中心体蛋白1),属于“癌症睾丸抗原(CTA)”类生物标志物。其筛选逻辑遵循“数据库初筛→临床样本验证→细胞系机制验证”的完整链条:首先通过GEO数据库发现CETN1的正常睾丸特异性表达(符合CTA特征);随后通过qPCR验证其在前列腺癌和胰腺癌中高表达;最后通过甲基化抑制剂处理明确其调控机制,完成对CETN1的CTA验证。
研究过程详述
CETN1的来源包括:临床前列腺癌样本、胰腺癌异种移植瘤样本及正常组织样本;验证方法主要为qPCR检测mRNA表达,甲基化抑制剂处理验证调控机制;特异性方面,CETN1在正常睾丸高表达,其他正常组织几乎无表达(组织特异性);敏感性方面,在前列腺癌和胰腺癌中显著高表达,但文献未提供ROC曲线的AUC值及具体敏感性、特异性数值。
核心成果提炼
- 功能关联:CETN1是新的CTA,在前列腺癌和胰腺癌中高表达,可作为潜在的肿瘤生物标志物;其表达受DNA甲基化调控,为CTA的“癌症再激活”机制提供了新证据。
- 创新性:首次证实人类CETN1是CTA,明确其在前列腺癌和胰腺癌中的表达及调控机制;通过生物信息学预测其为内在无序蛋白,为理解其在肿瘤中的功能提供了结构基础。
- 统计学结果:前列腺癌中CETN1表达较正常高6倍(n=37 vs n=23);胰腺癌异种移植瘤中高25倍(n=20 vs n=5);5-AZA处理后细胞系中CETN1表达显著升高(文献未明确P值)。
本研究通过多层面实验,明确了CETN1的CTA身份及在前列腺癌、胰腺癌中的表达特征,为肿瘤生物标志物的开发及CTA调控机制的研究提供了新的线索。
