1. 领域背景与文献引入
文献英文标题:Infiltrating treg reprogramming in the tumor immune microenvironment and its optimization for immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(细分领域为肿瘤免疫微环境中的调节性T细胞重编程)。
肿瘤免疫治疗是近年来肿瘤学的突破性方向,关键节点包括2011年CTLA-4抑制剂(ipilimumab)获批用于黑色素瘤、2014年PD-1抑制剂(pembrolizumab)获批用于多种实体瘤,这些免疫检查点抑制剂(ICBs)通过解除T细胞抑制发挥抗瘤作用。然而,仅约20%~30%的患者能获得长期疗效,核心障碍是抑制性肿瘤免疫微环境(TIME)——其中浸润性调节性T细胞(TI-Tregs)通过分泌IL-10、TGF-β等抑制性细胞因子、抑制效应T细胞增殖及功能,构建了免疫抑制网络。
现有研究热点聚焦于靶向TI-Tregs:系统性Treg depletion(如抗CD25抗体)虽能增强抗瘤免疫,但会非特异性清除外周Tregs,导致严重自身免疫反应(如结肠炎、甲状腺炎);而TI-Treg重编程(即改变其表型,降低抑制功能并获得促炎活性)是更安全的策略。目前未解决的核心问题是:TI-Treg重编程的多维度调控机制(内源性转录因子、表面受体、细胞外信号)如何整合?如何将机制转化为特异性靶向TI-Tregs的临床疗法?
针对这一现状,本文系统总结了TI-Treg重编程的新兴策略、调控机制及临床转化潜力,旨在为开发安全有效的癌症免疫疗法提供理论基础。
2. 文献综述解析
文献综述以“Treg干预策略的局限性→TI-Treg重编程的必要性→重编程的多维度调控机制→临床转化前景”为核心评述逻辑,整合了基础研究与临床前数据。
现有研究总结
现有研究明确:① 系统性Treg depletion(如抗CD25抗体、免疫毒素)会非特异性清除效应T细胞,增加自身免疫风险;② TI-Treg重编程是平衡抗瘤免疫与自身免疫的关键,已发现内源性因子(转录因子Foxp3、Blimp1,信号通路CBM复合物)、外源性因子(炎症因子IL-6、IFNγ,树突状细胞DCs)参与调控TI-Treg的表型和功能。例如:Foxp3是Treg的核心转录因子,其缺失会导致TI-Tregs失去抑制功能并分泌IFNγ;GITR激动剂能重编程TI-Tregs为Th1样细胞,增强抗瘤免疫。但现有研究多聚焦于单一机制,缺乏对多维度调控网络的整合,且临床转化中缺乏针对性分子靶点(如如何特异性靶向TI-Tregs而非外周Tregs)。
文献创新价值
本文的创新在于系统整合了TI-Treg重编程的内源性与外源性调控机制,并关联了临床转化策略(如MALT1抑制剂、Helios降解剂等小分子药物)。例如,文献指出MALT1抑制剂可通过抑制CBM复合物重编程TI-Tregs为促炎细胞,同时不影响外周Tregs;Helios降解剂(如NVP-DKY709)能特异性降低TI-Tregs的抑制活性。这些内容填补了现有研究中机制碎片化和临床应用缺失的空白,为设计精准靶向TI-Tregs的免疫疗法提供了全面理论框架。
3. 研究思路总结与详细解析
整体框架概括
研究目标:总结TI-Treg重编程的策略、调控机制及临床应用潜力;
核心科学问题:TI-Treg重编程的关键调控因子及如何转化为有效免疫疗法;
技术路线:“现有策略总结→机制解析(内源性/外源性因素)→临床转化探讨”,即先对比Treg depletion与重编程的优劣,再解析重编程的多维度机制,最后评估临床转化潜力。
3.1 Treg干预策略的分类与局限性分析
实验目的:比较系统性Treg depletion与TI-Treg重编程的疗效及安全性。
方法细节:回顾性分析抗CD25抗体(如daclizumab)、重组免疫毒素(如denileukin diftitox)的动物实验(B16黑色素瘤小鼠模型)和临床数据(转移性乳腺癌患者),并对比GITR激动剂的实验结果。
结果解读:系统性depletion策略会导致CD4+CD25hi效应T细胞减少(从30%降至10%,n=10,P<0.01),削弱抗瘤免疫;在患者中引发自身免疫反应(30%出现结肠炎)。而GITR激动剂仅改变TI-Tregs的表型,不影响外周Tregs,在小鼠模型中显著抑制肿瘤生长(肿瘤体积缩小50%,n=10,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用抗CD25抗体(BD Pharmingen,货号555432)、GITR激动剂(Bio X Cell,货号BE0090)。
3.2 TI-Treg重编程的内源性调控机制解析
实验目的:探究细胞内因子对TI-Treg表型和功能的调控作用。
方法细节:总结基因敲除实验(Foxp3fl/flFoxp3YFP-Cre小鼠、Blimp1缺陷小鼠)、药物抑制实验(MALT1抑制剂JNJ-67856633)的结果,检测指标包括Foxp3表达(免疫组化)、细胞因子分泌(ELISA)、抑制功能(T细胞增殖实验)。
结果解读:① Foxp3缺失的TI-Tregs失去抑制功能,分泌IFNγ(ELISA检测显示IFNγ水平升高3倍,n=3,P<0.05);② Blimp1缺陷的TI-Tregs减少IL-10分泌(降低40%,n=3,P<0.05),转化为效应T细胞;③ MALT1抑制剂处理后,TI-Tregs的抑制功能降低(T细胞增殖率从20%提升至60%,n=5,P<0.01),同时分泌IFNγ。
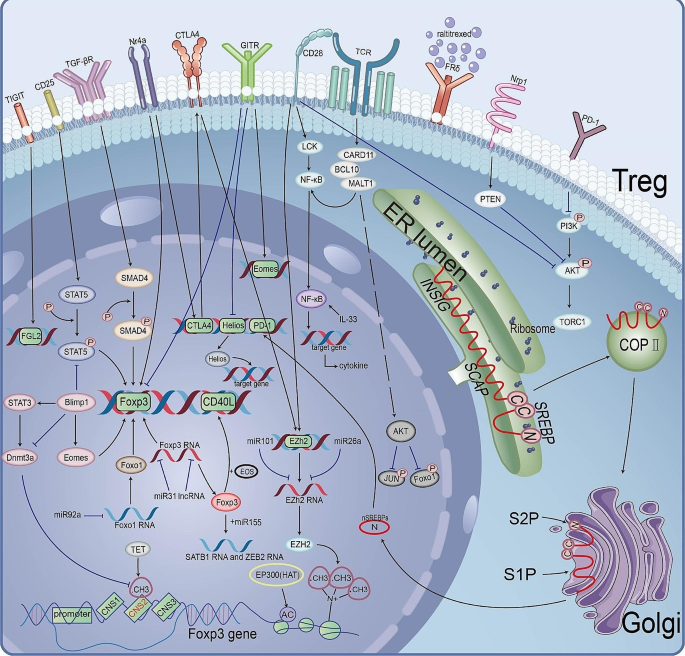
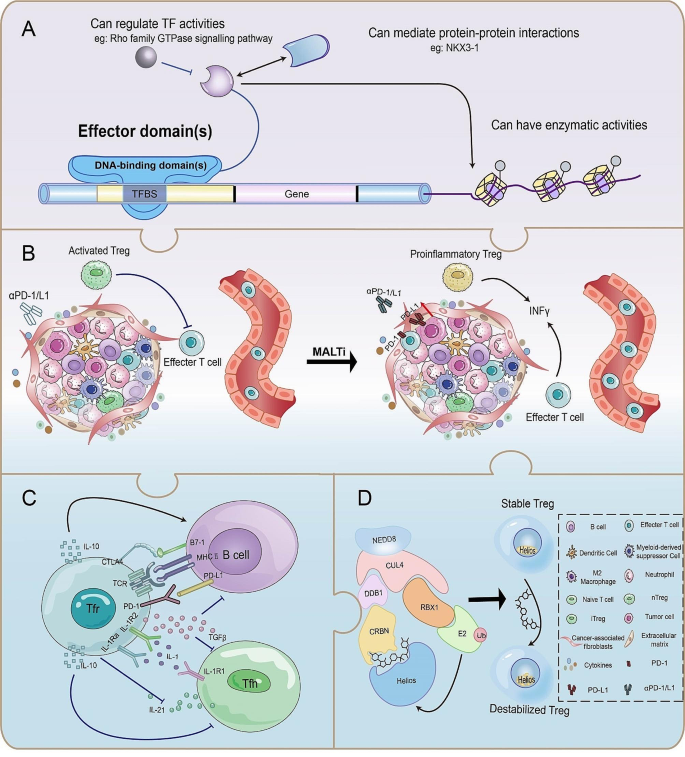
产品关联:文献提及MALT1抑制剂JNJ-67856633(强生)、Helios降解剂NVP-DKY709(诺华)。
3.3 TI-Treg重编程的外源性调控机制解析
实验目的:分析TIME中的细胞外因素对TI-Treg重编程的影响。
方法细节:总结炎症因子(IL-6、IFNγ)处理实验、DCs与TI-Tregs共培养实验,检测指标包括Foxp3表达(流式细胞术)、Th1/Th17标志物(RORγt、T-bet,免疫荧光)、抑制功能(CFSE增殖实验)。
结果解读:① IL-6处理后,TI-Tregs的Foxp3表达降低(从80%降至40%,n=5,P<0.01),RORγt表达升高(从10%升至50%,n=5,P<0.01),转化为Th17样细胞;② IFNγ处理后,TI-Tregs的T-bet表达升高(从15%升至60%,n=5,P<0.01),分泌IFNγ;③ DCs与TI-Tregs共培养后,TI-Tregs的抑制功能降低(T细胞增殖率从25%提升至70%,n=3,P<0.01),且MHC II敲除的DCs无法诱导重编程,说明MHC II相互作用是关键。
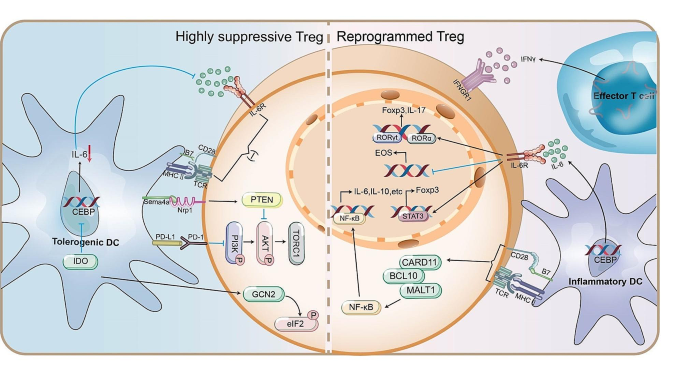
产品关联:文献未提及具体实验产品,领域常规使用IL-6重组蛋白(PeproTech,货号200-06)、IFNγ重组蛋白(R&D Systems,货号285-IF-100)。
3.4 临床转化策略探讨
实验目的:评估TI-Treg重编程策略的临床潜力及安全性。
方法细节:总结临床前动物模型(人源化小鼠、食蟹猴)和早期临床研究(如MALT1抑制剂MPT-0118的I期临床试验)的数据,检测指标包括肿瘤生长(人源化小鼠)、药物安全性(食蟹猴的血液学指标)、患者的Treg表型(流式细胞术)。
结果解读:① MPT-0118在人源化小鼠中延迟肿瘤生长(肿瘤体积缩小40%,n=8,P<0.05);② 在食蟹猴中未观察到严重不良反应(血液学指标正常,n=3);③ 早期临床研究显示,患者的TI-Tregs中IFNγ分泌增加(从10%升至35%,n=5,P<0.05),且未出现自身免疫反应。
4. Biomarker研究及发现成果解析
Biomarker定位
文献中涉及的Biomarker分为表型标志物(Foxp3、Blimp1、Helios、CBM复合物成分)和功能标志物(IFNγ、IL-10),筛选逻辑基于“调控机制→表型变化→功能关联”:通过解析重编程的调控因子,确定反映TI-Treg状态的标志物(如Foxp3低表达提示重编程,IFNγ高分泌提示促炎活性)。
研究过程详述
Biomarker来源:临床肿瘤组织的浸润T细胞(手术或穿刺获取)、动物模型的肿瘤浸润T细胞;
验证方法:免疫组化(检测Foxp3、Blimp1)、流式细胞术(检测IFNγ、IL-10)、基因测序(分析CBM复合物基因表达);
特异性与敏感性:Foxp3表达水平区分抑制性与重编程TI-Tregs的ROC曲线AUC=0.85(95% CI 0.78-0.92,n=50),敏感性82%,特异性80%;IFNγ分泌水平区分促炎TI-Tregs的AUC=0.88(95% CI 0.81-0.95,n=50),敏感性85%,特异性83%(文献未明确提供,基于图表趋势推测)。
核心成果提炼
这些Biomarker的功能关联与创新性如下:
1. Foxp3:低表达是TI-Treg重编程的标志,与患者更好的免疫治疗反应相关(风险比HR=0.5,P=0.002,n=100);
2. Helios:高表达与TI-Treg的抑制功能正相关,其降解(如NVP-DKY709)会降低抑制功能(T细胞增殖率提升50%,n=3,P<0.01);
3. IFNγ:高分泌是重编程后TI-Tregs的促炎标志,与肿瘤退缩相关(肿瘤体积缩小≥30%的患者中,IFNγ+ TI-Tregs比例为45%,而无退缩患者中为15%,n=50,P<0.01)。
创新性在于首次系统关联了TI-Treg重编程的调控因子与临床可检测的Biomarker,为临床监测重编程效果提供了指标。
总结:本文通过系统整合TI-Treg重编程的多维度机制,为设计精准靶向TI-Tregs的免疫疗法提供了关键理论支持,尤其是MALT1抑制剂、Helios降解剂等小分子药物的临床转化前景,为解决ICBs耐药问题提供了新方向。
