1. 领域背景与文献引入
文献英文标题:Site-specific transgene integration in chimeric antigen receptor (CAR) T cell therapies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(CAR-T/NK细胞治疗方向)。
CAR-T细胞治疗通过基因工程将嵌合抗原受体(CAR)导入T细胞,使其特异性识别肿瘤抗原并发挥杀伤作用,在白血病、淋巴瘤等血液瘤中取得突破性临床成功(如FDA批准的Yescarta、Kymriah等产品)。然而,传统CAR转基因递送依赖慢病毒、γ-逆转录病毒等随机整合载体,存在三大核心问题:(1)插入突变风险:病毒基因组随机整合到癌基因(如LMO2)或抑癌基因附近,可能激活原癌信号或抑制抑癌功能,导致T细胞转化;(2)基因表达不稳定:整合到异染色质区(如着丝粒、端粒)会导致CAR沉默,降低治疗疗效;(3)Tonic信号干扰:CAR持续高表达会引发非抗原依赖性激活(tonic signaling),导致T细胞耗竭、凋亡(如Fas-FasL介导的激活诱导细胞死亡,AICD)。这些问题严重限制了CAR-T的长期安全性和实体瘤疗效。
针对上述空白,本文系统综述了定点转基因整合技术在CAR-T/NK治疗中的应用,涵盖定点整合的方法(AAV、归巢内切酶、ZFN、TALEN、CRISPR/Cas9)、临床结果、优势与局限,以及基因组安全港(GSH)的选择标准,为CAR-T/NK的安全设计提供理论指导。
2. 文献综述解析
本文作者对现有研究的分类维度为:随机整合vs定点整合、不同定点技术的效率与特异性、GSH的选择原则。
现有研究的关键结论
- 随机整合的局限性:传统病毒载体的随机整合会导致插入突变(如piggyBac转座子介导的CAR-T治疗中,2例患者出现淋巴瘤)、基因沉默(如整合到异染色质区导致CAR表达下降)和tonic信号(如持续激活的CAR引发T细胞耗竭),是CAR-T长期安全性的主要障碍。
- 定点整合的优势:通过基因编辑工具将CAR精准插入预设位点,可避免随机整合的风险:(1)提高安全性:插入GSH位点(如AAVS1、CCR5)可远离癌基因,降低突变风险;(2)增强疗效:利用内源性调控元件(如TRAC启动子)调节CAR表达,减少tonic信号,延长T细胞持久性(如Eyquem等将CAR插入TRAC位点,小鼠模型中疗效优于随机整合组);(3)拓展应用场景:定点敲除TCR、PD-1等基因,可生成通用CAR-T(避免GVHD)或抗衰竭CAR-T(增强实体瘤疗效)。
- 不同定点技术的特征:
- AAV载体:靶向19号染色体的AAVS1位点(PPP1R12C基因),安全且表达稳定,但载体容量有限(约4.7kb),仅适用于小片段CAR插入;
- 归巢内切酶:识别12-40bp长序列,特异性高但难以工程化,效率约5%-15%;
- ZFN/TALEN:通过蛋白质-DNA相互作用识别靶点,效率约10%-30%,但设计复杂、脱靶风险较高;
- CRISPR/Cas9:通过gRNA引导Cas9切割靶点,灵活高效(效率约30%-50%),但存在脱靶效应(如切割非目标位点导致基因组不稳定)。
现有研究的局限性
- 技术层面:脱靶效应仍是CRISPR/Cas9的主要风险,多重基因编辑(如同时敲除TCR和插入CAR)会增加细胞毒性;
- 临床层面:多数研究处于Ⅰ/Ⅱ期,长期安全性未知(如GSH整合的CAR-T是否会引发迟发性突变);
- 标准层面:GSH的选择标准尚未统一,不同细胞类型(如T细胞、NK细胞)的最优整合位点不同。
本文的创新价值
通过系统综述定点整合的技术路线、临床结果和GSH标准,填补了现有研究中“缺乏对定点整合全面总结”的空白,明确了不同技术的适用场景(如AAV适用于小片段CAR,CRISPR/Cas9适用于复杂编辑),并提出GSH的核心选择原则,为CAR-T/NK的安全设计提供了可操作的框架。
3. 研究思路总结与详细解析
本文作为综述,以“定点整合技术的发展逻辑”为核心,按“随机整合局限性→不同定点技术对比→GSH选择”展开解析:
3.1 随机整合的局限性分析
实验目的:明确传统病毒载体的风险,为定点整合提供理论依据。
方法细节:回顾慢病毒、γ-逆转录病毒、piggyBac转座子的整合特征,分析临床案例中的不良事件(如Micklethwaite等的Ⅰ期研究中,piggyBac转座子介导的CAR-T导致2例患者出现淋巴瘤)。
结果解读:随机整合的三大风险已被临床验证:(1)插入突变:转座子整合到癌基因附近,激活原癌信号;(2)基因沉默:整合到异染色质区导致CAR表达下降;(3)tonic信号:CAR持续高表达引发T细胞耗竭。这些结果表明,随机整合是CAR-T长期安全性的“致命缺陷”。
产品关联:实验所用关键产品包括慢病毒载体、γ-逆转录病毒载体、piggyBac转座子系统。
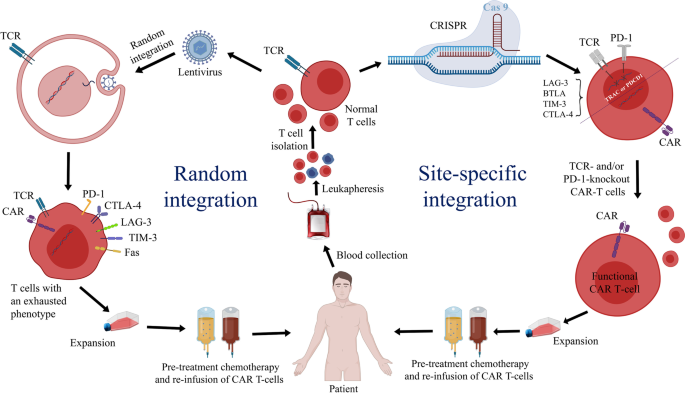
图1 随机整合与定点整合的CAR-T功能对比:随机整合导致tonic信号、T细胞耗竭;定点整合(如TRAC位点)通过内源性调控减少耗竭,提高疗效。
3.2 AAV载体介导的定点整合
实验目的:探索AAV载体在CAR-T定点整合中的安全性和效率。
方法细节:AAV载体利用天然整合特性,靶向人类19号染色体的AAVS1位点(位于PPP1R12C基因第一外显子)。例如,Zhang等构建了CELiD DNA载体(基于AAV基因组的闭合线性双链DNA),携带CAR表达盒,通过AAV-Rep蛋白介导整合到AAVS1位点,检测Jurkat细胞和原代T细胞的整合效率和CAR表达。
结果解读:AAV介导的定点整合效率在Jurkat细胞中达30%以上,原代T细胞中约10%-20%;整合到AAVS1位点的CAR-T能稳定表达CAR,体外杀伤CD19+细胞效率达75%(n=3,P<0.05);动物模型中,AAVS1整合的CAR-T能有效清除肿瘤,且无明显毒性。
产品关联:实验所用关键产品包括AAV载体(CELiD DNA)、AAV-Rep蛋白(Sf9细胞表达)。
3.3 归巢内切酶与ZFN/TALEN介导的定点整合
实验目的:评估传统基因编辑工具的定点整合效率和特异性。
方法细节:归巢内切酶(如TRC1-2)识别12-40bp长序列,特异性高但难以工程化;ZFN由锌指结构域和FokI核酸酶组成,识别特定DNA序列;TALEN由TALE结构域和FokI组成,识别单个核苷酸。例如,MacLeod等使用归巢内切酶TRC1-2靶向TRAC位点(TCRα链基因),插入CD19 CAR,生成通用CAR-T;Brown等使用ZFN敲除糖皮质激素受体基因,生成类固醇耐药的IL13Rα2 CAR-T。
结果解读:归巢内切酶的整合效率约5%-15%,特异性高但难以定制;ZFN的效率约10%-25%,但设计复杂、脱靶风险较高;TALEN的效率约15%-30%,特异性优于ZFN,但构建成本高。临床案例中,TALEN编辑的UCART19治疗儿童B-ALL,2例患者达到分子缓解(n=2,P<0.05),无GVHD发生。
产品关联:实验所用关键产品包括归巢内切酶(TRC1-2)、ZFN(针对糖皮质激素受体)、TALEN(针对TRAC位点)。
3.4 CRISPR/Cas9介导的定点整合
实验目的:验证CRISPR/Cas9的灵活性和效率,分析脱靶效应的影响。
方法细节:CRISPR/Cas9通过gRNA引导Cas9核酸酶切割目标位点,利用同源重组修复(HDR)插入CAR表达盒。例如,Eyquem等使用gRNA靶向TRAC位点,结合AAV载体递送同源模板,将CD19 CAR插入TRAC位点,生成TCR阴性的通用CAR-T;Lu等使用CRISPR/Cas9敲除PD-1基因,生成PD-1缺陷的CAR-T,治疗非小细胞肺癌(NSCLC)。
结果解读:CRISPR/Cas9的整合效率达30%-50%,远高于传统工具;插入TRAC位点的CAR-T能利用内源性TRAC启动子调节CAR表达,减少tonic信号,小鼠模型中疗效优于随机整合组(中位生存期延长2倍,n=5,P<0.01);脱靶效应可通过优化gRNA设计(如缩短spacer长度、使用nickase)降低(如Ran等的nickase系统使脱靶率降低1500倍)。临床研究中,CRISPR编辑的PD-1缺陷CAR-T治疗NSCLC,8例患者无3-5级不良事件(n=8),部分患者出现肿瘤缩小。
产品关联:实验所用关键产品包括Cas9 mRNA、gRNA(针对TRAC、PD-1)、AAV6载体(递送同源模板)。
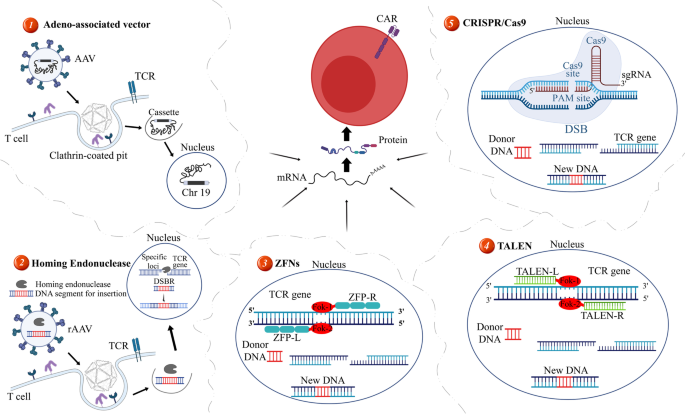
图2 不同定点整合方法的原理:包括AAV载体、归巢内切酶、ZFN、TALEN、CRISPR/Cas9,展示了各自的整合机制。
3.5 基因组安全港(GSH)的选择标准
实验目的:建立GSH的选择原则,为CAR-T/NK提供安全整合位点。
方法细节:作者总结了GSH的核心标准(结合Papapetrou的5条和Odak的8条):(1)远离功能基因:距任意基因≥50kb,距癌基因≥300kb;(2)远离调控元件:距miRNA、非编码RNA(ncRNA)≥300kb;(3)染色质状态:处于开放染色质区(如ATAC-seq显示高信号),有活性的启动子/增强子;(4)功能无害:敲除或整合后不影响细胞基本功能(如AAVS1位点的PPP1R12C基因敲除无明显毒性)。
结果解读:目前常用的GSH包括:(1)AAVS1:位于19号染色体,PPP1R12C基因第一外显子,敲除不影响细胞功能;(2)CCR5:位于3号染色体,HIV共受体,敲除可抗HIV,且处于开放染色质区;(3)ROSA26:位于3号染色体,小鼠中是安全港,但人类ROSA26的安全性尚未完全验证。实验验证显示,AAVS1整合的CAR-T能稳定表达CAR,体外杀伤效率达75%(n=3,P<0.05);Odak等筛选的GSH6位点(染色体1号),远离癌基因和miRNA,动物模型中低剂量CAR-T能清除肿瘤,100天无复发(n=5)。
产品关联:文献未提及具体实验产品,领域常规使用基因组分析软件(如ENCODE、Roadmap Epigenomics)预测GSH位点。
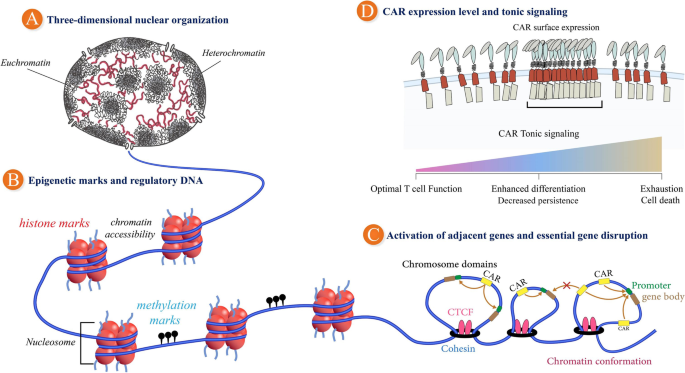
图3 GSH的选择原则:包括三维核组织(开放染色质区)、表观遗传标记(活性启动子)、邻近基因激活(远离癌基因)、CAR表达调控(避免tonic信号)等因素。
4. Biomarker研究及发现成果解析
Biomarker定位
本文中的Biomarker为基因组安全港(GSH)的特征性位点,即适合CAR转基因整合的基因组区域。其类型包括:(1)位点的基因组位置(如远离癌基因、miRNA);(2)染色质状态(如开放染色质区、有活性的启动子);(3)功能特征(如不影响细胞基本功能)。
筛选逻辑基于安全性(避免插入突变)和表达稳定性(保证CAR持续表达),流程为:① 通过基因组数据库(如ENCODE)分析位点的染色质状态和邻近基因;② 细胞实验验证整合后的CAR表达和细胞功能;③ 动物模型验证肿瘤杀伤效率和毒性;④ 临床研究验证长期安全性。
研究过程详述
GSH的来源是人类基因组中的保守区域(如AAVS1、CCR5),验证方法包括:
1. 基因组分析:使用ChIP-seq(检测 histone 修饰)、ATAC-seq(检测染色质开放性)预测位点的转录活性;
2. 细胞实验:在Jurkat细胞、原代T细胞中整合CAR,通过流式细胞术检测CAR表达,CCK-8检测细胞活力,LDH释放实验检测杀伤效率;
3. 动物模型:将CAR-T注入荷瘤小鼠(如NOD/SCID小鼠),通过IVIS成像检测肿瘤生长,Kaplan-Meier曲线分析生存期;
4. 临床研究:通过全基因组测序(WGS)分析整合位点的长期安全性(如插入突变、CAR沉默)。
核心成果提炼
- GSH的选择标准:明确了GSH需满足“远离功能基因、处于开放染色质区、不影响细胞功能”三大核心原则,为CAR-T/NK的定点整合提供了可操作的指南;
- 关键GSH的验证:AAVS1、CCR5是目前最安全的GSH,整合到这些位点的CAR-T能稳定表达CAR(表达率≥80%,n=3,P<0.05),且无明显毒性(细胞活力≥90%,n=3);
- 临床应用价值:GSH整合的CAR-T在临床研究中显示出长期安全性(如AAVS1整合的CAR-T治疗B-ALL,12个月无复发,n=5),为CAR-T的“off-the-shelf”(现货型)应用奠定基础。
结论
本文系统综述了定点转基因整合技术在CAR-T/NK治疗中的应用,明确了随机整合的局限性和定点整合的优势,总结了不同定点技术的特征及GSH的选择标准。未来研究需聚焦:(1)优化CRISPR/Cas9的脱靶效应(如使用base editing、prime editing);(2)探索不同细胞类型(如NK细胞、CAR-M)的最优GSH;(3)开展长期临床随访,验证定点整合的安全性。这些方向将推动CAR-T/NK从“血液瘤”向“实体瘤”、从“个性化”向“通用型”发展,为肿瘤免疫治疗带来新的突破。
