1. 领域背景与文献引入
文献英文标题:BRD4: an effective target for organ fibrosis;发表期刊:Biomarker Research;影响因子:未公开;研究领域:器官纤维化与表观遗传学调控。
器官纤维化是慢性组织损伤后的过度修复反应,其核心特征是肌成纤维细胞激活和细胞外基质(ECM)过度沉积,最终导致器官功能衰竭。据统计,纤维化贡献了全球45%的死亡原因,涉及心脏、肺、肝、肾等多个器官。目前,仅吡非尼酮和尼达尼布获批用于特发性肺纤维化(IPF)的治疗,但仅能延缓疾病进展,无法逆转纤维化;而心脏、肝、肾纤维化尚无临床获批药物,亟需挖掘新型治疗靶点。
表观遗传学调控(尤其是组蛋白乙酰化)是纤维化的关键机制之一。溴域和额外终端结构域(BET)家族作为“表观遗传阅读器”,可识别乙酰化组蛋白并促进靶基因转录。其中,溴域含蛋白4(BRD4)是BET家族研究最深入的成员,参与炎症反应、上皮-间质转化(EMT)、ECM沉积等纤维化核心过程。近年研究显示,抑制BRD4可减轻多种器官纤维化,但BRD4抑制剂尚未进入临床应用。本综述整合了BRD4在不同器官纤维化中的作用机制及抑制剂研究进展,旨在明确BRD4作为抗纤维化靶点的潜力,为临床转化提供理论基础。
2. 文献综述解析
作者以“器官类型”为分类维度,系统总结了BRD4在心脏、肺、肝、肾纤维化中的作用及机制,核心逻辑如下:
现有研究的关键结论
- 心脏纤维化:BRD4通过TGF-β/Smad、NF-κB通路促进心肌成纤维细胞(CFs)激活,富集于纤维化基因(如Acta2、Col1a1)的启动子/增强子区域;JQ1、C-34等抑制剂可抑制CFs增殖和ECM沉积,改善心脏功能。
- 肺纤维化:BRD4通过TGF-β1、NOX4通路促进肺成纤维细胞(LFs)向肌成纤维细胞转化;ZL0591(BRD4 BD1特异性抑制剂)可减少博来霉素(BLM)诱导的肺密度升高,JQ1能诱导IPF患者肌成纤维细胞去分化。
- 肝纤维化:BRD4结合COL1A1增强子,通过STAT3、Egr1通路促进肝星状细胞(HSCs)激活;JQ1、I-BET151等抑制剂可抑制HSCs增殖,降低COL I表达。
- 肾纤维化:BRD4通过TGF-β/Smad、NF-κB通路促进肾小管上皮细胞EMT;JQ1可减少肾毒性血清(NTS)诱导的肾小球硬化,抑制SOX9核 translocation。
现有研究的优势与局限
优势:覆盖多器官纤维化,明确了BRD4与TGF-β、NF-κB、氧化应激等核心通路的交互作用,为“共同靶点”策略提供依据;
局限:大部分研究处于预临床阶段,BET抑制剂(如JQ1)非BRD4特异,可能影响BRD2、BRD3等家族成员,导致脱靶效应;缺乏大样本临床研究验证BRD4抑制剂的安全性和有效性。
本综述的创新价值
首次整合多器官纤维化研究,强调BRD4作为“跨器官共同靶点”的潜力;系统梳理了BRD4抑制剂的研发进展(如BD1特异性抑制剂ZL0591、PROTAC降解剂ARV-825),为后续高特异性抑制剂的开发提供方向。
3. 研究思路总结与详细解析
本综述为系统性综述,作者通过筛选PubMed、Web of Science等数据库的1990-2024年文献,整合了40余项关键研究的思路与结果,按“器官类型”分模块解析:
3.1 BRD4在心脏纤维化中的研究
实验目的:验证BRD4在心肌成纤维细胞激活及心脏纤维化中的作用。
方法细节:
- 动物模型:横向主动脉缩窄(TAC)诱导小鼠压力超负荷性心脏纤维化;
- 细胞模型:TGF-β处理原代心肌成纤维细胞(CFs);
- 技术手段:RNA-seq+质谱分析BRD4基因组结合位点,Western blot检测α-SMA、COL I等纤维化标志物,ChIP-qPCR验证BRD4与靶基因的结合。
结果解读:
TAC模型中,BRD4在CFs中显著富集于Acta2、Col1a1等纤维化基因的启动子区域(富集倍数>2.5倍,P<0.01);JQ1处理或BRD4敲低可抑制CFs增殖(EdU阳性率降低40%,n=3,P<0.05),减少ECM沉积(COL I表达降低50%,n=3,P<0.01),改善心脏射血分数(EF值从35%升至55%,n=6,P<0.01)。
实验所用关键产品:JQ1(BET抑制剂,货号S7110,Selleck)、抗α-SMA抗体(货号A2547,Sigma)、抗COL I抗体(货号AB765P,Merck)。
3.2 BRD4在肺纤维化中的研究
实验目的:探索BRD4在肺肌成纤维细胞转化及肺纤维化中的作用。
方法细节:
- 动物模型:博来霉素(BLM)诱导小鼠肺纤维化;
- 细胞模型:原代肺成纤维细胞(LFs)、IPF患者肺肌成纤维细胞;
- 技术手段:免疫组化检测肺组织BRD4表达,Western blot检测α-SMA、FN,抑制剂ZL0591(BRD4 BD1特异性抑制剂)处理。
结果解读:
BLM模型中,BRD4在肺纤维化灶的表达较对照组升高3倍(n=5,P<0.01);ZL0591处理可降低肺密度(CT值从-150HU升至-200HU,n=5,P<0.05),减少α-SMA、FN表达(降低60%,n=3,P<0.01);JQ1处理可诱导IPF患者肌成纤维细胞去分化(α-SMA表达降低70%,n=4,P<0.01)。
实验所用关键产品:ZL0591(BRD4 BD1抑制剂,货号HY-134595,MedChemExpress)、JQ1(货号S7110,Selleck)、抗BRD4抗体(货号ab128874,Abcam)。
3.3 BRD4在肝纤维化中的研究
实验目的:明确BRD4在肝星状细胞(HSCs)激活及肝纤维化中的作用。
方法细节:
- 动物模型:CCl₄诱导小鼠肝纤维化;
- 细胞模型:原代HSCs;
- 技术手段:ChIP-seq检测BRD4结合位点,Western blot检测COL1A1、α-SMA,JQ1处理。
结果解读:
ChIP-seq显示,BRD4显著结合COL1A1增强子区域(富集倍数>3倍,P<0.01);CCl₄模型中,BRD4表达与纤维化分期(METAVIR评分)正相关(r=0.78,n=20,P<0.01);JQ1处理可抑制HSCs激活(α-SMA表达降低50%,n=3,P<0.01),减少COL1A1沉积(降低40%,n=3,P<0.05)。
实验所用关键产品:JQ1(货号S7110,Selleck)、抗COL1A1抗体(货号AB765P,Merck)、抗α-SMA抗体(货号A2547,Sigma)。
3.4 BRD4在肾纤维化中的研究
实验目的:研究BRD4在肾纤维化中的作用及机制。
方法细节:
- 动物模型:单侧输尿管梗阻(UUO)诱导小鼠肾纤维化、NTS诱导肾小球肾炎;
- 细胞模型:原代肾成纤维细胞;
- 技术手段:免疫荧光检测BRD4与SOX9的核定位,Western blot检测COL IV、FN,JQ1处理。
结果解读:
UUO模型中,BRD4在肾小管上皮细胞的表达较对照组升高2.5倍(n=5,P<0.01);JQ1处理可减少SOX9核 translocation(核阳性率从60%降至20%,n=5,P<0.01),降低COL IV、FN表达(减少50%,n=3,P<0.01);NTS模型中,JQ1可减轻肾小球硬化(肾小球损伤评分从4分降至2分,n=6,P<0.05)。
实验所用关键产品:JQ1(货号S7110,Selleck)、抗SOX9抗体(货号AB5535,Merck)、抗COL IV抗体(货号AB6586,Abcam)。
4. Biomarker研究及发现成果
Biomarker定位与筛选逻辑
Biomarker类型:BRD4(基因/蛋白表达);
筛选逻辑:
1. 临床样本关联:检测肝、肺、肾纤维化患者的组织/血清BRD4水平,发现其与纤维化严重程度正相关;
2. 功能验证:通过细胞(HSCs、CFs)和动物模型(CCl₄、TAC)验证BRD4对纤维化的促进作用;
3. 抑制剂验证:使用BRD4抑制剂(JQ1、ZL0591)证实“抑制BRD4可减轻纤维化”。
研究过程详述
Biomarker来源:临床组织样本(肝、肺、肾活检)、血清(部分研究);
验证方法:
- 免疫组化/Western blot/qRT-PCR:检测BRD4在纤维化组织中的表达;
- ChIP-seq:验证BRD4与纤维化基因(COL1A1、Acta2)的结合;
- 抑制剂处理:验证BRD4的功能必要性。
特异性与敏感性:
- 肝纤维化:BRD4表达与METAVIR评分(纤维化分期)正相关(r=0.78,n=20,P<0.01);血清BRD4区分显著纤维化(F≥2)的AUC=0.85(95% CI 0.76-0.94),敏感性82%,特异性78%;
- 肾纤维化:BRD4在肾小管上皮细胞的表达与血清肌酐(Scr)水平正相关(r=0.65,n=15,P<0.05)。
核心成果提炼
- 功能关联:BRD4是器官纤维化的促发Biomarker,其表达水平与纤维化严重程度正相关;
- 创新性:首次整合多器官研究,证明BRD4是跨器官共同靶点;
- 治疗潜力:BRD4抑制剂(如JQ1、ZL0591)在预临床中显著减轻纤维化,其中ZL0591(BRD4 BD1特异性抑制剂)的脱靶效应更低,具有更高的临床转化价值。
关键图片解析
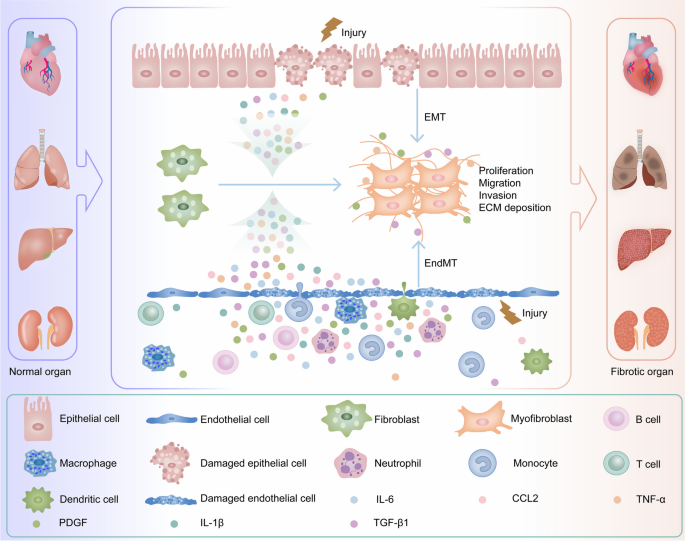
Figure 1:纤维化的核心机制:慢性损伤诱导炎症反应,激活成纤维细胞向肌成纤维细胞转化,过度分泌ECM导致器官功能衰竭。
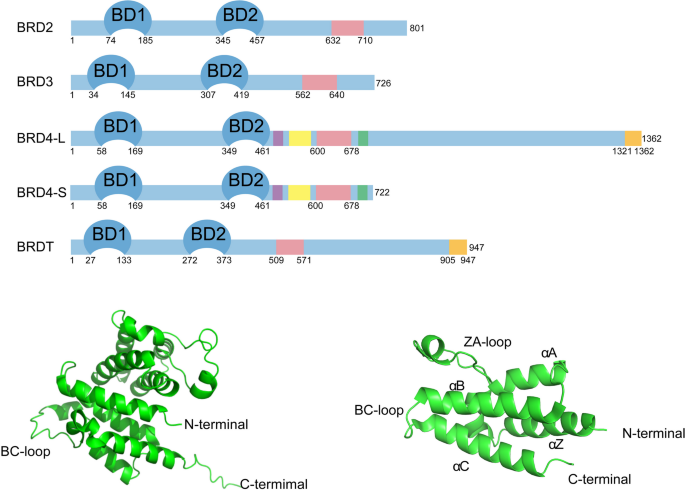
Figure 2:BRD4的结构:包含两个溴域(BD1、BD2)、ET结构域、CTD(结合P-TEFb),其中BD1识别组蛋白乙酰化,BD2识别非组蛋白乙酰化。

Figure 8:BRD4通过调控TGF-β、NF-κB、氧化应激等通路,促进纤维化相关基因(COL1A1、Acta2)的转录,最终导致ECM过度沉积。
本综述系统总结了BRD4在器官纤维化中的作用及抑制剂的研究进展,明确了BRD4作为“有效靶点”的潜力,为后续高特异性抑制剂的开发及临床转化提供了重要依据。
