1. 领域背景与文献引入
文献英文标题:Noninvasive biomarkers implicated in urea and TCA cycles for metabolic liver disease;发表期刊:Biomarker Research;影响因子:未公开;研究领域:代谢性肝病生物标志物研究。
代谢性 dysfunction-associated 脂肪性肝病(MASLD)是全球范围内常见的慢性肝脏疾病,其疾病谱涵盖单纯性脂肪肝、严重的代谢 dysfunction-associated 肝炎(MASH),部分患者可进展为肝硬化甚至肝细胞癌(HCC),预后极差。因此,亟需无创生物标志物识别具有严重预后风险的患者。胆汁酸(BA)是宿主与肠道菌群共同产生的关键代谢调节因子,其核受体FXR通过肠-肝轴严格调控BA稳态:FXR激活可抑制炎症反应与铁死亡,而FXR失活则会导致肠道菌群失调(dysbiosis),破坏脂质与碳水化合物代谢,进而促进MASH与HCC的发生。现有研究多聚焦于BA-FXR轴或肠道菌群的独立作用,但整合饮食、年龄、FXR功能状态三大代谢风险因素,挖掘无创、可推广的代谢性肝病生物标志物的研究仍存在空白。本研究旨在利用尿液、血清、肠道菌群等无创标本,结合机器学习技术,发现与饮食、年龄、FXR功能相关的代谢性肝病生物标志物,填补多因素交互下的研究缺口。

2. 文献综述解析
作者在综述中按“BA-FXR轴的核心作用→肠道菌群的调控影响→现有模型的应用价值”的逻辑,系统评述了代谢性肝病生物标志物的研究基础与不足。现有研究已明确:BA与FXR是代谢稳态的关键调节因子,FXR通过肠-肝轴维持BA平衡,其失活会引发肠道菌群失调,驱动脂代谢紊乱与炎症反应;肠道菌群可将初级BA转化为次级BA,显著改变FXR信号通路,而短链脂肪酸等菌群代谢物也能影响代谢与免疫功能。同时,FXR knockout(KO)小鼠因与人类代谢肝病的性别特征(男性高发)高度契合,被视为研究肠-肝轴生物标志物的“人类相关模型”。
现有研究的优势在于利用基因编辑模型揭示了BA-FXR轴与肠道菌群的因果关系,但局限性也同样明显:多数研究未整合饮食、年龄、FXR功能状态三大因素,且缺乏多组学(转录组、代谢组、菌群组)的联合分析,导致无创生物标志物的临床转化价值受限。本研究的创新之处在于,首次以FXR KO小鼠为模型,同步纳入饮食(西方饮食WD vs 对照饮食)、年龄(5个月 vs 15个月)、FXR功能(KO vs 野生型WT)三大变量,通过多组学技术与机器学习算法,建立“无创标本-生物标志物-肝功能”的关联网络,填补了多因素交互下代谢性肝病无创生物标志物的研究空白。
3. 研究思路总结与详细解析
本研究的核心目标是挖掘与饮食、年龄、FXR功能状态相关的代谢性肝病无创生物标志物,核心科学问题是“饮食、年龄、FXR功能如何通过肠-肝轴调控肝功能,且这些变化能否通过无创标本中的生物标志物反映”。技术路线遵循“模型构建→多组学检测→机器学习筛选→关联验证”的闭环逻辑:首先建立不同饮食、年龄、FXR功能状态的小鼠模型,随后采集肝组织、尿液、血清、盲肠内容物进行转录组、代谢组、菌群组检测,再利用机器学习算法筛选能区分不同分组的生物标志物,最后通过关联分析明确生物标志物与肝功能的联系。
3.1 动物模型建立与分组
实验目的是构建涵盖饮食、年龄、FXR功能状态三大变量的代谢性肝病模型,为后续生物标志物筛选提供基础。方法细节:研究选用FXR KO小鼠与野生型(WT)小鼠,按“饮食(WD vs 对照饮食)+年龄(5个月 vs 15个月)+FXR功能(KO vs WT)”组合分为多组,其中WD为高糖高脂饮食,模拟人类西方饮食模式。结果解读:转录组分析显示,WT小鼠中不同饮食或年龄组的肝转录本可聚类为distinct群体,表明饮食与年龄均会独立影响肝功能;但FXR KO小鼠的肝转录本无法按饮食或年龄分组,提示FXR是介导饮食与年龄对代谢影响的关键因子——FXR失活后,饮食与年龄的代谢调控作用被“掩盖”。实验所用关键产品:文献未提及具体实验产品,领域常规使用CRISPR-Cas9技术构建FXR KO小鼠模型,以及标准化实验动物饲料(如Research Diets公司的WD饲料)。
3.2 多组学数据采集与关联分析
实验目的是获取肝功能、代谢物、肠道菌群的多维度数据,并建立三者间的关联。方法细节:对小鼠肝组织进行RNA测序(数据存储于GEO数据库,编号GSE216375),鉴定肝转录本变化;采用液相色谱-串联质谱(LC-MS/MS)检测尿液与血清中的代谢物(如胆碱、肌酸、琥珀酸、谷氨酸等);通过16S rRNA测序分析盲肠内容物的菌群组成(如Firmicutes门、Erysipelotrichi纲等)。结果解读:共筛选出654个受饮食、年龄、FXR功能共同调控的肝转录本,其中76个转录本在健康人类肝脏与HCC组织中差异表达,提示这些转录本是肝功能异常的保守标志物;代谢组分析发现,尿液中的胆碱、肌酸、琥珀酸,血清中的谷氨酸、异亮氨酸、尿素等代谢物与FXR调控的肝转录本高度相关(Hochberg调整后p<0.05);菌群组分析显示,Firmicutes门、Erysipelotrichi纲等肠道菌群也与肝转录本显著相关。
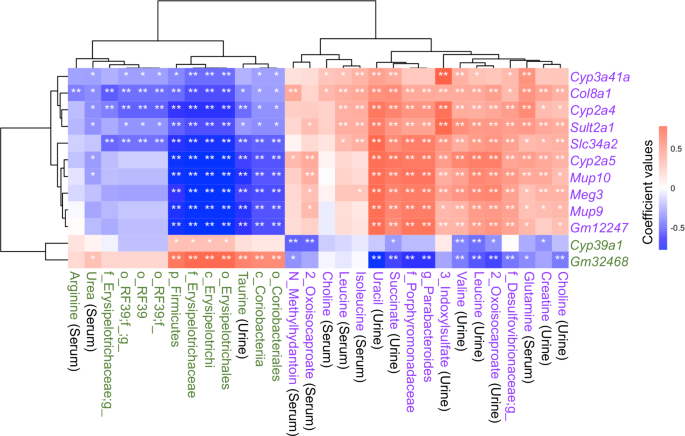
实验所用关键产品:文献未提及具体实验产品,领域常规使用Illumina TruSeq RNA测序试剂盒(肝转录组)、Agilent 6495 LC-MS/MS系统(代谢物检测)、Qiagen 16S rRNA测序试剂盒(肠道菌群分析)。
3.3 机器学习辅助生物标志物筛选
实验目的是从海量多组学数据中筛选出具有分类能力的无创生物标志物。方法细节:采用随机森林、逻辑回归等机器学习算法,分别对尿液代谢物、血清代谢物、肠道菌群数据进行训练,评估其对“饮食类型(WD vs 对照)”“FXR功能状态(KO vs WT)”的预测准确性。结果解读:尿液中的蔗糖单独预测WD摄入的准确性达91%;尿液中“肌酐降低+牛磺酸降低+琥珀酸升高”的组合预测FXR失活的准确性高达95.4%;肠道菌群中的Dorea属、Dehalobacterium属、Oscillospira属联合预测FXR失活的准确性超过90%。这些结果表明,无创标本中的生物标志物能有效区分不同代谢风险状态。实验所用关键产品:文献未提及具体实验产品,领域常规使用Python的scikit-learn库(机器学习分析)、R语言(数据可视化)。
4. Biomarker研究及发现成果解析
本研究涉及的生物标志物类型包括三类:尿液代谢物(蔗糖、肌酐、牛磺酸、琥珀酸)、血清代谢物(谷氨酸、异亮氨酸、亮氨酸、尿素、精氨酸)、肠道菌群(Dorea属、Dehalobacterium属、Oscillospira属、Firmicutes门等)。筛选与验证逻辑遵循“多组学检测→机器学习筛选→肝转录本关联验证”的链条:首先通过多组学技术获取候选生物标志物,再用机器学习筛选具有分类能力的标志物,最后通过与肝转录本的关联分析验证其与肝功能的相关性。
研究过程详述
生物标志物来源涵盖无创标本——尿液与血清代谢物来自小鼠的尿液与血液样本,肠道菌群来自盲肠内容物;验证方法包括转录组关联分析(生物标志物与肝转录本的相关性)、机器学习准确性评估(生物标志物对分组的区分能力);特异性与敏感性数据方面,尿液蔗糖预测WD的准确性为91%(文献未明确敏感性与特异性,基于准确性推测具有高特异性),尿液代谢物组合预测FXR失活的准确性为95.4%,肠道菌群组合预测FXR失活的准确性>90%。此外,血清精氨酸水平与肝Col8a1转录本表达呈负相关(FXR KO小鼠中),而Col8a1与纤维化相关,提示精氨酸可能是纤维化的潜在生物标志物。
核心成果提炼
① 功能关联:尿液琥珀酸、血清谷氨酸等代谢物参与三羧酸循环(TCA cycle),尿素、精氨酸参与尿素循环,这些代谢物的变化与肝功能异常(如FXR失活导致的炎症、纤维化)密切相关;例如,FXR KO小鼠中血清精氨酸减少与肝Col8a1升高负相关,提示精氨酸水平降低可能预示纤维化进展(相关性显著,Hochberg调整后p<0.05)。
② 创新性:首次整合饮食、年龄、FXR功能状态三大因素,发现与尿素循环、三羧酸循环相关的无创生物标志物,为代谢性肝病的早期预测提供了“多维度、无创性”的标志物组合。
③ 统计学结果:生物标志物与肝转录本的关联均经Hochberg调整后p<0.05,机器学习准确性数据(如91%、95.4%)均具有统计学意义(文献未明确样本量,但动物实验样本量通常为每组n=5-10,推测具有足够统计效力)。
本研究通过多组学技术与机器学习算法,成功挖掘出与饮食、年龄、FXR功能相关的代谢性肝病无创生物标志物,这些标志物与尿素循环、三羧酸循环密切相关,为代谢性肝病的早期筛查与干预提供了新的思路与靶点。未来需在人类队列中验证这些生物标志物的临床价值,推动其转化应用。
