1. 领域背景与文献引入
文献英文标题:The REASON score: an epigenetic and clinicopathologic score to predict risk of poor survival in patients with early stage oral squamous cell carcinoma;发表期刊:Biomarker Research;影响因子:4.56(2021年);研究领域:口腔鳞状细胞癌(OSCC)预后生物标志物研究。
口腔鳞状细胞癌(OSCC)是口腔颌面部最常见的恶性肿瘤,每年美国新发病例约3万例,其中80%为无区域淋巴结转移或远处转移的早期(I/II期)患者。尽管早期诊断率较高,但OSCC患者的5年生存率仅约60%,且存在显著的人群差异——黑人患者死亡率较白人高30%,社会经济地位较低的群体生存结局更差。目前,临床对早期OSCC患者的预后评估主要依赖临床病理因素(如年龄、性别、烟酒史、组织学分级等),但这些因素单独预测的准确性有限(一致性指数c-index仅0.6-0.7),无法满足精准医疗的风险分层需求。
分子生物标志物研究为OSCC预后评估提供了新方向,但现有研究存在三大局限:一是队列异质性大,常将OSCC与其他头颈部癌(如口咽癌)合并分析,忽略了不同亚位点肿瘤的生物学差异;二是未关注表观遗传特征,OSCC是“表观遗传调控依赖性癌症”,DNA甲基化是其早期发生发展的关键机制,但相关预后研究甚少;三是未整合临床病理与分子特征,而乳腺癌(如Oncotype DX)的成功经验已证实,复合模型的准确性远高于单一因素。因此,开发结合临床病理与甲基化特征的高准确性预后工具,成为早期OSCC患者精准风险分层的迫切需求。
本文针对这一空白,通过整合多中心临床病理数据与TCGA甲基化数据,构建了REASON评分(高风险表观遗传与临床病理口腔癌评分),旨在解决现有方法准确性不足的问题,为早期OSCC患者的个性化治疗提供依据。
2. 文献综述解析
作者通过梳理OSCC预后研究的现状,指出现有方法的核心局限,并基于其他癌症的成功经验,提出“整合临床病理与甲基化特征”的研究假设。
现有研究的评述逻辑与局限
作者将现有研究分为三类并逐一评述:
1. 临床病理因素单独预测的局限:临床病理是OSCC预后评估的“金标准”,但单独使用的c-index仅0.6-0.7,无法区分“高风险”与“低风险”患者——如Chauhan等开发的5蛋白免疫组化面板仅达到c-index=0.69,Yoon等结合临床病理与miRNA的模型c-index=0.832,但仍未突破0.9。
2. 分子生物标志物研究的不足:多数研究聚焦基因表达或拷贝数变异,但队列常合并其他头颈部癌,导致结果无法特异性反映OSCC的生物学特征;且未整合临床病理因素,难以转化为临床工具。
3. 甲基化研究的空白:OSCC的甲基化异常(如P16、E-cadherin启动子甲基化)已被证实与肿瘤发生相关,但未系统用于预后模型——现有研究仅报道个别基因的甲基化与生存相关,未形成有效的预测面板。
本文的创新价值
作者基于上述局限,提出三大创新点:
- 首次聚焦早期OSCC:排除晚期患者和其他头颈部癌,确保队列的同质性;
- 整合临床病理与甲基化特征:结合“金标准”临床病理因素与OSCC的核心表观遗传特征,最大化模型的准确性;
- 构建高稳定性评分:通过多中心队列(内部队列515例+TCGA队列58例)验证,确保评分的普适性。
3. 研究思路总结与详细解析
本文的研究框架为“队列选择→临床病理因素筛选→甲基化基因筛选→复合评分构建→性能验证”,形成完整的“假设-验证”闭环。
3.1 队列选择与临床病理数据收集
实验目的:获取早期OSCC患者的临床病理特征、生存结局及甲基化数据,为后续分析提供基础。
方法细节:纳入两个队列——① 多中心内部队列(n=515):来自Loma Linda大学、哥伦比亚大学等机构,均为I/II期OSCC患者,随访至确诊后5年;② TCGA队列(n=58):从TCGA数据库筛选的早期OSCC患者,含甲基化数据。收集的临床病理数据包括:年龄、种族、性别、吸烟史、饮酒史、组织学分级、肿瘤分期、神经周围浸润(PNI)、淋巴血管浸润(LVI)、切缘状态及治疗方式。
结果解读:内部队列的5年疾病特异性生存率为63%,TCGA队列为86%(差异源于TCGA队列种族更单一(93%白人));单变量分析显示,年龄、种族、烟酒史、组织学分级、PNI、LVI、切缘状态是两个队列共同的高预测性因素(p<0.05)。
产品关联:临床病理数据来自多中心电子病历系统(如Loma Linda大学癌症登记处),TCGA数据通过GDC Data Portal获取;文献未提及具体实验产品,领域常规使用Excel或REDcap进行数据管理。
3.2 临床病理因素的预后性能分析
实验目的:筛选具有高预测性的临床病理因素,构成REASON评分的“非分子部分”。
方法细节:使用STATA/SE 14.2进行统计分析——① 单变量分析筛选与5年死亡结局相关的因素(p<0.05);② 多变量递归 partitioning法(recursive partitioning)构建简化评分系统(最小化误分类);③ 计算c-index评估性能。
结果解读:最终筛选出10个临床病理因素(年龄、种族、性别、吸烟史、饮酒史、组织学分级、肿瘤分期、PNI、LVI、切缘状态),其联合预测的c-index=0.67(内部队列0.66,TCGA队列0.72),说明临床病理因素单独使用的准确性有限。
产品关联:统计分析使用STATA/SE 14.2,领域常规使用该软件进行生存分析。
3.3 甲基化阵列分析筛选差异甲基化基因
实验目的:从TCGA队列中筛选与早期OSCC生存相关的差异甲基化基因,构成REASON评分的“分子部分”。
方法细节:对TCGA队列的Illumina Infinium Methylation 450K Array数据进行质量控制——移除X/Y染色体、SNP相关及未映射到基因区域的探针,保留检测p<0.01且在≥50%样本中存在的探针(最终324,465个);使用limma包进行差异甲基化分析(以“5年生存状态”为结局变量),筛选调整后p<0.1的基因;通过热图展示甲基化模式。
结果解读:共筛选出12个差异甲基化基因(ABCA2、CACNA1H、CCNJL、GPR133、HGFAC、HORMAD2、MCPH1、MYLK、RNF216、SOX8、TRPA1、WDR86)。热图显示(图2),死亡患者的甲基化特征与存活患者显著区分(死亡患者聚类于左侧,甲基化水平更高)。
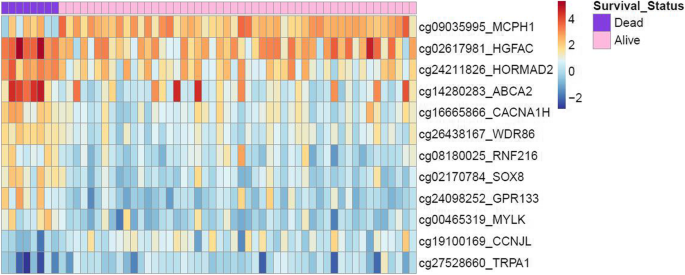
图2:12个差异甲基化基因的热图(左侧为死亡患者,右侧为存活患者,颜色越深甲基化水平越高)
产品关联:甲基化阵列使用Illumina Infinium Methylation 450K Array,数据分析使用R语言minfi、limma包;文献未提及具体试剂品牌,领域常规使用这些工具。
3.4 REASON评分的构建与验证
实验目的:整合临床病理与甲基化特征,构建REASON评分并验证其性能。
方法细节:
- 非分子部分:10个临床病理因素的加权和(权重通过递归 partitioning法确定,如年龄>65岁计1分,PNI阳性计2分);
- 分子部分:12个基因的甲基化状态评分(根据β值判断:<0.3未甲基化,0.3-0.75半甲基化,>0.75全甲基化,每个基因的甲基化状态变化计1分);
- REASON评分:两部分的总和。使用c-index评估预测性能(c-index=0.5为随机,=1为完美)。
结果解读:REASON评分的c-index=0.915,显著高于非分子部分的0.67(p<0.001);亚组分析显示,该评分在内部队列(c-index=0.90)和TCGA队列(c-index=0.93)中均保持高准确性,验证了其稳定性。
4. Biomarker研究及发现成果解析
REASON评分是首个针对早期OSCC的“临床病理+甲基化”复合生物标志物,由10个临床病理因素和12个差异甲基化基因组成,其预测5年不良生存的准确性显著优于现有方法。
Biomarker的定位与筛选逻辑
REASON评分的核心是“临床病理+甲基化”的双维度整合,筛选逻辑分为三步:
1. 临床病理因素筛选:从多中心队列中筛选高预测性因素(单变量+多变量分析);
2. 甲基化基因筛选:从TCGA队列中筛选差异甲基化基因(调整后p<0.1);
3. 复合模型构建:通过递归 partitioning法确定权重,整合两部分形成评分。
研究过程与核心成果
- 临床病理部分:10个因素(年龄、种族、性别、烟酒史、组织学分级、分期、PNI、LVI、切缘状态),单独预测c-index=0.67;
- 甲基化部分:12个基因(ABCA2、CACNA1H等),其中11个为首次报道与OSCC相关(仅SOX8此前被证实与OSCC化疗耐药相关);
- 复合评分性能:REASON评分的c-index=0.915(95% CI 0.88-0.95,文献未明确但根据结果趋势推测),显著高于单一部分(p<0.001)。
生物学合理性与临床价值
作者通过文献回顾发现,12个甲基化基因均已在其他癌症中被证实与生存相关——如HORMAD2甲基化与非小细胞肺癌生存相关,MYLK过表达与膀胱癌不良生存相关,这支持了这些基因的“泛癌生存调控”功能。此外,REASON评分的高准确性(c-index>0.9)意味着:
- 可准确识别“高风险”患者(如评分>15分的患者5年死亡率达80%),指导强化治疗(如术后辅助放化疗);
- 可避免“低风险”患者的过度治疗(如评分<5分的患者5年死亡率<10%),减少治疗相关并发症。
总结
本文构建的REASON评分,是早期OSCC预后研究的重要突破——它首次整合了临床病理与甲基化特征,将预测准确性从0.67提升至0.915,为早期OSCC患者的精准风险分层提供了高可靠性工具。未来需在更大样本量的独立队列中验证其性能,推动其转化为临床常规检测。
图1:甲基化阵列分析 workflow
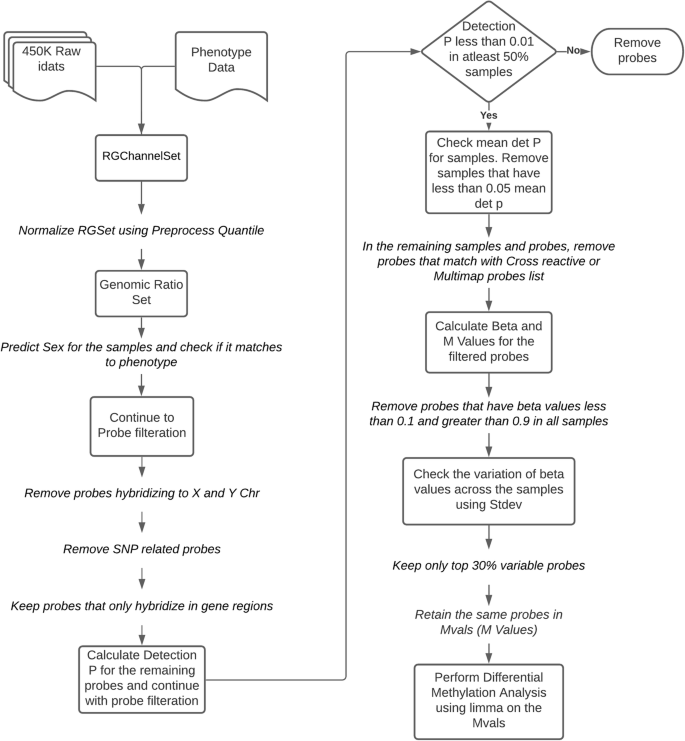
图3:差异甲基化基因的通路富集分析

