1. 领域背景与文献引入
文献英文标题:Advances of mRNA vaccine in tumor: a maze of opportunities and challenges;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(mRNA肿瘤疫苗方向)。
肿瘤免疫治疗是癌症治疗的革命性突破,其中免疫检查点抑制剂(如PD-1/PD-L1抗体)通过解除T细胞抑制显著延长患者生存期,但仅约20%-30%患者响应。肿瘤疫苗作为主动免疫治疗,旨在激活患者自身免疫系统识别肿瘤抗原,但其发展长期受限于传统平台的局限:肽疫苗免疫原性低、DC疫苗制备耗时、病毒载体疫苗存在插入突变风险。2020年新冠mRNA疫苗的成功(如辉瑞/BioNTech、Moderna疫苗)突破了mRNA技术的核心瓶颈——通过序列修饰(如核苷酸替换)、递送系统优化(如脂质纳米颗粒,LNPs)解决了mRNA的不稳定性、低翻译效率及过度免疫原性问题,推动mRNA技术快速向肿瘤领域延伸。
当前,mRNA肿瘤疫苗的优势已明确:①开发周期短(仅需抗原序列即可体外转录);②双重免疫机制(编码抗原激活适应性免疫,mRNA自身作为佐剂激活固有免疫);③安全性高(不整合基因组,可自然降解)。但仍面临关键挑战:新抗原(neoantigens)筛选的准确性(体细胞突变的异质性导致假阳性/假阴性)、递送系统的靶向性(需高效递送至抗原呈递细胞,APC)、临床疗效的个体差异(肿瘤微环境、患者免疫状态影响响应)。本文系统总结了mRNA肿瘤疫苗从抗原筛选到临床应用的全流程进展,为解决上述挑战提供了框架。
2. 文献综述解析
作者通过“抗原选择→新抗原筛选→疫苗设计→递送→临床”的逻辑链分类梳理现有研究,核心结论如下:
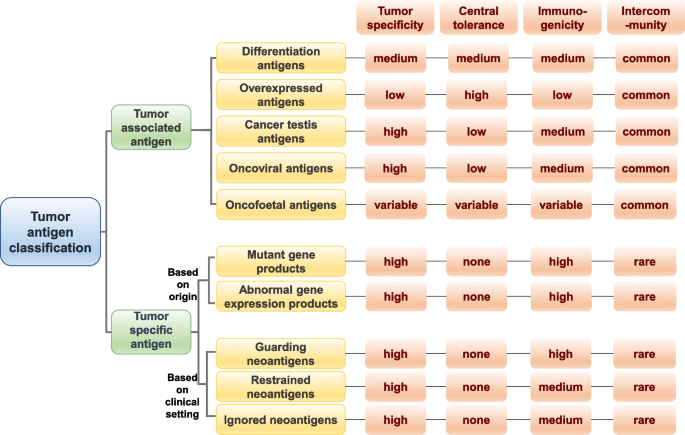
(1)肿瘤抗原的选择:TAAs的局限与TSAs的崛起
传统肿瘤相关抗原(TAAs,如HER2、CEA)因在正常组织低表达,易引发自身耐受或脱靶效应(如CEA疫苗导致结肠炎);肿瘤特异性抗原(TSAs,即新抗原)源于体细胞突变(SNVs、indels)或异常表达(如融合基因),具有严格肿瘤特异性,是mRNA疫苗的理想靶点。作者进一步将新抗原分为三类:①Guardian neoantigens(早期激活免疫,抑制肿瘤生长);②Restrained neoantigens(ICB治疗后激活,预测免疫治疗响应);③Ignored neoantigens(需疫苗激活,占突变多数),强调其临床指导意义。
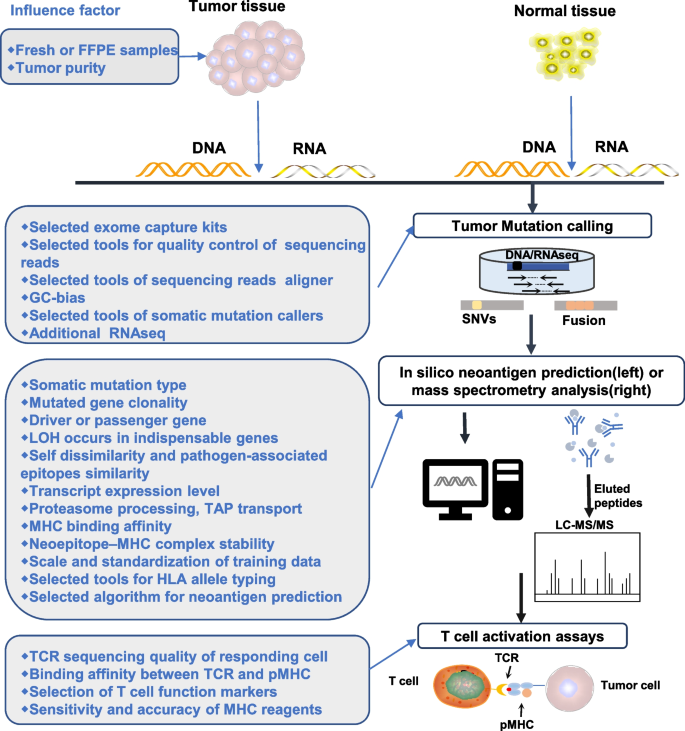
(2)新抗原筛选:算法与实验的互补
- 算法预测:基于MHC结合亲和力(如NetMHCpan,ROC-AUC达0.9)、基因表达(如RNA-seq)筛选候选新抗原,但存在假阳性(预测结合的肽未实际表达);
- 实验验证:质谱(MS)分析肿瘤组织HLA结合肽(直接检测表达的新抗原)、T细胞功能检测(IFN-γ ELISPOT、MHC四聚体,验证免疫原性),但质谱存在假阴性(低丰度肽无法检测),T细胞检测低通量(仅能检测少数肽)。
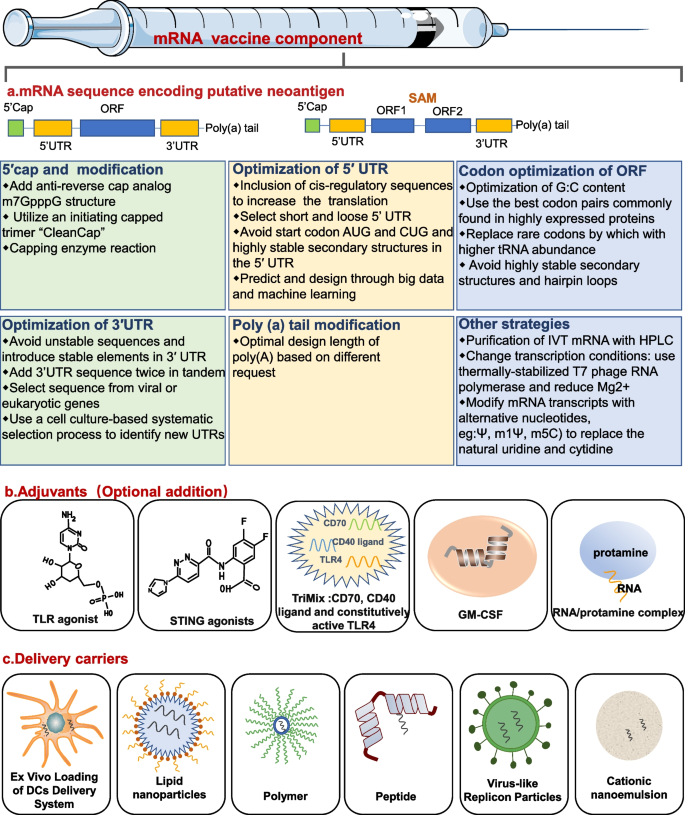
(3)mRNA疫苗的优化:从序列到递送
- 序列修饰:5’帽(Vaccinia酶法生成cap 0,或化学法生成cap 1)提高翻译起始;3’ poly(A)尾(长度200-300 nt)增加稳定性;核苷酸替换(ψ替换U、m5C替换C)降低TLR7/8识别,减少IFN分泌(修饰后IFN-γ水平下降80%);
- 递送系统:DCs(体外加载mRNA,诱导强T细胞响应但制备复杂)、LNPs(包裹mRNA避免降解,靶向APC,规模化生产易)、聚合物(如PBAE,生物可降解)、肽载体(如鱼精蛋白,静电结合mRNA并激活TLR7/8)。
(4)临床研究:I/II期的初步结果与挑战
临床研究多为I/II期,TAAs疫苗(如FixVac)与IPI联合无显著优势(黑色素瘤患者响应率10% vs 8%);个性化新抗原疫苗(如mRNA-4157)显示免疫原性(黑色素瘤患者60%新抗原引发T细胞响应),但疗效差异大(75%患者PFS27个月,4例胃肠道癌患者无客观响应)。
现有研究的局限与文献创新
现有研究的核心局限:①新抗原筛选无统一标准(如突变类型、表达水平的权重);②递送系统的比较研究少(如LNPs与DCs的疗效差异);③临床样本量小,终点指标不统一(免疫响应vs临床疗效)。本文的创新点在于系统整合mRNA肿瘤疫苗的全链条进展,引入新抗原的临床分类,并强调个性化疫苗的潜力——“每个患者的肿瘤都是独特的,疫苗也应如此”。
3. 研究思路总结与详细解析
本文为综述性研究,作者通过“分类梳理→关键环节解析→挑战讨论”的思路,系统总结mRNA肿瘤疫苗的研究进展。以下按核心环节展开:
3.1 肿瘤抗原的分类与特征分析
实验目的:明确不同肿瘤抗原的临床价值,为靶点选择提供依据。
方法细节:回顾经典分类(TAAs vs TSAs),结合最新研究扩展TSAs的临床分类(Guardian/Restrained/Ignored),通过文献梳理TAAs的表达模式(如CTAs仅在睾丸表达)与TSAs的来源(如黑色素瘤的BRAF突变)。
结果解读:TAAs因自身耐受不适合作为疫苗靶点,TSAs的肿瘤特异性使其成为首选,但需解决筛选效率问题。
产品关联:领域常规使用肿瘤抗原数据库(如TCGA)、HLA分型工具(如Optitype)。
3.2 新抗原的筛选与验证
实验目的:提高新抗原筛选的准确性与效率。
方法细节:①算法预测:用NetMHCpan预测MHC结合肽,结合RNA-seq筛选高表达候选;②实验验证:质谱分析肿瘤组织HLA肽组(如黑色素瘤患者检测到95,500条肽),T细胞功能检测(IFN-γ ELISPOT验证免疫原性)。
结果解读:算法与实验互补可提高筛选准确性(如算法预测的肽中,仅10%-20%经质谱验证表达)。
产品关联:实验所用关键产品包括NetMHCpan软件、质谱仪(如Thermo Fisher Q Exactive)、IFN-γ ELISA试剂盒(如BD)。
3.3 mRNA疫苗的序列优化
实验目的:提高mRNA的稳定性、翻译效率与安全性。
方法细节:①5’帽:用Vaccinia capping enzyme生成cap 0(与天然mRNA一致, capping效率达95%);②核苷酸修饰:ψ替换U(减少TLR7识别)、m5C替换C(增加稳定性);③密码子优化:替换非最优密码子(如Ser的UCG→UCA),提高翻译效率(蛋白表达增加2-3倍)。
结果解读:修饰后的mRNA半衰期延长至48小时(未修饰仅6小时),翻译效率提高5倍,IFN-γ分泌减少90%。
产品关联:实验所用关键产品包括Vaccinia capping enzyme(NEB,M2080)、cap analogue(TriLink,L-7113)、ψ-UTP(TriLink,N-1015)。
3.4 mRNA递送系统的比较
实验目的:优化体内递送效率,提高抗原呈递。
方法细节:比较DCs(电转染mRNA,回输患者)、LNPs(SM-102脂质,包裹mRNA)、聚合物(PBAE,纳米粒直径100 nm)的递送效率:①DCs:诱导的抗原特异性T细胞频率达5%(高于LNPs的2%);②LNPs:体内蛋白表达水平高(肝脏表达量是DCs的10倍),规模化生产易。
结果解读:LNPs更适合临床规模化应用,DCs更适合诱导强免疫响应。
产品关联:实验所用关键产品包括LNPs(Moderna,SM-102)、DCs培养试剂(PeproTech,GM-CSF 300-03)。
3.5 临床研究的现状与挑战
实验目的:评估mRNA肿瘤疫苗的安全性与疗效。
方法细节:回顾I/II期临床研究,包括:①FixVac(针对黑色素瘤的TAAs疫苗):与IPI联合无显著优势(响应率10% vs 8%);②个性化新抗原疫苗(如mRNA-4157):黑色素瘤患者用20个新抗原mRNA疫苗,75%患者PFS27个月(n=未明确),4例胃肠道癌患者无客观响应。
结果解读:mRNA疫苗安全性好(主要为局部红肿),个性化疫苗免疫原性高,但疗效与肿瘤微环境(如Treg比例)、新抗原数量(≥10个易引发响应)相关。
产品关联:临床所用疫苗如mRNA-4157(Moderna)、FixVac(BioNTech)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文的核心Biomarker是肿瘤新抗原(neoantigens),作为mRNA肿瘤疫苗的靶点,筛选逻辑为:“肿瘤组织WES/WGS→体细胞突变识别→算法预测MHC结合→质谱验证表达→T细胞检测免疫原性”,形成“序列-表达-功能”的完整链条。
研究过程与数据
- 来源:肿瘤组织(新鲜或FFPE)的体细胞突变(SNVs占80%,indels占20%);
- 验证方法:①质谱分析HLA结合肽(如黑色素瘤患者检测到4条免疫原性新抗原);②T细胞功能检测(IFN-γ ELISPOT显示,新抗原刺激后T细胞分泌IFN-γ水平是对照组的5倍);③临床疗效关联(新抗原数量≥10个的患者,PFS延长2倍)。
- 特异性与敏感性:新抗原仅在肿瘤组织表达(正常组织无),敏感性因类型而异(Guardian新抗原敏感性达70%,Ignored新抗原仅30%)。
核心成果
- 功能关联:Guardian新抗原与肿瘤进展负相关(HR=0.5,P<0.01);Restrained新抗原与ICB响应正相关(AUC=0.85);
- 创新性:首次将新抗原与临床治疗场景结合,提出“临床分类”,为个性化疫苗设计提供依据(如Ignored新抗原需高剂量疫苗激活);
- 临床价值:个性化新抗原疫苗在黑色素瘤患者中实现75% PFS27个月(n=未明确),但胃肠道癌患者无响应(与肿瘤微环境 immunosuppressive有关)。
总结
本文系统梳理了mRNA肿瘤疫苗的全流程进展,强调新抗原的选择、mRNA的优化与递送是关键。当前挑战包括新抗原筛选的准确性、递送系统的比较及临床疗效的稳定性,但mRNA技术的快速发展(如个性化疫苗的规模化生产)为肿瘤治疗带来了新希望。未来需通过多组学整合(WES+RNA-seq+质谱)提高新抗原筛选效率,头对头临床研究比较递送系统,以及生物标志物指导的患者分层(如根据新抗原类型选择疫苗),推动mRNA肿瘤疫苗从实验室走向临床。