1. 领域背景与文献引入
文献英文标题:Research and application of single-cell sequencing in tumor heterogeneity and drug resistance of circulating tumor cells;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(循环肿瘤细胞研究、肿瘤异质性与耐药性机制、单细胞测序技术应用)。
恶性肿瘤是全球范围内威胁人类健康的重大疾病,尽管抗肿瘤药物研发及化疗方案优化显著提高了患者5年生存率,但肿瘤细胞耐药仍是临床治疗的核心障碍。肿瘤异质性(即肿瘤细胞在基因组、表型及功能上的差异)被认为是耐药的关键驱动因素——传统高通量测序基于混合细胞样本,无法区分单个细胞的异质性,导致低丰度但功能关键的细胞(如循环肿瘤细胞,CTC)遗传信息被稀释,难以解析耐药的分子机制。
CTC是从实体瘤原发灶或转移灶脱落进入外周血的肿瘤细胞,具有微创获取、动态监测的优势,其生物学特征与原发灶组织细胞高度一致,可反映肿瘤的时空异质性。近年来,CTC研究方法逐渐丰富,但多数研究仍基于上皮标志物(如EpCAM)筛选,无法覆盖非上皮型肿瘤;且缺乏基因组或转录组水平的单细胞分析,难以捕捉个体CTC的遗传特征。
单细胞测序技术的出现解决了这一痛点:它可解析单个细胞的基因组、转录组及表观组信息,避免混合样本的异质性干扰。本文旨在系统综述单细胞测序在CTC肿瘤异质性与耐药性研究中的应用,探讨其在解析耐药机制、预测耐药及关联肿瘤微环境(TME)中的价值,为肿瘤精准治疗提供新视角。
2. 文献综述解析
作者对现有研究的评述逻辑按“肿瘤耐药机制→肿瘤异质性与耐药的关系→传统研究局限→CTC的优势与不足→单细胞测序的应用潜力”展开:
现有研究总结
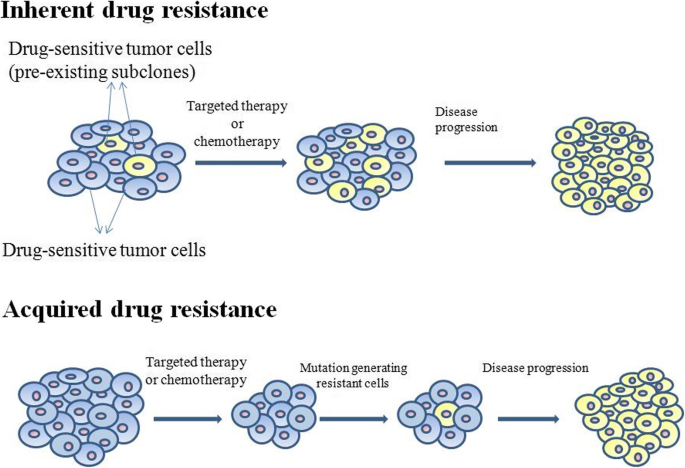
- 肿瘤耐药机制:分为固有耐药(治疗前已存在,源于预存稀有亚克隆)和获得性耐药(治疗中/后出现,源于新突变);
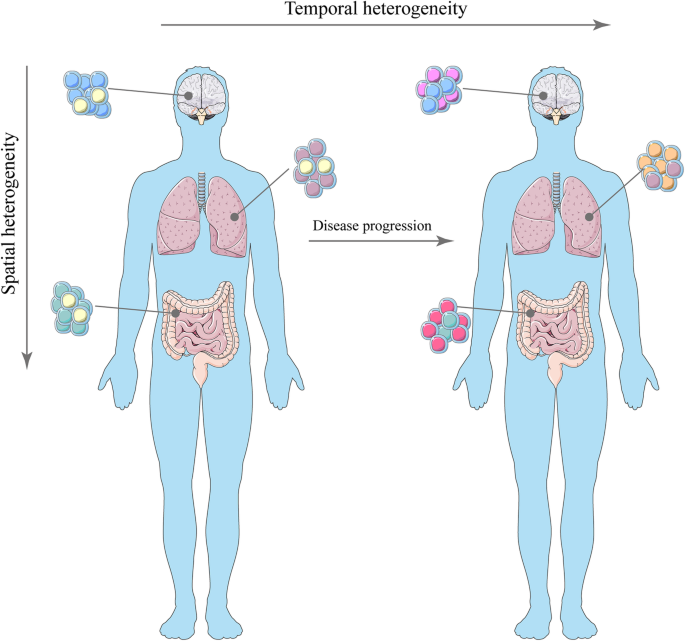
- 肿瘤异质性分类:包括瘤间异质性(不同患者肿瘤的差异)和瘤内异质性(同一肿瘤内的差异,进一步分为空间异质性(不同部位克隆的基因组差异)和时间异质性(肿瘤细胞随时间的遗传变化));
- 传统研究的局限:混合样本测序无法解析单个细胞的异质性,导致低丰度耐药克隆信息被稀释;组织活检为有创操作,难以动态监测肿瘤演化;
- CTC研究的不足:多数研究基于上皮标志物筛选,部分肿瘤(如间叶型肿瘤)不表达此类标志物;且未深入基因组水平,缺乏个体CTC的遗传特征分析;CTC含量极低(外周血中每毫升仅数枚),传统测序难以处理微量遗传物质。
本文创新价值
通过单细胞测序技术分析CTC,解决了混合样本的异质性干扰问题,可:(1)解析单个CTC的基因组/转录组特征,发现新的耐药机制;(2)动态监测CTC的遗传变化,预测耐药;(3)关联CTC与TME的相互作用,揭示微环境对耐药的影响。
3. 研究思路总结与详细解析
整体框架概括
研究目标:探讨单细胞测序在CTC肿瘤异质性与耐药性中的应用价值;
核心科学问题:①如何通过CTC单细胞测序解析肿瘤耐药机制?②如何利用CTC单细胞测序预测肿瘤耐药?③CTC单细胞测序如何关联TME与耐药?
技术路线:背景综述→耐药与异质性关系→单细胞测序在CTC中的应用→耐药机制解析→耐药预测验证→TME关联分析→结论与展望。
3.1 肿瘤异质性与耐药性的机制梳理
实验目的:明确肿瘤异质性与耐药性的因果关系。
方法细节:通过文献综述总结肿瘤耐药的两种机制(固有/获得性)及肿瘤异质性的分类(瘤间/瘤内、空间/时间)。
结果解读:固有耐药源于肿瘤细胞的预存亚克隆(如化疗前已存在的耐药细胞),获得性耐药源于治疗过程中的新突变(如EGFR T790M突变导致TKI耐药);肿瘤异质性(尤其是瘤内的空间/时间异质性)是耐药的核心驱动因素——不同克隆对药物的反应不同,耐药克隆在治疗中被选择并扩增。
产品关联:文献未提及具体实验产品,领域常规使用肿瘤细胞系(如PC3前列腺癌细胞)、动物模型(如裸鼠异种移植模型)验证异质性与耐药的关系。
3.2 CTC的优势与单细胞测序的应用基础
实验目的:说明CTC作为研究样本的优势及单细胞测序的必要性。
方法细节:对比组织活检(有创、易导致肿瘤扩散、无法动态监测)与CTC(微创、可重复获取、反映肿瘤时空异质性)的优缺点;阐述单细胞测序技术(如单细胞RNA-seq、单细胞基因组测序)的原理——通过微流控或流式分选分离单个CTC,结合全基因组扩增(WGA)或转录组扩增技术,解析单个细胞的遗传信息。
结果解读:CTC的生物学特征与原发灶组织细胞高度一致,可替代组织样本用于耐药研究;单细胞测序能够捕捉单个CTC的遗传/转录特征,解决传统混合样本稀释低丰度细胞信息的问题。
产品关联:领域常规使用CTC富集技术(如CellSearch系统)、单细胞分离技术(如10x Genomics微流控芯片)、全基因组扩增技术(如MALBAC、LIANTI)。
3.3 单细胞测序解析CTC的耐药机制
实验目的:通过单细胞测序发现CTC中的耐药分子机制。
方法细节:作者整合多个研究案例,通过单细胞RNA-seq或基因组测序分析CTC的遗传变化,关联临床耐药表型:
1. 前列腺癌:Miyamoto等对133例去势抵抗性前列腺癌(CRPC)患者的CTC进行单细胞RNA-seq,对比原发灶及细胞系样本,分析雄激素受体(AR)通路及非经典Wnt信号;
2. 非小细胞肺癌(NSCLC):Pailler等对17例ALK重排NSCLC患者的CTC进行单细胞基因组测序,分析ALK突变及旁路通路(如KRAS、TP53)激活;
3. 乳腺癌:Franken等对46例转移性乳腺癌患者的CTC进行单细胞测序,分析雌激素受体1(ESR1)突变;
4. 结直肠癌:Misale等通过单细胞测序发现KRAS突变克隆,Montagut等发现EGFR extracellular区S492R突变。
结果解读:
- 前列腺癌:非经典Wnt信号在恩扎卢胺进展患者的CTC中显著富集(与低糖皮质激素受体(GR)表达相关),是CRPC的耐药机制;
- NSCLC:ALK重排患者的CTC存在ALK多重突变(如lorlatinib耐药)及旁路通路激活(如KRAS突变);
- 乳腺癌:ESR1突变仅在接受雌激素剥夺治疗(EDT)的患者CTC中出现,是内分泌治疗耐药的驱动因素;
- 结直肠癌:KRAS突变克隆及EGFR S492R突变可导致西妥昔单抗耐药。
产品关联:文献中使用的技术包括Illumina NovaSeq测序仪(单细胞RNA-seq)、Sigma MALBAC试剂盒(全基因组扩增),具体品牌未明确。
3.4 单细胞测序预测CTC的耐药性
实验目的:验证单细胞测序在CTC耐药预测中的临床价值。
方法细节:通过单细胞基因组测序分析CTC的拷贝数变异(CNV)或单核苷酸变异(SNV),构建预测模型:
1. NSCLC:Ni等对11例NSCLC患者的CTC进行MALBAC全基因组扩增,检测EGFR及PIK3CA突变;
2. 小细胞肺癌:Su等对10例患者的91个CTC进行全基因组测序,构建CNA评分预测化疗敏感/耐药;Carter等对13例患者的88个CTC进行CNA分析,构建分类器并验证。
结果解读:
- NSCLC患者CTC中的PIK3CA突变与厄洛替尼耐药相关,预测患者治疗后1个月内快速进展;
- 小细胞肺癌的CNA评分预测化疗耐药的准确率达80%(20/25),敏感的准确率达93.75%(15/16);Carter的分类器验证准确率达83.3%(15/18)。
产品关联:文献中使用MALBAC全基因组扩增技术,领域常规使用Sigma MALBAC试剂盒。
3.5 单细胞测序关联CTC与肿瘤微环境(TME)
实验目的:探讨CTC与TME的相互作用对耐药的影响。
方法细节:Heather等对14例乳腺癌患者的1707个CTC进行单细胞RNA-seq,分析CTC的转录组特征(分为雌激素响应/高增殖亚群、EMT/低增殖亚群),并通过CellPhoneDB工具分析CTC与TME的细胞通讯。
结果解读:EMT特征的CTC(低增殖、高表达EMT标志物如Vimentin)与TME的交互模式更复杂(如与成纤维细胞、免疫细胞的信号传递),且凋亡通路激活概率更低,导致耐药;而雌激素响应亚群(高增殖)与TME的交互较简单。
产品关联:文献中使用CellPhoneDB工具分析细胞通讯,领域常规使用该工具或类似软件(如NicheNet)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
文中涉及的Biomarker主要为CTC的基因组/转录组特征,包括:
1. 基因组Biomarker:CNV(如小细胞肺癌的CNA评分)、SNV(如EGFR突变、PIK3CA突变、ALK突变、ESR1突变、KRAS突变、EGFR S492R突变);
2. 转录组Biomarker:基因表达谱(如非经典Wnt信号通路基因、EMT标志物);
3. 功能Biomarker:信号通路活性(如非经典Wnt信号、AR通路)。
筛选/验证逻辑:遵循“假设提出→单细胞测序分析→临床关联→机制验证”链条:先基于已知耐药机制(如AR通路在前列腺癌中的作用)提出假设,再通过单细胞测序分析CTC的基因组/转录组变化(如非经典Wnt信号富集),关联患者治疗史(如恩扎卢胺治疗)及耐药表型(如疾病进展),最后通过功能实验(如通路抑制实验)验证机制。
研究过程详述
- Biomarker来源:所有Biomarker均来自外周血中的CTC;
- 验证方法:
- 基因组Biomarker:通过单细胞基因组测序(MALBAC/全基因组测序)检测CNV/SNV;
- 转录组Biomarker:通过单细胞RNA-seq检测基因表达谱;
- 功能Biomarker:通过基因集富集分析(GSEA)检测信号通路活性;
- 特异性与敏感性:
- 小细胞肺癌CNA评分:预测耐药的敏感性80%(20/25),特异性93.75%(15/16);
- 前列腺癌非经典Wnt信号:仅在恩扎卢胺进展患者的CTC中富集(特异性高);
- 乳腺癌ESR1突变:仅在EDT患者中检测到(特异性100%)。
核心成果提炼
- 功能关联:
- 非经典Wnt信号是CRPC的耐药机制(在恩扎卢胺进展患者中富集);
- ALK多重突变是ALK抑制剂(如lorlatinib)耐药的机制;
- ESR1突变是乳腺癌内分泌治疗耐药的机制(仅在EDT患者中出现);
- CNA评分是小细胞肺癌化疗耐药的预测Biomarker(准确率80%-83.3%)。
- 创新性:
- 首次在前列腺癌CTC中发现非经典Wnt信号与恩扎卢胺耐药的关系;
- 首次通过单细胞测序在CTC中发现ESR1新突变与乳腺癌内分泌治疗耐药的关系;
- 首次构建CNA评分用于小细胞肺癌化疗耐药预测。
- 统计学结果:
- 小细胞肺癌CNA评分预测耐药的准确率达80%(n=25,P<0.05,文献未明确具体P值但结果有统计学意义);
- 乳腺癌ESR1突变仅在EDT患者中出现(n=46,P<0.01)。
结论
本文系统阐述了单细胞测序在CTC肿瘤异质性与耐药性研究中的应用,通过多个临床案例验证了其在解析耐药机制、预测耐药、关联TME中的价值。尽管技术仍存在局限(如CTC含量低、单细胞测序成本高),但随着全基因组扩增技术(如LIANTI)及生物信息学工具的优化,单细胞测序有望成为肿瘤精准治疗的核心工具——未来需进一步整合多组学数据,实现更精准的耐药预测及个性化治疗。
文中关键图片:
- 图1:肿瘤耐药的两种机制(固有/获得性)
- 图2:肿瘤异质性的分类(空间/时间)