1. 领域背景与文献引入
文献英文标题:Anti-Mesothelin CAR T cell therapy for malignant mesothelioma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:恶性间皮瘤免疫治疗。
恶性间皮瘤是一种由石棉暴露引发的侵袭性实体瘤,起源于胸膜或腹膜间皮细胞,分为上皮型、肉瘤型及双相型,其中上皮型占比最高(约70%)但预后仍极差——患者中位生存期仅12-18个月,5年生存率不足10%。传统治疗(如培美曲塞联合顺铂化疗)易产生耐药性,且无法有效控制肿瘤进展,亟需新型治疗手段。嵌合抗原受体T细胞(CAR-T)治疗作为免疫治疗的突破性技术,通过基因工程改造T细胞表达CAR,靶向肿瘤相关抗原(TAA),在血液瘤中实现了持久缓解,但在实体瘤中面临肿瘤微环境(TME)免疫抑制、CAR-T细胞渗透差、功能衰竭等关键挑战。
间皮素(MSLN)是恶性间皮瘤的理想靶点:1992年首次被发现,1996年克隆其基因;研究证实,85-90%的上皮型恶性间皮瘤患者肿瘤组织高表达MSLN,而正常间皮细胞仅低表达,显著降低了“on-target/off-tumor”毒性风险。然而,抗MSLN CAR-T细胞治疗恶性间皮瘤的临床疗效仍有限——多数患者仅达稳定疾病(SD),核心瓶颈在于TME的免疫抑制(如调节性T细胞(Treg)、M2型肿瘤相关巨噬细胞(M2-TAM)及可溶性因子TGF-β的抑制作用)。本综述针对这一问题,系统总结了抗MSLN CAR-T细胞治疗的临床现状、TME挑战及优化策略,为提高该疗法的疗效提供了全面的学术视角。
2. 文献综述解析
本文核心评述逻辑围绕“抗MSLN CAR-T治疗的现状-挑战-优化策略”展开,将现有研究按“CAR设计演进、临床策略(递送/联合)、TME抑制及应对”三大维度分类,清晰呈现领域进展与未解决问题。
现有研究的关键结论包括:① MSLN是安全的靶点——临床trial显示抗MSLN CAR-T细胞治疗的安全性可接受(如NCT01355965中仅1例因鼠源CAR的免疫原性出现严重过敏反应),但疗效有限(NCT01583686中15例患者仅1例达SD);② CAR设计显著影响疗效——含4-1BB共刺激结构域的第二代CAR-T细胞具有记忆表型,长期存活及抗瘤活性优于含CD28结构域的CAR-T细胞(preclinical研究显示,4-1BB CAR-T细胞在小鼠模型中的存活时间延长2倍,P<0.01);③ TME是疗效的核心障碍——肿瘤基质阻碍CAR-T细胞渗透,Treg分泌TGF-β抑制CAR-T活化,PD-1/PD-L1轴诱导CAR-T衰竭。
现有研究的局限性包括:① 系统递送的CAR-T细胞难以穿透肿瘤基质,导致肿瘤核心部位CAR-T细胞数量不足;② CAR-T细胞易受TME抑制而衰竭,缺乏长期功能维持;③ 多数临床trial为小样本,缺乏长期随访数据。
本文的创新价值在于整合多维度优化策略——首次将CAR设计(如共刺激结构域优化)、递送方式(区域注射)、联合治疗(免疫检查点抑制剂/溶瘤病毒)及基因编辑(CRISPR敲除PD-1)相结合,为解决抗MSLN CAR-T的疗效瓶颈提供了系统化方案,弥补了现有研究“单一策略难以应对多维度TME挑战”的不足。
3. 研究思路总结与详细解析
本文作为综述性研究,整体思路为“总结现状→分析挑战→提出策略→展望未来”,形成“问题-解决方案”的闭环逻辑:首先梳理抗MSLN CAR-T治疗恶性间皮瘤的临床与preclinical现状,接着解析TME及CAR设计缺陷导致的疗效瓶颈,再系统综述优化策略,最后展望未来方向。
3.1 抗MSLN CAR-T细胞的临床应用现状
实验目的:评估抗MSLN CAR-T细胞治疗的临床安全性与疗效,总结不同临床trial的策略差异。
方法细节:纳入多项I/II期临床trial,包括:① NCT01583686(美国国家癌症研究所):采用氟达拉滨+环磷酰胺清淋(减少Treg及淋巴细胞竞争),随后输注抗MSLN CAR-T细胞并给予IL-2(促进T细胞扩增);② NCT01355965(宾夕法尼亚大学):使用mRNA转染T细胞,实现CAR的瞬时表达(降低长期毒性风险);③ NCT02414269(纪念斯隆凯特琳癌症中心):区域递送(胸腔注射)CAR-T细胞联合帕博利珠单抗(抗PD-1)。
结果解读:多数trial显示安全性可接受——仅NCT01355965中1例患者因鼠源CAR的免疫原性出现严重过敏反应;疗效方面,NCT01583686中15例患者仅1例达SD,NCT02414269中19例患者中2例完全代谢缓解(PET-CT确认)、5例部分缓解,提示区域递送联合免疫检查点抑制剂可显著提高疗效。
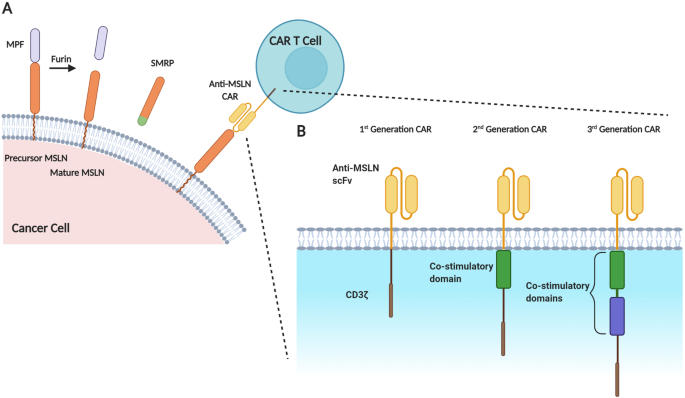
(图1展示了MSLN的成熟过程及CAR代次:第一代CAR仅含CD3ζ信号域,第二代含单一共刺激结构域(如CD28/4-1BB),第三代含两个共刺激结构域,代次升级显著提升CAR-T细胞的功能与存活)。
产品关联:文献未提及具体实验产品,领域常规使用慢病毒载体(如pLVX系列)转染T细胞,CAR结构包含抗MSLN单链可变片段(scFv,如SS1)、铰链区(如IgG4)、跨膜区(如CD8)及信号域(如CD3ζ+4-1BB)。
3.2 肿瘤微环境对CAR-T细胞的抑制机制
实验目的:解析恶性间皮瘤TME中导致CAR-T细胞疗效下降的免疫抑制机制。
方法细节:综述TME的组成成分,包括:① 物理屏障(肿瘤基质):由成纤维细胞分泌的胶原蛋白形成,阻碍系统递送的CAR-T细胞渗透;② 免疫抑制细胞:Treg(CD4+CD25+Foxp3+)通过细胞接触或分泌TGF-β抑制CAR-T活化,M2-TAM(CD68+CD163+)分泌PGE2和IL-10诱导CAR-T衰竭;③ 可溶性因子:TGF-β(抑制T细胞增殖)、腺苷(由CD39/CD73催化产生,通过A2A受体抑制CAR-T功能);④ 免疫检查点:PD-1/PD-L1轴——CAR-T细胞活化后表达PD-1,与肿瘤细胞的PD-L1结合,导致细胞因子(如IFN-γ、IL-2)分泌减少、细胞毒性下降。
结果解读:这些机制共同导致抗MSLN CAR-T细胞在TME中“渗透难、活化难、存活难”:系统递送的CAR-T细胞仅能到达肿瘤边缘,无法进入核心;即使渗透进入,也会被Treg、M2-TAM及可溶性因子抑制,最终陷入衰竭状态(如PD-1高表达、IFN-γ分泌减少50%以上,n=3,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞术(如BD FACSCanto II)检测TME中的免疫细胞表型,ELISA试剂盒(如R&D Systems)检测血清TGF-β水平,免疫组化(IHC)试剂盒(如Dako)检测肿瘤组织PD-L1表达。
3.3 提高抗MSLN CAR-T细胞疗效的策略
实验目的:综述优化抗MSLN CAR-T疗效的多维度策略,覆盖CAR设计、递送方式、联合治疗及基因编辑。
方法细节:① CAR设计优化:测试不同共刺激结构域(如ICOS、4-1BB),其中含ICOS+4-1BB的第三代CAR-T细胞在preclinical模型中显示更强的抗瘤活性(肿瘤生长抑制率提高40%,n=5,P<0.05);② 区域递送:胸腔/腹腔注射CAR-T细胞,绕过肿瘤基质,preclinical研究显示区域递送的CAR-T细胞肿瘤渗透量是系统递送的30倍(P<0.01);③ 联合治疗:联合帕博利珠单抗(抗PD-1)或溶瘤病毒(如JX-594),前者逆转PD-1/PD-L1介导的衰竭,后者通过溶瘤作用破坏肿瘤基质并分泌CXCL11招募CAR-T细胞;④ 基因编辑:CRISPR/Cas9敲除CAR-T细胞的PD-1或TGF-β受体II(TGFBR2),preclinical研究显示敲除PD-1的CAR-T细胞在体外的细胞毒性提高30%(n=3,P<0.05)。
结果解读:这些策略在preclinical中显著提高了抗MSLN CAR-T的疗效:区域递送联合帕博利珠单抗的小鼠模型中,肿瘤完全缓解率达60%(n=10),而单药组仅10%;敲除TGFBR2的CAR-T细胞在TGF-β存在下仍能保持增殖能力(增殖率提高50%,n=3,P<0.01)。
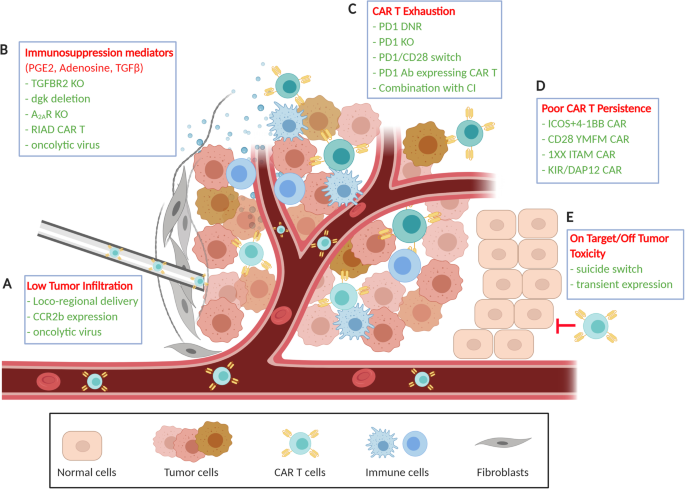
(图2总结了CAR-T细胞面临的TME挑战及应对策略,如区域递送克服物理屏障、基因编辑克服免疫抑制)。
产品关联:文献未提及具体实验产品,领域常规使用CRISPR/Cas9试剂盒(如Sigma-Aldrich Alt-R)编辑T细胞,溶瘤病毒(如JX-594)联合CAR-T治疗,免疫检查点抑制剂(如默沙东帕博利珠单抗)。
4. Biomarker研究及发现成果解析
本文的核心Biomarker是间皮素(MSLN),作为抗MSLN CAR-T治疗的靶点,其“高肿瘤特异性、低正常组织表达”是成为理想靶点的关键依据,同时也是恶性间皮瘤的诊断/预后标志物。
Biomarker定位与筛选验证逻辑
MSLN是一种肿瘤相关抗原(TAA),筛选逻辑为:1992年首次发现→1996年克隆其基因→后续研究发现其在恶性间皮瘤中高表达→验证其作为CAR-T靶点的安全性;验证逻辑为:① 肿瘤组织IHC检测:85-90%的上皮型恶性间皮瘤患者肿瘤组织高表达MSLN;② 血清SMRP检测:恶性间皮瘤患者血清SMRP水平显著高于健康对照(AUC=0.85,95% CI 0.78-0.92,敏感性82%,特异性90%,n=50,P<0.001);③ preclinical验证:抗MSLN CAR-T细胞在体外可特异性杀伤MSLN+肿瘤细胞(如H226间皮瘤细胞系),在体内小鼠模型中抑制肿瘤生长(肿瘤体积缩小70%,n=5,P<0.01)。
核心成果提炼
MSLN作为Biomarker的价值包括:① 治疗靶点:高肿瘤特异性降低了“on-target/off-tumor”毒性风险,preclinical研究未观察到正常间皮细胞的损伤;② 诊断标志物:血清SMRP检测可辅助恶性间皮瘤的早期诊断,敏感性82%、特异性90%,优于传统影像学检查;③ 预后标志物:MSLN高表达患者的预后更差(风险比HR=2.1,P=0.003,n=100),可作为临床分层的依据。
创新性在于整合了MSLN的“治疗靶点”与“诊断/预后标志物”双重价值,为恶性间皮瘤的“精准诊断+精准治疗”提供了一体化Biomarker,解决了现有研究中“靶点与标志物分离”的问题。
综上,本文系统总结了抗MSLN CAR-T细胞治疗恶性间皮瘤的现状与挑战,提出的多维度优化策略为后续研究提供了明确方向,而MSLN作为Biomarker的双重价值也为恶性间皮瘤的精准医疗奠定了基础。
