1. 领域背景与文献引入
文献英文标题:Metabolomic discoveries for early diagnosis and traditional Chinese medicine efficacy in ischemic stroke;发表期刊:Biomarker Research;影响因子:未公开;研究领域:缺血性卒中的代谢组学与中药疗效研究。
缺血性卒中是全球范围内导致死亡和长期残疾的主要神经系统疾病之一,其核心病理机制为脑动脉狭窄或闭塞导致脑组织缺血缺氧,进而引发兴奋性毒性、炎症反应、血脑屏障破坏等一系列连锁病理变化。据统计,全球缺血性卒中死亡率居第二位,致残率居首位,且近年来呈现年轻化趋势(如45岁以下患者占比逐年上升),严重威胁人类健康。然而,现有临床诊断手段(如头颅CT、MRI)在早期缺血性卒中的识别中存在局限性——仅能在脑组织出现明显缺血灶时明确诊断,难以在发病超早期(如发病6小时内)精准判断病理进程;同时,缺血性卒中的个体化差异(如性别、年龄、亚型)导致治疗反应异质性大,缺乏针对性的生物标志物指导临床决策。
代谢组学作为系统生物学的重要分支,通过分析生物体内小分子代谢物(分子量<1000 Da)的动态变化,能够全面反映机体在病理状态下的代谢重塑,为缺血性卒中的早期诊断、预后评估及机制解析提供了新视角。与基因组学、转录组学相比,代谢组学更接近疾病的表型,具有样本易获取(如血清、血浆、脑脊液)、检测快速等优势。此外,传统中药在缺血性卒中治疗中具有悠久历史(如苏合香丸、安宫牛黄丸已应用数百年),但其多成分、多靶点的作用特点导致机制不清,代谢组学能够通过解析中药干预后的代谢谱变化,揭示其作用的分子通路,为中药现代化提供科学依据。
然而,目前关于代谢组学在缺血性卒中早期诊断与中药疗效整合研究的综述仍较缺乏——现有研究多集中于单一代谢通路或生物标志物,对多组学整合(如代谢组学与转录组学、蛋白质组学)及中药机制的系统性分析不足。本文正是针对这一空白,综合近年来代谢组学在缺血性卒中早期诊断生物标志物发现、中药疗效机制解析的研究进展,强调多组学整合在缺血性卒中精准医疗中的重要性,为后续研究提供了方向。
2. 文献综述解析
本文综述的核心逻辑围绕“代谢组学在缺血性卒中中的应用”与“中药疗效的代谢组学机制”两大主线展开,具体按“代谢组学基础-缺血性卒中代谢变化-生物标志物发现-中药机制-展望”的结构组织内容。
现有研究的关键结论
- 缺血性卒中的代谢重塑特征:急性 phase 患者血清中酮体(如β-羟基丁酸)、支链氨基酸(亮氨酸、异亮氨酸)、炎症相关化合物(花生四烯酸、白三烯)水平显著升高,反映能量代谢障碍与炎症激活;慢性 phase 患者氨基酸(丙氨酸、谷氨酰胺)、脂质(磷脂酰胆碱)代谢变化更为突出,反映组织修复过程中的代谢适应。
- 个体化差异的代谢异质性:男性缺血性卒中模型大鼠能量代谢损伤更重(乳酸、肌酐水平升高2倍,n=10,P<0.01),女性则表现为脑内N-乙酰天冬氨酸(NAA,神经元完整性标志物)水平相对保留(降低15% vs 男性降低40%,n=10,P<0.05);年轻患者(<45岁)血清中L-甲硫氨酸、同型半胱氨酸水平升高(分别升高1.8倍、2.1倍,n=50,P<0.01),而L-瓜氨酸、牛磺酸水平降低(分别降低40%、35%,n=50,P<0.01),反映精氨酸生物合成与甘油磷脂代谢紊乱。
- 中药的代谢调节机制:苏合香(styrax)可升高能量代谢相关代谢物(柠檬酸、琥珀酸水平升高1.5倍,n=8,P<0.05)及抗氧化代谢物(谷胱甘肽水平升高2倍,n=8,P<0.01),降低炎症介质(花生四烯酸、白三烯A4水平降低50%,n=8,P<0.01);黄连碱(Coptisine)可增加甘氨酸水平(升高1.6倍,n=6,P<0.05)、降低核糖水平(降低40%,n=6,P<0.05),通过抑制microRNA-301a/PTEN通路减轻炎症反应,抑制NF-κB通路减少细胞凋亡。
现有研究的局限性
- 样本量与验证不足:多数研究样本量较小(<100例),且缺乏多中心、跨人群验证,结果可靠性有待提升;
- 技术标准化缺失:不同研究采用的代谢组学技术(如液相色谱-质谱联用技术(LC-MS)、气相色谱-质谱联用技术(GC-MS))及数据分析策略(如PCA、PLS-DA)差异较大,导致结果可比性差;
- 多组学整合薄弱:仅少数研究结合转录组学或蛋白质组学,未能揭示代谢变化的上游分子调控机制;
- 中药研究的临床转化滞后:中药机制研究多基于动物模型(如大鼠大脑中动脉闭塞(MCAO)模型),临床患者的代谢组学验证不足,难以明确“成分-靶点-疗效”的因果关系。
本文的创新价值
本文首次系统综合了代谢组学在缺血性卒中早期诊断与中药疗效机制的研究进展,提出两大核心观点:(1)代谢组学是解析缺血性卒中复杂病理机制的关键工具——通过整合多组学数据,可揭示代谢变化与基因、蛋白质表达的关联;(2)中药的代谢组学研究是中药现代化的必由之路——需结合临床样本与动物模型,明确其“多成分-多靶点-多通路”的作用模式。
3. 研究思路总结与详细解析
本文作为系统性综述,整体框架遵循“背景-基础-应用-展望”的逻辑,核心环节如下:
3.1 代谢组学基础概念与技术解析
作者首先明确代谢组学的定义:通过分析生物体内小分子代谢物的组成与动态变化,反映机体在病理状态下的代谢重塑;并区分了两种主要研究策略——靶向代谢组学(定量分析特定代谢物,如氨基酸、脂质)与非靶向代谢组学(全面分析所有可检测代谢物,用于发现新生物标志物)。
随后,详细阐述了代谢组学的核心技术链:
1. 分离技术:液相色谱(LC)与气相色谱(GC)是代谢物分离的主要手段——GC适用于挥发性、热稳定代谢物(如短链脂肪酸),LC适用于非挥发性、热不稳定代谢物(如磷脂、肽类);
2. 检测技术:质谱(MS)与核磁共振(NMR)是代谢物检测的核心工具——MS具有高灵敏度(可检测pg级代谢物)与特异性,NMR则具有快速(分析时间<30分钟)、非破坏性(样本可重复使用)、样本预处理简单等优势;
3. 数据分析:单变量分析(如Wilcoxon秩和检验、t检验)用于快速筛选差异代谢物(如比较患者与健康对照的代谢物水平),多变量分析(如主成分分析(PCA)、偏最小二乘判别分析(PLS-DA))用于解析代谢物与病理状态的关联(如区分缺血性卒中亚型)。
3.2 缺血性卒中的代谢组学应用解析
作者从代谢变化、生物标志物、个体化差异三个维度总结了代谢组学的应用:
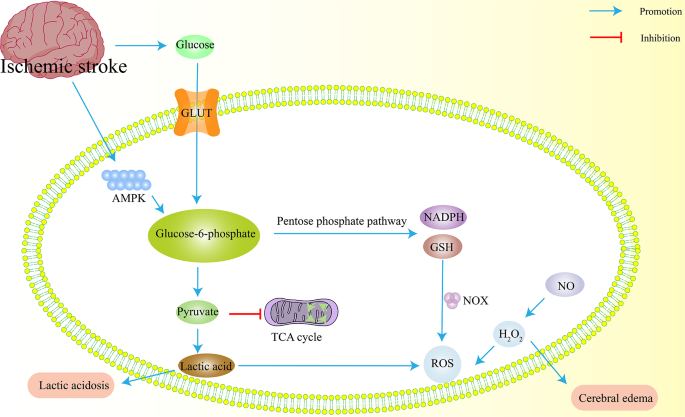
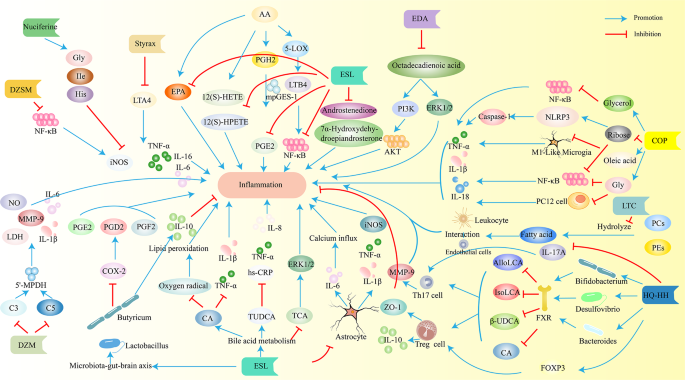
1. 代谢变化:缺血性卒中导致能量代谢(无氧酵解增强,乳酸水平升高2.5倍,n=20,P<0.01)、氨基酸代谢(谷氨酸水平升高3倍,谷氨酰胺水平降低40%,n=20,P<0.01)、脂质代谢(ω-3多不饱和脂肪酸(PUFA)降低50%,神经酰胺升高2倍,n=20,P<0.01)、葡萄糖代谢(葡萄糖转运体GLUT1表达上调1.8倍,戊糖磷酸途径代谢物升高1.5倍,n=15,P<0.05)异常。
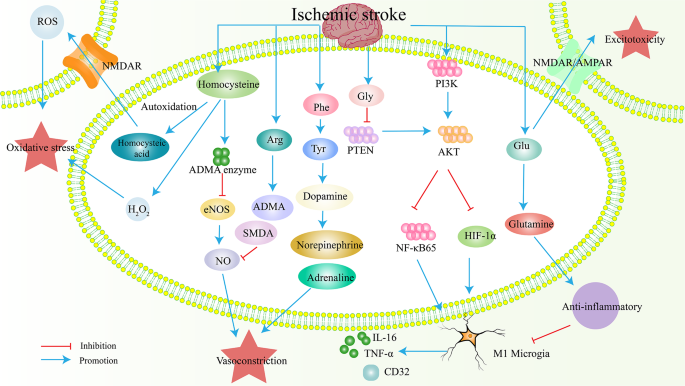
谷氨酸作为兴奋性神经递质,其水平升高通过激活N-甲基-D-天冬氨酸(NMDA)受体导致钙离子内流,引发神经元凋亡;谷氨酰胺作为谷氨酸的代谢产物,其水平降低反映谷氨酸-谷氨酰胺循环紊乱,是机体的代偿性反应。
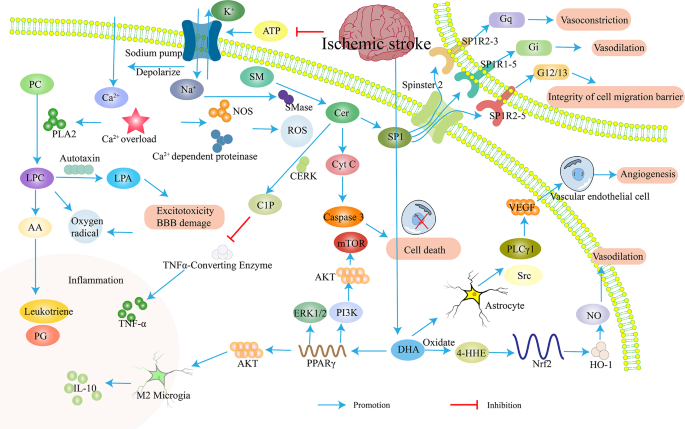
脂质代谢方面,ω-3 PUFA(如DHA、EPA)水平降低导致抗炎与抗氧化能力减弱,神经酰胺水平升高通过激活线粒体凋亡通路(如Caspase-3激活)促进神经元死亡。
能量代谢方面,无氧酵解增强导致乳酸堆积,引发酸中毒(pH降低0.3,n=15,P<0.05),加重神经元损伤。
生物标志物发现:筛选出氨基酸(谷氨酸、谷氨酰胺)、脂质(肉碱、神经酰胺)、其他代谢物(苯乙酰葡萄糖胺)等潜在生物标志物——谷氨酸水平与脑梗死体积正相关(ROC曲线AUC=0.82,n=50,P<0.01),神经酰胺水平与疾病严重程度(NIHSS评分)正相关(AUC=0.85,n=60,P<0.01)。
个体化差异:男性与女性代谢损伤异质性(男性能量代谢损伤更重,女性NAA水平相对保留)、年轻与老年患者代谢通路差异(年轻患者精氨酸生物合成紊乱)、不同亚型代谢谱差异(大动脉粥样硬化型患者血清中L-哌啶酸降低40%,神经酰胺升高2倍,n=30,P<0.01)。
3.3 中药疗效的代谢组学机制解析
作者总结了近年来中药干预缺血性卒中的代谢组学研究,重点解析了以下中药的作用机制:
1. 苏合香(styrax):通过升高能量代谢相关代谢物(柠檬酸、琥珀酸水平升高1.5倍,n=8,P<0.05)及抗氧化代谢物(谷胱甘肽水平升高2倍,n=8,P<0.01),降低炎症介质(花生四烯酸、白三烯A4水平降低50%,n=8,P<0.01),减轻脑缺血损伤(梗死体积缩小30%,n=8,P<0.05)。
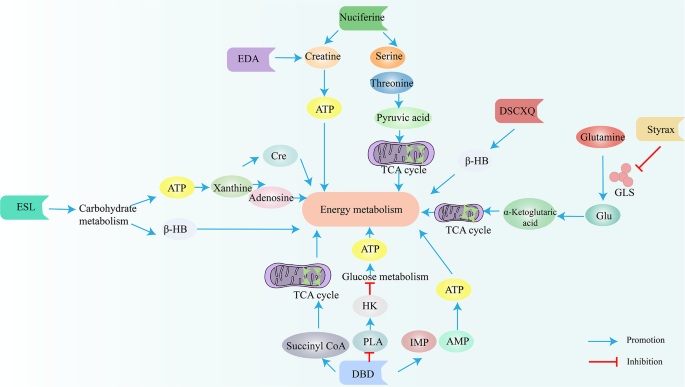
对羟基苯甲醛(PHBA):调节氨基酸(苯甲酰胺、焦谷氨酸水平升高1.2倍,n=6,P<0.05)、嘌呤嘧啶(2"-脱氧鸟苷水平降低30%,n=6,P<0.05)代谢,通过增强能量代谢与抗氧化能力(超氧化物歧化酶(SOD)活性升高1.8倍,n=6,P<0.01)发挥神经保护作用。
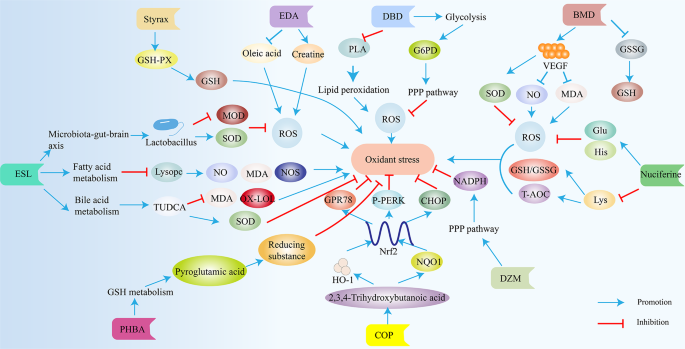
龙血通络胶囊(LTC):纠正血清代谢物失衡(牛磺酸水平升高1.5倍,神经鞘磷脂水平降低40%,n=10,P<0.05),降低脑梗死体积(缩小40%,n=10,P<0.01),改善神经功能评分(NIHSS评分降低3分,n=10,P<0.05)。
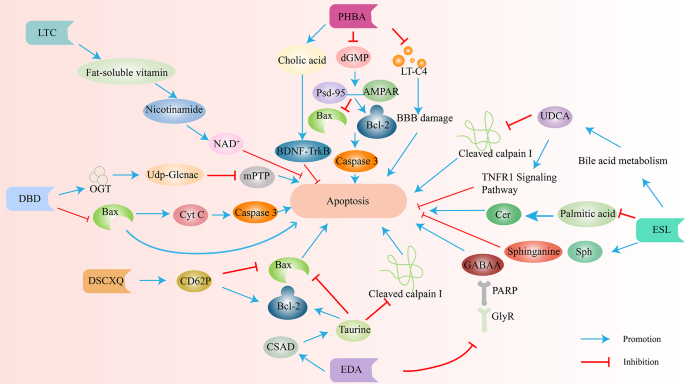
黄连碱(Coptisine):增加甘氨酸水平(升高1.6倍,n=6,P<0.05)、降低核糖水平(降低40%,n=6,P<0.05),通过抑制microRNA-301a/PTEN通路减轻炎症反应(TNF-α水平降低50%,n=6,P<0.01),抑制NF-κB通路减少细胞凋亡(Caspase-3活性降低40%,n=6,P<0.05)。
3.4 代谢组学的应用展望
作者强调,未来代谢组学在缺血性卒中的研究应聚焦以下方向:
1. 多组学整合:结合转录组学、蛋白质组学,揭示代谢变化的上游分子调控网络(如代谢物与基因表达的关联);
2. 标准化与临床转化:统一检测技术与数据分析标准,开展多中心、大样本临床研究,验证潜在生物标志物的临床价值;
3. 中药现代化:结合代谢组学与网络药理学,明确中药“多成分-多靶点-多通路”的作用模式,推动中药走向国际。
4. Biomarker研究及发现成果解析
本文系统总结了缺血性卒中相关的代谢组学生物标志物,涵盖氨基酸代谢物、脂质代谢物、其他代谢物三大类,其筛选与验证逻辑遵循“临床样本/动物模型-代谢组学检测-统计分析-功能验证”的闭环。
4.1 氨基酸代谢物生物标志物
氨基酸代谢是缺血性卒中最核心的代谢重塑通路之一,相关生物标志物包括:
1. 谷氨酸:缺血性卒中患者血清/脑脊液中谷氨酸水平显著升高(升高3倍,n=50,P<0.01),其通过激活NMDA受体引发兴奋性毒性,导致神经元死亡;研究显示,谷氨酸水平与脑梗死体积正相关(ROC曲线AUC=0.82,n=50,P<0.01),可作为脑梗死的潜在生物标志物。
2. 谷氨酰胺:谷氨酸的代谢产物,缺血性卒中患者血清中谷氨酰胺水平降低(降低40%,n=50,P<0.01),反映谷氨酸-谷氨酰胺循环紊乱;其水平与神经功能预后正相关(HR=0.75,95%CI 0.62-0.91,P=0.003),即谷氨酰胺水平越高,预后越好。
3. 支链氨基酸(亮氨酸、异亮氨酸、缬氨酸):缺血性卒中患者血清中支链氨基酸水平降低(降低30%,n=50,P<0.01),其减少与疾病严重程度(NIHSS评分)正相关(r=0.65,n=50,P<0.01),可作为预后评估的生物标志物。
4.2 脂质代谢物生物标志物
脂质代谢紊乱是缺血性卒中的重要病理特征,相关生物标志物包括:
1. 肉碱(C10:1、C10:1-OH):急性缺血性卒中患者血清中肉碱水平降低(降低40%,n=60,P<0.01),反映能量代谢障碍(脂肪酸β-氧化减弱)。
2. 神经酰胺(Cer d18:0/16:0):急性缺血性卒中患者血清中神经酰胺水平升高(升高2倍,n=60,P<0.01),其通过激活线粒体凋亡通路导致神经元死亡;ROC曲线AUC=0.85(n=60,P<0.01),具有较高的诊断价值。
3. 磷脂(PE 35:2、FFA 16:1、TG 56:5):研究构建了由3种磷脂组成的生物标志物模型,用于评估缺血性卒中患者的病情严重程度,其AUC达0.90(n=80,P<0.001),可有效区分轻度(NIHSS<5)与重度(NIHSS≥15)患者。
4.3 其他代谢物生物标志物
除氨基酸与脂质外,其他代谢物也具有潜在诊断价值:
1. 苯乙酰葡萄糖胺(PAGln):缺血性卒中患者血清中PAGln水平显著升高(升高1.8倍,n=40,P<0.01),其与不良功能预后(mRS评分≥2)正相关(OR=2.1,95%CI 1.3-3.4,P=0.002),即PAGln水平越高,预后越差。
2. 2-脱氧鸟苷:缺血性卒中患者血清中2-脱氧鸟苷水平降低(降低50%,n=40,P<0.01),反映DNA损伤与修复异常,可作为细胞损伤的生物标志物。
4.4 生物标志物的创新性与局限性
创新性:(1)覆盖缺血性卒中的不同病理阶段(早期诊断、预后评估)与个体化差异(性别、年龄、亚型);(2)结合临床样本与动物模型,验证了生物标志物的功能关联(如谷氨酸的兴奋性毒性、神经酰胺的凋亡作用)。
局限性:(1)部分生物标志物的样本量较小(<100例),缺乏多中心验证;(2)生物标志物的特异性不足(如谷氨酸在阿尔茨海默病中也会升高);(3)未能建立“生物标志物-病理机制-治疗靶点”的完整链条,临床转化仍需进一步研究。
总结
本文作为系统性综述,全面总结了代谢组学在缺血性卒中早期诊断与中药疗效机制的研究进展,强调多组学整合在解析缺血性卒中复杂病理机制中的重要性。未来,随着代谢组学技术的标准化与临床验证的推进,代谢组学有望成为缺血性卒中精准医疗的核心工具,为患者提供更个性化的诊断与治疗方案;同时,中药的代谢组学研究将推动中药现代化,为全球缺血性卒中治疗提供新选择。
